猕猴桃溃疡病拮抗菌株筛选及田间药效试验
张文娟
(渭南职业技术学院,陕西 渭南 714026)
0 引言
猕猴桃又名奇异果,果肉中富含有糖、多种维生素和氨基酸、有机酸、K+、Mg2+以及相应的色素等等内容,新鲜的猕猴桃可以进行加工,将其加工成果品以及饮料罐头,而且还可以做进一步的开发,同时猕猴桃的籽、叶子、枝条、花等部分都有进一步加工和开发的价值[1,2]。因此,猕猴桃有广阔的市场发展前景和很好的研究价值。但是猕猴桃种植过程中会受病菌感染而出现病害,比如丁香假单胞菌,是导致猕猴桃病变的一种病原菌,可能导致猕猴桃出现一些大面积的病害,猕猴桃溃疡病主要感染树干、枝条、叶片及花,引起枝干溃病或者枝叶萎蔫[3,4]。猕猴桃溃疡自1980年首次在日本报道以来,已在全球猕猴桃栽培区广泛分布,当猕猴桃出现病害的时候,带来的危害较大,会导致果实的产量以及质量出现大面积的下降,继而给生产者带来巨大的经济损失[5,6]。分析导致猕猴桃出现病害的原因,其中一个因素就是大量使用农药导致的抵抗力降低。大量的使用化学方面的农药很容易会使病菌出现一定的耐药性,药物的效力逐渐下降;同时化学农药的大量使用会出现较高的残留,不仅可能污染环境,还可能影响人类的身体健康。因此,迫切需要创制高效、安全、低残留的新型农药,这对于猕猴桃以及相关疾病的抑制都是十分有效的,只有不断地提升病害防治水平,才能保证猕猴桃的种植质量,进而提升猕猴桃生产水平[7,8]。笔者研究采集渭南市猕猴桃健康株,进行内生放线菌的分离纯化,并对猕猴桃溃疡病病菌进行拮抗试验,筛选出拮抗菌株,从生物农药角度为猕猴桃细菌性溃疡病防治工作提供支持。
1 材料与方法
1.1 材料
1.1.1 供试样品 采集地点为陕西省渭南市临渭区贺家村、高李村、华州区3个猕猴桃种植园区,于2018年4-5月份采集健康猕猴桃植株的枝条和叶片等组织,样品共计29份。
1.1.2 病原菌 猕猴桃溃疡病菌(Pseudomonassyringaepv.actinidiae,Psa)由西北农林科技大学植物病理研究室提供。
1.1.3 培养基 淀粉酪素培养基:可溶性淀粉 10.0 g,K2HPO42.0 g,KNO32.0 g,NaCl 2.0 g,Casein 0.3 g,MgSO47H2O 0.05 g,CaCO30.02 g,FeSO47H2O 0.01 g,琼脂粉 15.0 g,H2O 1 000 mL。
小米发酵培养基:葡萄糖 10.0 g,小米 10.0 g, NaCl 2.5 g,蛋白胨3.0 g,CaCO31.0 g,(NH4)2SO41.0 g,H2O 1 000 mL,pH7.2。
高氏一号合成培养基、牛肉膏蛋白胨培养基。
1.1.4 主要试剂 HPD系列大孔树脂、分析纯甲醇、乙酸乙酯等(汕头西陇化工厂)、氨苄青霉素(Ampicillin)为生化试剂。
1.2 方法
1.2.1 内生放线菌的分离、纯化 用蒸馏水将样品清洗干净、自然晾干备用。使用打孔器切割叶片,使其成为直径确定的小圆片。用无菌处理的枝剪将枝条剪成0.6 cm两端均有切口的小段,按照组织块表面消毒法,枝条:75%酒精冲洗3次→3.5%次氯酸钠冲洗4次→75%酒精冲洗3次;叶片:75%酒精冲洗1次→3.5%次氯酸钠冲洗2次→75%酒精冲洗1次,对组织表面进行消毒。消毒结束后即刻用无菌水清洗3次,末次清洗液取1 000 μL加入淀粉酪素培养基和高氏一号合成培养基制成的平板中,涂布均匀,置于28℃培养箱中,培养3 d,观察表面是否有菌落长出,以检测消毒是否彻底。
将表面消毒的组织块无菌条件下贴在淀粉酪素培养基和高氏一号合成培养基制成的平板中,每皿贴4份,放置在28℃的培养箱中培养,等待菌株长出菌落,然后采集菌落开展菌株的纯化工作,最后将纯化处理之后的菌株在培养基斜面上进行保存、备用。
1.2.2 内生放线菌的拮抗实验 内生放线菌的液体发酵:在250 mL 三角瓶中装入50 mL 小米培养基,灭菌,冷却。接种各纯化菌株到培养瓶中,置入28℃摇床,以180 r·min-1转速培养5 d。过滤发酵液并收集滤液,4℃保藏备用。
活性测定:测定各菌株发酵液对猕猴桃溃疡病的抑菌活性采用管碟法。将供试细菌猕猴桃溃疡病菌制成浓度为1×106菌悬液,取1 mL菌悬液与9 mL的牛肉膏蛋白胨培养基充分混匀,制成带菌平板,各平板等距离放置牛津杯5个,各加发酵液 200 μL,37℃培养 24 h ,测量抑菌圈直径,每处理重复3次。
1.2.3 WN34菌株发酵液活性粗提物制备 大孔吸附树脂的选择:取6份100 mL过滤好的菌株发酵液分别用预处理过的20 mL(湿体积)HPD100、HPD300、HPD400、HPD500、HPD600、HPD750大孔吸附树脂静态吸附,重复三次。12 h后装入层析柱,先用少量蒸馏水洗去杂质,然后分别用甲醇洗脱(解吸)。将甲醇洗脱液定容至一定体积,采用管碟法、滤纸片法对残留液、甲醇洗脱液进行以猕猴桃溃疡病病菌为指示菌的抑菌活性试验。
针对这个问题,我们在课后进行了探讨,最后得到一致结论,那就是我们在选取视频的时候只注重了上课内容本身,没有关注学生的兴趣点,从而造成了课前师生互动的脱节,以至于整个教学系统在这个阶段就已经崩塌了。
树脂的动态饱和吸附量考察:取已处理好的HPD100树脂20 mL(湿体积)装柱,将准备好的菌株发酵液缓慢加入层析柱中,通过液用三角瓶收集并编号,每份100 mL,流速约为2 mL·min-1,采用管碟法对收集的各馏分进行以猕猴桃溃疡病病菌为指示菌的抑菌活性试验。
活性粗提物的制备:将90L发酵液经HPD100树脂富集,用40%,60%,100%甲醇水梯度洗脱,100%甲醇馏分浓缩至一定体积即为活性粗提物。
1.2.4 WN34 菌株的大田实验 田间病害防治实验于 2018年 2 月下旬在渭南市临渭区猕猴桃园进行,以全株喷雾和涂抹枝干的方法进行防效实验,被试猕猴桃品种为徐香。①喷雾法: 分别用WN菌株发酵液粗提物稀释液(浓度为原发酵液浓度),进行全株喷施,每组处理发病株 10 株,间隔 7 d 喷药 1 次,连续4 次。分别于7 d、14 d、21 d、28 d调查各个处理树枝的病斑愈合情况,计算相对防效。以45%代森铵150倍稀释液和清水为对照[9,10]。②涂抹法: 在施药前,先用刀将植株发病部位的树皮刮除,然后再涂抹WN菌株发酵液粗提物稀释液(浓度为原发酵液浓度),每组处理发病株10株,以45%代森铵150倍稀释液和清水为对照。涂抹药剂6个月后调查病斑愈合情况,以病斑处产生愈合组织为愈合病斑的依据,计算防治效果[11]。
病斑愈合率=(防治后病斑愈合数/防治前病斑总数)×100%
防治效果=[(处理区病斑愈合率-对照区病斑愈合率)/(1-对照区病斑愈合率)]×100%
2 结果与分析
2.1 内生放线菌的分离及拮抗实验结果
实验结果显示,最后一次清洗液加入淀粉酪素培养基和高氏一号合成培养基制成的平板中,涂布均匀,置于28℃培养箱中,培养3 d,表面未观察到菌落,说明表面消毒效果良好。从采集的猕猴桃植株的枝条和叶片等组织分离得到37株内生放线菌,其中从枝条组织中分离得到8株,叶片组织中分离得到29株。采用管碟法测定各菌株发酵液对Psa的抑菌活性,实验结果见表1。

表1 初筛拮抗菌发酵液对猕猴桃溃疡病菌的抑制活性
备注:"+++"表示抑菌圈非常清晰,"++"表示抑菌圈比较清晰。
2.2 WN34菌株的大田实验结果
采用喷雾法进行田间试验的结果见表2。从表2可知,在喷药14 d、21 d、28 d内,WN34菌株发酵液粗提物对猕猴桃溃疡病都有较好的治疗效果,防效优于阳性对照45%代森铵,并且随着时间的推移有一定程度的提高,在喷药28 d后,WN34菌株发酵液粗提活性物对猕猴桃溃疡病的防效提高至66.0%。采用涂抹法进行田间试验的结果见表3。从表3可知,在涂抹药剂后,WN34菌株发酵液粗提活性物对猕猴桃溃疡病的防治效果为78.2%,优于阳性对照45%代森铵。并且在实验中观察发现,涂抹药剂6个月后病斑出现愈合现象,并且在病斑处后形成愈合层。说明WN34菌株发酵液对猕猴桃溃疡病有较好的防治效果。
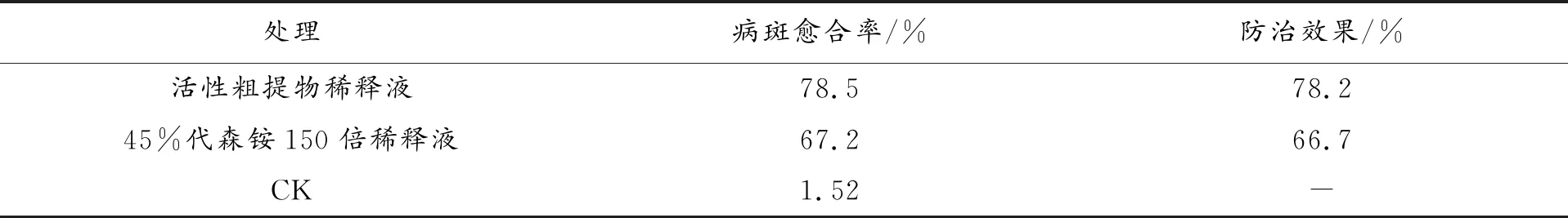
表3 菌株WN34发酵液活性粗提物涂抹法对猕猴桃溃疡病的田间防治效果
3 结论
研究从采集的猕猴桃植株的枝条和叶片等组织分离得到37株内生放线菌,其中从枝条组织中分离得到8株,叶片组织中分离得到29株,其中8株内生放线菌的发酵液表现出对Psa有较强的抑制作用。说明叶片组织中内生放线菌多于枝条组织中的内生放线菌。采用管碟法测定WN34菌株发酵液对Psa的抑菌活性,抑菌圈直径达到21 mm。
田间试验结果表明:采用喷雾法,WN34菌株发酵液粗提活性物对猕猴桃溃疡病有较好的治疗效果,在喷药28 d后,防效达到66.0%。采用涂抹法,WN34菌株发酵液粗提活性物防效为78.2%,优于阳性对照45%代森铵。并且在实验中观察发现,涂抹药剂6个月后病斑出现愈合现象,并且在病斑处后形成愈合层。说明WN34菌株发酵液对猕猴桃溃疡病有较好的防治效果。
4 讨论
内生菌具有一定的多样性,植物的种类、生长年限以及培养过程等因素对其的成长都有一定影响。笔者在筛选猕猴桃内生放线菌时发现不同部位内生菌数量差异显著,其中叶片中的内生放线菌多于枝干样品。可能原因为叶片相对于枝干表面积大,与外界物质交换机会多,微生物更有可能进入植物组织。也有学者认为植物内生菌是通过植物体表面、根际的自然孔口或伤口等进入组织内部。笔者使用淀粉酪素和高氏一号两种培养基来分离筛选猕猴桃组织中的内生放线菌,目的是尽量多的得到不同种类的内生放线菌,但即使使用不同种类的培养基,也不能确保将植物组织中所有的内生放线菌全部分离出来,并且有些内生菌不能在离体条件下生长,有些内生菌生长较慢,会被生长相对较快的菌株覆盖,导致分离得到菌株有所遗漏。
笔者采用喷雾法和涂抹法两种方法进行田间试验,结果表明涂抹法防治效果(78.2%)优于喷雾法(66.0%)。可能是因为涂抹法在实施过程中是将病斑部位的组织刮除后再涂抹药剂,缩短药剂与病原菌接触时间,快速抑制病情发展,避免外界气候条件的影响,故优于喷雾法。WN34菌株发酵液作为一种新型的抗猕猴桃溃疡病生物防治药剂开发,有很好的潜力。

