吲哚美辛/β-环糊精/尤特奇结肠靶向纳米粒制备及体外释放
尹海梦,王丹,林辉焕,季金苟*,郝石磊
(1.重庆大学 化学化工学院制药工程系,重庆 401331;2.重庆大学 生物工程学院,重庆 400030)
口服结肠定位给药系统是一种通过制剂学手段使药物在上消化道保持完整,达到结肠部位才发挥作用的给药系统,是目前制剂领域的研究热点之一[1-2]。吲哚美辛(Indomethacin,IDM)是一种非甾体类抗炎药,具有解热、镇痛和抗炎作用,同时具有抗结肠癌的作用[3-4]。但IDM几乎不溶于水,因而具有口服吸收不好、生物利用度低和胃肠道不良反应大等问题[5-6]。
β-环糊精(β-Cyclodextrin,β-CD)是一类环状寡糖,具有疏水性内部空腔和亲水性外部结构,这一独特结构允许疏水分子或疏水部分通过非共价键被包合进空腔以此来形成水溶性包合物,从而起到增溶、缓释和增加稳定性的作用[7]。尤特奇S100(Eudragit S100,ES100)为甲基丙烯酸和甲基丙烯酸甲酯(1︰2)共聚物,在pH>7的介质中溶解,是理想的pH依赖性聚合物之一[8],因而具有pH触发的胃肠道靶向性。纳米制剂由于其纳米效应,对肿瘤或炎性组织具有被动靶向性[9],因而能增加肿瘤部位或炎性部位的局部药物浓度。另外,纳米颗粒还具有增加药物稳定性,减少药物毒副作用的功能[10-11]。本文为了增加IDM的水溶性,同时减少其对胃肠道的毒副作用,利用β-CD为载体,包合IDM,并外包肠溶性ES100,制备成纳米制剂,以期为肠肿瘤或肠炎设计出更为理想的新剂型。
1 材料与方法
1.1 仪器和试剂
1.1.1 仪器
Nano ZS90 Zetasizer激 光 粒 度 测 定 仪(Laser particle size analyzer,LPSA),英国马尔文公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;TG-16高速离心机,巩义市裕华仪器厂;FD-1冷冻干燥机,北京德天佑科技发展有限公司;HJ-4A调速磁力搅拌器,巩义市裕华仪器厂;JSM-7800F扫描电子显微镜(SEM),日本日立制作所;XRD 6000 X-射线衍射光谱分析仪(X-ray diffractometer,XRD),日本岛津制作所。
1.1.2 试剂
IDM,上海阿达玛斯有限公司;β-CD,重庆川东化工集团有限公司;ES100,德国罗姆公司;乙醇,重庆川东化工集团有限公司;盐酸,重庆川东化工集团有限公司;液体石蜡,成都科龙化工试剂厂;Span80,成都科龙化工试剂厂;磷酸二氢钠,医药集团化学试剂有限司;磷酸氢二钠,医药集团化学试剂有限公司;蒸馏水。本实验所用试剂均为分析纯。
1.2 实验方法
1.2.1 标准曲线的绘制
称取适量IDM,溶解于pH 7.8的磷酸盐缓冲液(PBS)中配制成一系列不同浓度的溶液,用紫外可见分光光度计在320 nm处测定吸光度(A),并绘制IDM在pH 7.8的PBS中的标准曲线。
1.2.2 β-CD的相溶解度
相溶解度实验采用Higuchi和Connors报导的方法[12]进行,称取不同量的β-CD溶解于30 mL乙醇水溶液(乙醇︰水=3︰2)中,再分别加入过量的IDM,并称重,记为m。将上述体系置于50 ℃水浴中,恒温搅拌,使溶液中的乙醇挥发,每隔1 h称重,并补入相应的蒸馏水维持体系的质量为m,反应12 h。抽滤,收集上清液,用磷酸二氢钠和磷酸氢二钠调pH至7.8,用紫外可见分光光度计在320 nm处测得A,通过标准曲线计算上清液中IDM的含量,并绘制相溶解度曲线图。
1.2.3 IDM/β-CD包合物的制备
通常情况下,谷物原料如玉米需经过粉碎加工后用于配制饲料,主要是可以增加饲料与消化液的接触面积[8],提高饲料的利用率,从而提高动物的生产性能。本试验在蛋鸡产蛋期极显著改善了产蛋率,平均蛋重,平均采食量,料蛋比和不合格蛋率。饲料营养均衡,有效促进蛋鸡消化与提高生产性能。
包合物采用饱和溶液法[13-14]制备,根据相溶解度图,分别精密称取适量的IDM和β-CD,根据1.2.2所述方法制备IDM/β-CD包合物混悬液,抽滤,并用乙醇洗涤,真空干燥24 h,得IDM/β-CD包合物。
1.2.4 IDM/β-CD/ES100纳米粒的制备
通过乳化溶剂挥发法对IDM/β-CD进行包衣,制备IDM/β-CD/ES100纳米粒,如图1所示为IDM/β-CD/ES100纳米粒的制备方法示意图。25 mL含有2% Span80的液体石蜡作为连续相,IDM/β-CD与ES100质量比为1︰1、1︰1.5和1︰2,分别分散于3 mL丙酮中作为分散相。将上述分散相在快速搅拌下逐滴滴加入连续相中,搅拌30 min。再将上述体系于 35 ℃、真空、200 r/min 条件下搅拌 3 h,使丙酮挥发。抽滤,并用正己烷洗去残留外液,再真空干燥24 h,得 IDM/β-CD/ES100 纳米粒。
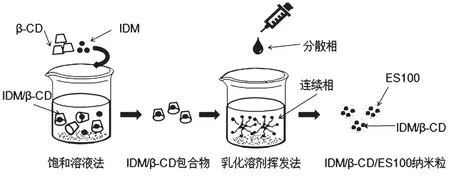
图1 IDM/β-CD/ES100纳米粒的制备方法示意图
1.2.5 包封率和载药量的测定
精密称取IDM/β-CD/ES100纳米粒适量,溶解于适量pH 7.8的PBS中,并置于37 ℃恒温振荡器中透析48 h,以保证IDM/β-CD完全释放。用紫外可见分光光度计测定透析袋外部溶液的吸光度A,通过标准曲线计算溶液中IDM/β-CD的含量。纳米粒载药量(Drug loading capacity,LC)及包封率(Encapsulation efficiency,EE)计算方法如式1和式2所示。

式中:WA为初始投药量,WB为上清液中含药量,WS为纳米粒质量。
1.2.6 IDM/β-CD/ES100纳米粒的表征
(1)粒径和Zeta电位的测定:IDM/β-CD/ES100纳米粒的粒径、Zeta电位以及多分散指数(Particle dispersion index,PDI)使用LPSA 进行测定(n=3)。(2)形貌观察:微球的表面形态通过SEM进行观察。(3)X-射线衍射光谱分析:使用XRD分别对IDM、ES100、β-CD和纳米粒粉末进行扫描,以观察晶型变化,扫描范围为5°~60°。
一般来说,口服药物在胃中的运转时间为2 h,在小肠中的运转时间为2 h,而后到达结肠。因此,本研究采用的体外释放实验先在胃液环境(pH 1.2的 HCl)中进行释放 2 h,再在小肠环境(pH 6.8的PBS)中释放 2 h,最后转移至结肠环境(pH 7.8的PBS)中释放,以准确观察纳米粒在人体消化道pH变化环境中的体外释放情况[15]。
取适量纳米粒分散于 5 mL pH 1.2 的盐酸溶液中,并将此溶液装入透析袋,放置于 25 mL pH 1.2 的盐酸溶液中;2 h后转入pH 6.8的PBS中,再经2 h转入pH 7.8的PBS中分别进行释药[16],上述3个过程均在37 ℃水浴恒温震荡器中完成。定时取样5 mL,同时补加相应体积的外液,对pH 1.2和pH 6.8的取出液,先将其pH值调整至7.8,再于320 nm波长处测定取出液的吸光度A,按照标准曲线计算取出样品中的IDM/β-CD含量,绘制药物的累积释放曲线。
2 结果与讨论
2.1 标准曲线的绘制
IDM在pH 7.8的PBS中的标准曲线如图2所示,A=0.020 2C-0.007 8(R2=0.999 7),线性关系良好,线性范围 7.24~72.40 μg/mL。

图2 IDM在pH 7.8的PBS中的标准曲线
2.2 相溶解度图
从图3相溶解度图可以算出,相溶解度曲线为:b=0.346a+0.318(R2=0.983 2);S0=0.318 mmol/L,包和常数K=1 663.7,K值越大,表明此包合物越稳定。同时,从图3可以看出,IDM随β-CD的增加而线性增加,说明形成了1︰1的包合物[17-18]。

图3 β-CD的相溶解度曲线
2.3 纳米粒载药分析
ES100载DM/β-CD纳米粒的LC和EE通过对应公式计算得出。IDM/β-CD、ES100的比例为1︰1时,所制备纳米粒的EE较低,仅为46.33%,其原因可能是ES100太少,药物未被包载的量增多,因此EE降低;当IDM/β-CD、ES100的比例为1︰1.5和1︰2时,纳米粒EE相差不大,但LC随着ES100的增加而降低。综合考虑,取IDM/β-CD、ES100的比例为1︰1.5时较好,此时纳米粒的LC和EE分别为21.14%±0.79%和57.47%±0.96%。
2.4 纳米粒粒径和Zeta电位
IDM/β-CD、ES100比例为1︰1.5时制备的纳米粒粒径分布如图4所示。通过计算3次粒径的平均值,得其粒径为(383.0±6.9)nm。当Zeta电位绝对值>10时,粒子由于表面电荷互相排斥,不易发生聚集等现象。本实验所得纳米粒的Zeta电位为(-23.0±0.5)mV,比较稳定,分散性较好。

图4 IDM/β-CD/ES100纳米粒的粒径分布
2.5 纳米粒形貌分析
IDM/β-CD、ES100比例为1︰1.5纳米粒的电镜图如图5所示。从图中可以观察到纳米粒的形态为球形,具有良好的分散性,纳米粒的粒径在260 nm左右。此粒径比LPSA测得的结果稍小,其原因在于LPSA测定时样品处于水环境中,粒子表面较为伸展,而使用SEM观察样品时,样品处于干燥条件下,导致粒子发生少许皱缩。
2.6 XRD图谱分析
图 6为 IDM、ES100、β-CD 和 IDM/β-CD/ES100纳米粒的XRD扫描图谱。从图中可知,IDM(图6A)具有多个很强的晶体吸收峰;ES100(图6B)在2θ=17°和2θ=20°处有两个细且尖的吸收峰;β-CD(图6C)在2θ=10°和2θ=20°有两个较宽的吸收峰;IDM/β-CD/ES100纳米粒(IDM/β-CD︰ES100=1︰1.5)(图6D)的衍射图中,在2θ=10°和2θ=15°处有两个较弱的吸收峰,但IDM的吸收峰、β-CD 在 2θ=20°和 ES100 在 2θ=17°及 2θ=20°处的吸收峰都消失。这表明,IDM、ES100和β-CD在制备成纳米粒时,不是简单重结晶,可能发生了一定的相互作用。

图5 IDM/β-CD/ES100纳米粒的SEM图

图6 XRD扫描图谱
2.7 体外释药试验
模拟IDM/β-CD/ES100纳米粒在消化系统中的释药曲线如图7所示。从图7可知,在pH 1.2的盐酸溶液中,2 h后,IDM/β-CD、ES100比例为1︰1的纳米粒,IDM/β-CD释放约10%,而对于IDM/β-CD、ES100比例为1︰1.5和1︰2的纳米粒,IDM/β-CD释放约 5%。这是由于 IDM/β-CD在ES100表面所致,而1︰1的纳米粒中,IDM/β-CD释放率比其他两个比例高,主要原因在于ES100太少,包衣不完全,导致更多的IDM/β-CD暴露于溶液中。在pH 6.8的PBS中,2 h后,1︰1的纳米粒IDM/β-CD累积释放约50%,而1︰1.5和1︰2的纳米粒,IDM/β-CD释放比较接近,累积释放27%左右,其原因是ES100少量溶解,IDM/β-CD随之释放出来;在pH 7.8的PBS中,2 h后,1︰1的纳米粒,IDM/β-CD累积释放约95%,而1︰1.5和1︰2的纳米粒,IDM/β-CD累积释放60%左右,在17 h以后,1︰1的纳米粒IDM/β-CD的释放率不再增加,说明药物完全释放,而其他两个比例的纳米粒的释放率还在升高。从图7可以得出,IDM/β-CD、ES100比例为1︰1.5和1︰2的纳米粒,缓释效果基本相当,都远远好于1︰1的纳米粒,具有良好的结肠释药靶向性。
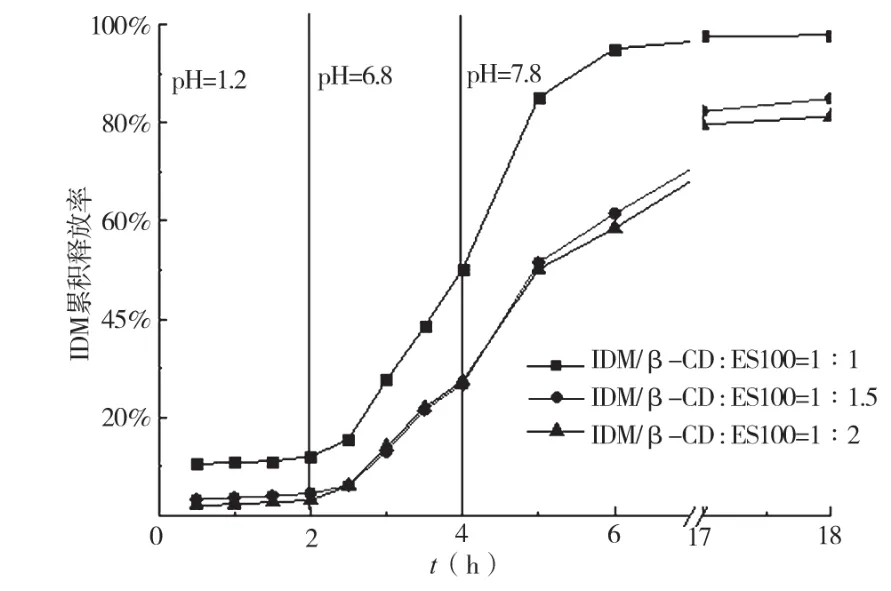
图7 IDM/β-CD/ES100纳米粒在pH 1.2、6.8和7.8的介质中的体外释药曲线
3 结论
本文用β-CD成功地制备了IDM/β-CD包合物,增加了IDM在水相中的溶解度。并进一步利用乳化溶剂挥发法,成功地对IDM/β-CD进行了包衣,制备出粒径在260 nm左右、稳定性良好的IDM/β-CD/ES100球形纳米粒。体外释药实验表明,当IDM/β-CD、ES100比例不超过1︰1.5时,纳米粒具有良好的结肠释药靶向性。

