miR-150-5p在卵巢癌中的表达及其生物学功能研究
蒋小平 樊华 严建耀 朱红玲
卵巢癌作为妇科常见肿瘤之一,其发病率和死亡率均较高,与其他肿瘤发病相似,卵巢癌发生发展与细胞侵袭、血管生成等密切相关[1]。研究报道[2]称卵巢癌的发生发展与癌基因的异常活化表达有关。近期有学者[3]研究发现,微小RNA(miRNA)能够调控相关癌基因,作为非编码的小分子RNA,miR-150-5p由22个核苷酸构成,有研究[4]已经证实其能够通过某种特定通路参与肿瘤的发生发展。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)在多种肿瘤中处于激活状态,参与肿瘤细胞的增殖和凋亡过程。研究报道[5],抑制PI3K/Akt能够明显降低癌细胞的增殖、侵袭和迁移能力,而miR-150-5p是否能够基于PI3K/Akt信号通路来对卵巢癌细胞增殖凋亡的机制进行调控尚未有研究报道。因此,本研究通过干扰miR-150-5p的表达,研究其对卵巢癌增殖、凋亡和PI3K/Akt信号通路影响,以期为临床治疗卵巢癌提供新的靶点。
材料和方法
一、临床标本及资料
选取2016年4月—2018年12月于本院妇科就诊的82例卵巢癌患者作为研究对象,患者年龄22~65周岁,平均(43.5±6.8)岁。纳入标准:(1)经病理学检测确诊为卵巢癌的患者;(2)纳入患者均为初次诊断;(3)在本院经手术切除卵巢癌组织标本。排除标准:术前接受过放化疗治疗。手术将患者病变组织切除后,立即在距离肿瘤2 cm位置处切下0.6 cm大小的正常卵巢组织,同时留取同样大小的癌组织样本,快速放入冷存管液氮保存,样本留取过程中注意交叉污染。本实验经本院伦理委员会批准,所有参与研究患者均签署知情同意书。
二、方法
1.细胞来源和培养:人卵巢癌SKOV3细胞株由本实验室液氮冷冻保存。SKOV3细胞株经取出后,37℃水浴溶解,加入含有10%胎牛血清的DMEM培养基,离心去上清,加入细胞培养液悬浮细胞,接种于培养瓶中,37 ℃、5% CO2培养,融合度到80%时,用0.25%的胰蛋白酶消化,采用完全培养基传代。传代次数一致且细胞处于对数期,用于后续研究。
2.试剂和仪器:胎牛血清、胰蛋白酶、DMEM培养基均购自美国Gibco公司,miR-150-5p inhibitors(抑制剂)和阴性对照质粒由上海吉玛制药技术有限公司代为合成,Lipofectamine2000购自美国Invitrogen公司,兔抗人cleaved caspase3、PI3K、Akt和p-Akt多克隆抗体、辣根过氧化物标记的羊抗兔IgG采购自美国Abcam公司,MTT试剂盒、BCA蛋白浓度检测试剂盒采购自上海经科化学科技有限公司,细胞培养箱和分光光度计购自上海三腾仪器有限公司。
3.qRT-PCR检测:采用TRIzol试剂提取总RNA,按照PrimeScrip反转录试剂盒进行反转录成cDNA,采用SYBR Premix Ex Taq说明书配置PCR反应体系,反应条件为95 ℃预变性10 min,然后95 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,40 个循环;95 ℃ 5 s,60 ℃ 1 min,95 ℃ 30 s。U6作为内参(上游引物为 5′-CTCGCTTCGGCAGCACA-3′,下游引物为 5′AACGCTTCACGAATTTGCGT-3′),miR-150-5p(上游引物为 5′-ACTGTCTCCCAACCCTTGTA-3′,下游引物为5′-GTGCAGGGTCCGAGGT-3′)相对表达量用2-△△CT表示。
4.细胞转染:调整卵巢癌SKOV3细胞株浓度至1×106个/毫升,取2 ml接种于6孔板中,培养过夜,采用Lipofectamine 2000将浓度均为100 nmol/L的miR-150-5p 抑制剂和阴性对照分别转染至SKOV3细胞。以人卵巢癌SKOV3细胞株作为空白对照组,转染miR-150-5p抑制剂的人卵巢癌SKOV3细胞株作为miR-150-5p抑制剂组,转染阴性对照质粒的人卵巢癌SKOV3细胞株作为阴性对照组。
5.MTT法检测:转染48 h后,调整卵巢癌SKOV3细胞株浓度至3×104个/毫升接种于96孔板中,每孔加入200 μl的细胞悬液,置入培养箱中培养,条件为37 ℃、5%CO2,于24 h、48 h和72 h,加入MTT试剂10 μl,37 ℃孕育4 h,检测490 nm处OD值。细胞增殖率=转染组OD/空白组OD×100%。
6.流式细胞术检测:转染48 h后,PBS洗涤,加入300 μl的缓冲液悬浮细胞,调整细胞浓度为1×106个/毫升,取100 μl置于流式管中,加入Annexin V-FITC及PI各5 μl,混匀室温孕育15 min,加入400 μl PBS,上机检测细胞凋亡情况。
7.生物信息学预测和荧光素酶报告基因分析:通过Targetscan(http://ww w.targetscan.org/)预测miRNA-150-5p与PI3K的靶向结合情况。采用 PCR从大鼠星形胶质细胞基因组 DNA中扩增 PI3K的 3′-非翻译区(3′-untranslated region,3′-UTR)序列,构建至荧光素酶报告基因载体 pGL3(pGL3-PI3K-WT)中,同时构建突变型重组质粒(pGL3-PI3K-MUT),将HEK293T 细胞按30%左右密度铺25孔板,将miRNA-150-5p mimic及mimic control分别与空载质粒及上述质粒共转染至HEK293T 细胞。转染后24 h,根据双荧光素酶测定试剂盒说明书检测荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性值即为报告基因活性。
8.Western blotting检测:取转染48 h的SKOV3细胞,加入RIPA裂解液,裂解30 min,12 000/min 4 ℃离心10 min,收集上清,BCA试剂盒检测蛋白浓度,将蛋白样品和Loading buffer混合,100 ℃水域变性5 min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入Cleaved caspase-3、PI3K(P110亚基)、Akt、p-Akt一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h后加入ECL显影,以GAPDH作为内参。
9.统计学处理:应用SPSS16.0版软件处理数据。多组间比较采用单因素分析,两两比较用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
一、miR-150-5p在卵巢癌组织和癌旁正常组织中的表达
82例卵巢癌患者癌组织和癌旁正常组织中miR-150-5p的相对表达分别为(1.64±0.10)和(0.99±0.08),差异有统计学意义,见图1。
2、转染后miR-150-5p在卵巢癌SKOV3细胞株中的表达
空白对照组和阴性对照组miR-150-5p的相对表达量分别为(0.97±0.06)和(1.01±0.08),组间差异无统计学意义;miR-150-5p抑制剂组为(0.11±0.03),明显低于空白对照组和阴性对照组,差异有统计学意义。见图2。
三、转染miR-150-5p抑制剂对卵巢癌SKOV3细胞株增殖能力的影响
空白对照组和阴性对照组24 h、48 h和72 h细胞增殖率的差异无统计学意义;miR-150-5p抑制剂组24 h、48 h、72 h细胞增殖率分别为(9.61±1.32)%、(24.54±3.61)%和(33.78±3.72)%,同一时间点均明显低于空白对照组和阴性对照组,差异均有统计学意义。见图3。
四、转染miR-150-5p抑制剂对卵巢癌SKOV3细胞株凋亡的影响
空白对照组和阴性对照组细胞凋亡率分别为(0.74±0.10)%和(1.79±0.21)%,差异无统计学意义;而miR-150-5p抑制剂组细胞凋亡率为(16.65±2.93)%,明显高于空白对照组和阴性对照组,差异均有统计学意义。见图4。
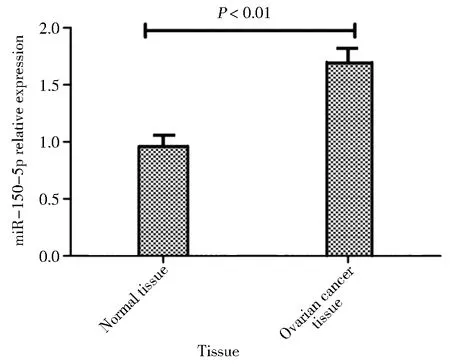
图1 miR-150-5p在卵巢癌组织和癌旁正常组织中的表达
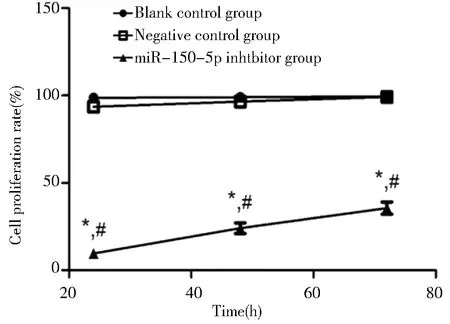
Compared with blank control group, *P<0.05;compared with negative control group, #P<0.05
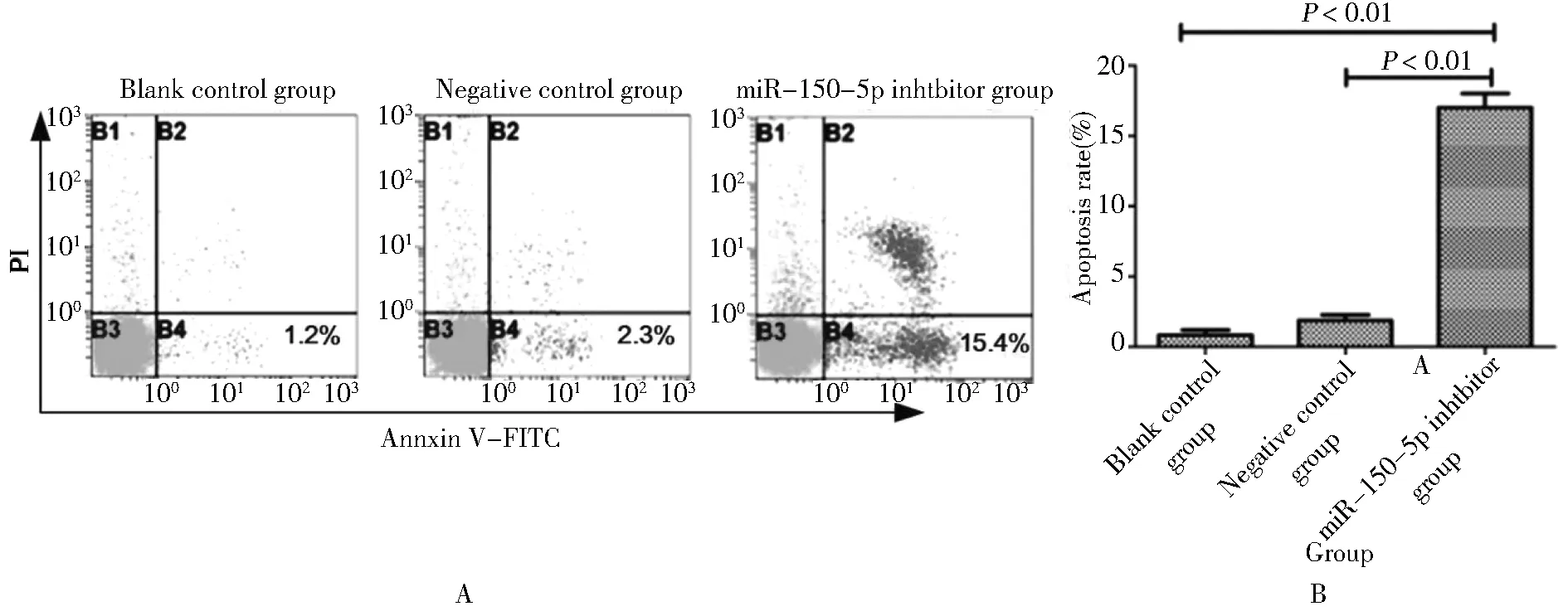
A:flow detection record chart; B:apoptosis rate in different groups
五、PI3K与miRNA-150-5p的作用关系
双荧光素酶报告基因结果显示,转染miRNA-150-5p后,野生型PI3K的荧光素酶活性被抑制(t=21.354,P=0.000),突变型PI3K的荧光素酶活性无明显变化(t=0.323,P=0.684),说明PI3K与miRNA-150-5P具有靶向调控关系,见图5。
六、转染miR-150-5p抑制剂对PI3K、Akt、p-Akt和Cleaved caspase-3蛋白表达的影响
各组细胞转染后培养48 h,空白对照组和阴性对照组PI3K、p-Akt以及Cleaved caspase-3蛋白表达的差异均无统计学意义;miR-150-5p抑制剂组PI3K、p-Akt蛋白表达显著低于空白对照组和阴性对照组,差异均有统计学意义;Cleaved caspase-3蛋白明显高于空白对照组和阴性对照组,差异均有统计学意义;而三组间Akt蛋白表达的差异无统计学意义。见图6。
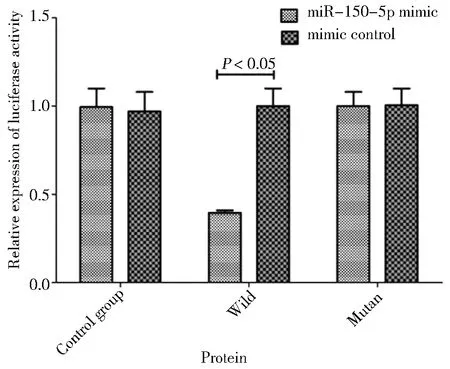
图5 双荧光素酶报告基因检测结果
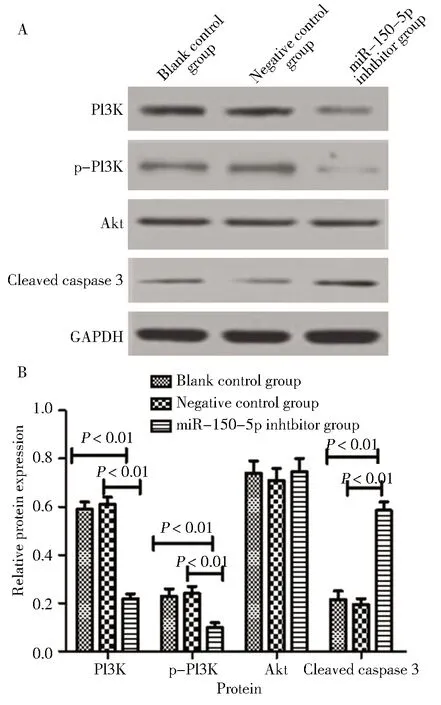
A:western blotting detection electrophoresis map; B:relative expression of each protein
讨 论
卵巢癌发病机制较为复杂,但与其他恶性肿瘤相似,其发生发展与致癌基因、抑癌基因的表达密切相关[6]。miRNA作为单链非编码RNA,长度在21~25 nt,研究报道[7]称其能够和靶基因的3′UTR结合,从而调节靶基因的表达或者降解[7-8]。miR-150-5p作为miRNA中的一员,位于人类染色体19q13.33。国外有学者[9]研究发现,肺癌细胞中miR-150-5p异常高表达,且其能够下调p53表达,从而影响细胞表型。还有学者[10]发现,胃癌组织和细胞株中miR-150-5p均处于高表达状态。Inoue等[11]学者通过QPCR检测胃癌组织中miR-150-5p的表达,结果显示其在胃癌中异常高表达。
RNA干扰主要是通过双链DNA将特定基因进行沉默,其具有毒性小,抑制率高的特点,目前主要用来研究功能基因生物学特性。有学者[12]采用RNA干扰技术下调鼻咽癌细胞中miR-150-5p表达,结果癌细胞的侵袭能力也明显下降。还有学者[13]在多发性骨髓瘤中采用RNA干扰技术沉默miR-150-5p的表达,结果显示细胞凋亡增强,增殖能力减弱。本研究也采用小分子RNA干扰miR-150-5p在卵巢癌细胞株SKOV3中的表达,结果显示,miR-150-5p抑制剂组24 h、48 h和72 h细胞增殖率均明显低于空白对照组和阴性对照组。转染48 h,miR-150-5p抑制剂组细胞凋亡率明显高于空白对照组和阴性对照组,提示miR-150-5p在卵巢癌的发生、发展过程中可能扮演促癌基因的角色。
文献报道[14]称miRNA主要是通过与靶蛋白结合来发挥生物功能,本研究首先采用生物信息学TargerScan数据库检索显示miR-150-5p与PI3K存在靶向结合位点,双荧光素酶报告基因结果也显示二者存在靶向调控关系。国内有学者[15]在结肠癌细胞中研究发现,沉默biaoda miR-150-5p,PI3K表达水平也明显降低,结肠癌细胞凋亡能力增强。本研究结果也显示抑制卵巢癌细胞SKOV3中miR-150-5p的表达后,PI3K表达量明显下调,细胞增殖能力下降,凋亡能力增强。
PI3K/Akt作为经典的信号通路,在细胞迁移、分化和凋亡过程中起着重要作用[16]。研究报道称PI3K能够通过PDK1促使Akt发生磷酸化,进而上调caspase表达,而caspase可将自身底物水解传递至凋亡通路,进而导致细胞出现程序性死亡,Cleaved caspase 3 作为caspases 级联反应中关键蛋白,在凋亡过程中扮演着极其重要角色[17]。有学者[18]发现,肺癌细胞中Cleaved caspase 3表达明显下降,而加入了 PI3K/Akt信号通路抑制剂LY294002干预之后,Cleaved caspase 3蛋白水平明显升高,细胞凋亡率显著提高。本研究采用蛋白免疫印迹法检测 PI3K/Akt/caspase 3关键蛋白表达,结果显示miR-150-5p 抑制剂组SKOV3细胞中Akt的磷酸化程度明显下降,Cleaved caspase 3蛋白表达明显升高,提示miRNA-150-5p调卵巢癌增殖、凋亡可能是通过调节PI3K/Akt/Cleaved caspase 3 信号通路实现的。
综上所述,miR-150-5p在卵巢癌中作促癌基因,其调控作用可能与PI3K/Akt信号通路有关。

