GPER激动剂G-1在大鼠肝脏缺血再灌注损伤中的作用研究*
秦 勇 王超君 徐胜前 叶冠雄 潘德标 叶海林
温州医科大学附属第六医院(丽水市人民医院) 1 肝胆外科 2 超声科,浙江省丽水市 323000
肝脏缺血再灌注损伤在临床上常见于失血性休克、肝肿瘤切除和肝移植等情况,也是目前肝脏保护研究的热点,近年来雌激素对大鼠肝脏缺血再灌注损伤的研究发现雌激素预处理能刺激雌激素受体表达,进而降低TNF-α水平,抑制NF-κB表达来减轻肝脏缺血再灌注损伤[1],而雌激素受体GPER作为雌激素的独立受体,在传统雌激素受体ERα和ERβ缺乏的细胞中介导了雌激素对靶细胞的快速效应,目前未见有关GPER激动剂G-1在肝脏缺血再灌注损伤中的相关作用的报道。本研究建立肝脏缺血再灌注损伤模型观察GPER激动剂G-1在大鼠肝脏缺血再灌注损伤中的作用及意义。
1 材料与方法
1.1 实验材料 成年健康雄性SD大鼠54只,体重(250±20)g,由上海斯莱克实验动物有限公司提供。TUNEL细胞凋亡检测试剂盒是由瑞士Roche公司(货号11684817910)提供,DAB浓缩型试剂盒是由上海长岛生物技术有限公司(货号FL-6001)提供,G-1是由美国Med Chem Express公司提供(货号HY-107216),谷丙转氨酶(ALT/GPT)测试盒是由南京建成生物有限公司提供(货号C009-1),大鼠白细胞介素 1β(IL-1β)酶联免疫分析(ELISA)试剂盒由武汉华美生物有限公司提供(货号GSB-E08055r)。
1.2 动物分组 54只大鼠随机分成三组,每组18只。G-1预处理+肝缺血再灌注组(GIR组)于造模前1h经腹腔给予G-1 120μg/(kg·d),假手术组(PO组)和肝缺血再灌注组(IR组)则于术前1h经腹腔给予同等容积的生理盐水。缺血再灌注6h、12h和24h共3个时间点进行标本检测,每个时间点6只大鼠。
1.3 动物模型建立 8周龄SD大鼠术前12h 禁食,腹腔内注射1%戊巴比妥钠溶液30mg/kg 麻醉,上腹部正中切口开腹,断离肝周韧带后分离肝门部脉管,以无创伤小血管夹夹闭左外及中叶的肝动脉、门静脉造成70%肝脏缺血,45min后重新开放血供并切除未阻断血供的30%肝叶,造成肝切除肝缺血再灌注模型,分别在各时间点沿着大鼠剑突剪开胸腔,暴露心脏,右心室取4~6ml血液,分装于Eppendoef导管中,室温下1 000g离心10min分离出血清,-20℃保存待测。同时取肝左中叶组织,用冰生理盐水冲洗后用10%甲醛溶液浸泡固定,制作石蜡切片。
1.4 全自动生化检测仪检测血清ALT水平 根据谷丙转氨酶(ALT/GPT)测试盒操作步骤完成大鼠缺血再灌注后6h、12h和24h的血清谷丙转氨酶检测。
1.5 ELISA法测定血清白细胞介素1β(IL-1β) 取大鼠肝脏缺血再灌注后6h、12h和24h的血清,室温血液自然凝固10~20min,离心20min左右(2 000~3 000r/min),仔细收集上清,保存过程中如出现沉淀,应再次离心,经过标准品的稀释与加样(稀释后各孔加样量都为50μl,浓度分别为30ng/L、20ng/L、10ng/L、5ng/L、2.5ng/L),分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔,温育、配液洗涤、加酶、再次温育、再次洗涤、显色(每孔先加入显色剂A 50μl,再加入显色剂B 50μl,轻轻震荡混匀,37℃避光显色15min)、终止(每孔加终止液50μl,终止反应,此时蓝色立转黄色)等步骤;最终测定:以空白孔调零,450nm波长依序测量各孔的吸光度(OD值),测定应在加终止液后15min以内进行。
1.6 TUNEL法观察肝细胞的凋亡 取肝组织包埋与固定,脱蜡、水化、消化、制备TUNEL反应混合液,加50μl TUNEL反应混合液于标本上,加盖玻片或封口膜在暗湿盒中37℃反应1h;PBS洗3min×3次,加50μl POD于标本上,加盖玻片或封口膜在暗湿盒中反应37℃×30min,PBS洗3min×3次,DAB染色3~10min,自来水冲洗,苏木素复染,1%盐酸酒精分化,显微镜下观察,控制染色程度,脱水:75%酒精、85%酒精、95%酒精、100%酒精,逐级脱水,各3min,透明:二甲苯透明3min×2次,中性树胶封片,通过显微镜采集分析样本相关部位,计算凋亡率。

2 结果
2.1 血清转氨酶水平变化 大鼠肝脏缺血再灌注后6h、12h及24h,PO组、IR组及GIR组血清ALT值在组间各时点分别两两对比,差异显著(P<0.01),GIR组血清ALT值随着再灌注时间的延长而逐渐下降,于再灌注6h达到峰值,到再灌注24h时渐渐接近PO组,见表1。

表1 大鼠肝缺血再灌注后各时点血浆ALT的活性比较
注:★P<0.01 VS PO组;▲P<0.01 VS IR组。
2.2 大鼠肝缺血再灌注后各时点凋亡率的变化 大鼠肝脏缺血再灌注后6h,PO组、IR组及GIR组的凋亡率两两对比,有统计学意义(P=0.000、0.015、0.000),大鼠肝脏缺血再灌注后12h,三组的凋亡率两两对比,差异显著(P=0.000、0.005、0.000),大鼠肝脏缺血再灌注后24h,三组肝细胞凋亡率两两对比,其中PO组及GIR组与IR组两两对比差异明显(P=0.000),PO组与GIR组对比无统计学意义(P=0.265),GIR组随着再灌注时间的延长,凋亡率逐渐下降,到再灌注24h时已显著下降,接近PO组,见表2。

表2 大鼠肝缺血再灌注后各时点凋亡率比较研究
注:★P<0.01 VS PO组;▲P<0.01 VS IR组。
2.3 大鼠肝缺血再灌注后各时点大鼠血清白细胞介素 1β(IL-1β)的变化 大鼠肝脏缺血再灌注后6h PO组、IR组及GIR组IL-1β值两两对比,差异显著(P=0.000),大鼠肝脏缺血再灌注后12h,三组IL-1β值两两对比有统计学意义(P=0.000),大鼠肝脏缺血再灌注后24h,三组IL-1β值两两对比有差别(P=0.000),随着再灌注时间的延长,GIR组白细胞介素 1β(IL-1β)水平逐渐下降,到再灌注24h时下降明显,见表3。
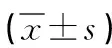
表3 大鼠肝缺血再灌注后各时点白细胞介素 1β(IL-1β)的变化情况
注:★P<0.01 VS PO组;▲P<0.01 VS IR组。
3 讨论
肝缺血再灌注(Ischemia reperfusion,I/R)损伤常由炎症反应和氧化应激介导,引起肝细胞的凋亡和坏死,进而导致肝功能不全[2],随着研究进展,近年发现了与雌激素相关联的第3种受体,即G蛋白偶联雌激素受体(G protein-coupled estrogen receptor,GPER),雌激素可通过GPER介导的快速信号反应来调控细胞的增殖、凋亡、炎症反应等[3],G-1和G-15分别是CPER高选择性的激动剂和抑制剂,它们的发现促进了GPER在细胞、组织和动物中的功能研究[4-5]。
本研究成果通过建立大鼠肝切除肝缺血再灌注模型,于造模前1h经腹腔给予120μg/(kg·d)G-1预处理,于造模后6h、12h及24h取大鼠血清及肝组织标本,分别检测血清谷丙转氨酶(ALT)浓度、肝细胞的凋亡情况发现,肝脏缺血再灌注后,血清ALT活性明显升高。在IR组和GIR组,大鼠肝脏缺血再灌注后各个时间点ALT活性明显升高,且随着再灌注时间的延长而逐渐下降,组间同时点比较,GIR明显低于IR组(P<0.05),且随着再灌注时间的延长GIR组血清ALT值渐渐接近PO组;通过TUNEL法检测肝细胞的凋亡情况发现,GIR组随着再灌注时间的延长,G-1预处理组凋亡率逐渐下降,于再灌注6h达到峰值,到再灌注24h时已显著下降,说明GPER激动剂G-1具有保护肝功能作用。
近期国内相关学者[6]对GPER激动剂(G-1)对C57BL/6小鼠腹腔巨噬细胞的研究发现GPER激动剂G-1可特异性降低IL-1β表达,IL-1β的激活依赖NLRP3炎性小体的活化,GPER激动剂G-1可能抑制NLRP3炎性小体的活化,本研究通过ELISA法在大鼠肝缺血再灌注后各时点测定血清白细胞介素1β(IL-1β)的变化,发现GPER激动剂G1预处理后,假手术组的IL-1β明显低于GIR组及IR组(P<0.01),且随着再灌注时间的延长,GIR组白细胞介素 1β(IL-1β)水平逐渐下降,到再灌注24h时下降明显,表明GPER激动剂G-1预处理能降低大鼠肝缺血再灌注损伤后的IL-1β水平,抑制炎性细胞聚集,减轻肝组织炎性浸润和细胞凋亡,从而减轻大鼠肝脏缺血再灌注损伤,这说明GPER激动剂G-1在大鼠肝缺血再灌注损伤的作用可能与NLRP3炎性小体相关。
综上所述,GPER激动剂G-1预处理大鼠肝缺血再灌注损伤后,随着再灌注时间的延长,能降低肝转氨酶(ALT),减少肝细胞凋亡率,从而起到肝保护作用,其可能作用是通过降低IL-1β水平,来抑制IL-1β产生减轻肝脏缺血再灌注损伤,其进一步作用机制为GPER激动剂G-1可能是抑制NLRP3炎性小体的活化而发挥抗炎作用,从而影响细胞周期进程及细胞增殖,在肝脏缺血再灌注损伤中发挥保护肝脏组织的功能有待我们进一步研究。

