羊泰勒虫套式PCR检测方法的建立
田万年,宋旗,孙凰员,郑秀红
(1. 吉林农业科技学院动物科技学院,吉林 吉林 132101;2. 吉林省龙井市德新乡畜牧兽医站,吉林 龙井 133400)
羊泰勒虫病是由泰勒虫寄生于羊红细胞或网状内皮细胞内引起的经蜱传播血液原虫病[1]。本病以体表淋巴结肿大、贫血、血红蛋白尿为主要特征,对羔羊和外地引进羊危害严重[2]。羊泰勒虫病的诊断一般为血涂片染色后,通过显微镜观察红细胞内虫体确诊,近年来随着分子生物技术的迅速发展,相继建立了检测羊泰勒虫PCR和荧光定量PCR方法[3-4]。传统病原学血液涂片镜检受人为因素影响较大,容易出现漏检和误诊,PCR技术具有特异性强、灵敏度高的特点,已广泛应用于羊泰勒虫病的诊断和流行病学分析[5-6]。泰勒虫主要表面蛋白(major piroplasm surface protein, MPSP)是泰勒虫感染红细胞阶段虫体分泌的一种膜内蛋白,是泰勒虫所特有的膜表面蛋白, 其编码的基因在遗传分类和分子诊断方面具有较好应用价值[7-8]。目前,国内尚未见套式PCR检测方法应用于羊泰勒虫病诊断的研究报道。本试验利用羊泰勒虫MPSP基因的特异性,建立了羊泰虫套式PCR检测方法,为基层兽医工作人员对该病的诊断提供一种新的方法。
1 材料与方法
1.1 样本的采集
30份绵羊抗凝血于2017年5月采自吉林省珲春地区,同时用载玻片制作血涂片供染色镜检。
1.2 血液涂片染色
制成的血液涂片滴加甲醇固定,放入装有吉姆萨染液的染缸中,室温染色6 h,然后取出血液涂片用蒸馏水冲洗,自然晾干后显微镜镜检。
1.3 基因组DNA的提取
临床样本绵羊血液DNA提取按照天根生化科技有限公司血液DNA提取试剂盒说明书进行操作。羊巴贝斯虫(Babesia)、羊无浆体(Anaplasmaovis)、弓形虫(Toxoplasmagondii)基因组DNA由日本带广畜产大学玄学南教授惠赠。
1.4 引物设计与合成
根据GenBank 收录的梨形虫MPSP序列(GQ281044),利用引物设计软件设计两对特异性引物(见表1)。
表1 MPSP基因引物序列

引物名称引物序列(5'-3')产物长度/bp退火温度/℃MPSP外引物P1: ATGTTGTCCAAGAGATCATTCP2: CTAGAAATAGTAGGATACTGCG85255MPSP内引物N1: GAAGAAGAGCGACAAGGAATGN2: GATACTGCGAGTAAGGCGATG49258
1.5 PCR扩增
先用外引物P1和P2进行第一轮PCR扩增,取扩增出的产物1 μL为模板,再用内引物N1和N2进行第二轮PCR扩增。反应程序:预变性温度为95 ℃ 5 min,变性温度为94℃ 45 s,退火温度为53 ℃ ~60 ℃ 40 s,延伸温度为72 ℃ 1 min,循环数为30个;最后延伸温度为72 ℃ 5 min。
1.6 目的基因序列测定
第一轮阳性PCR产物回收纯化,与克隆载体T载体连接、转化,经鉴定为阳性的质粒送大连宝生物工程技术公司进行测序。
1.7 特异性试验
应用所建立的套式PCR方法分别检测无浆体、羊巴贝斯虫、羊泰勒虫与弓形虫的DNA,以评价该方法的特异性。
1.8 敏感性试验
将带有MPSP基因的质粒用分光光度计测量浓度后,对其进行10倍倍比稀释,浓度为106~100拷贝数,分别进行套式PCR和普通PCR扩增,对比最低检测浓度进行对比。
1.9 临床样本检测
对30份绵羊血液进行套式PCR检测,同时应用田万年等[9]报道的普通PCR检测方法、血液涂片法平行检测,并比较检测结果,评价羊泰勒虫感染情况。
2 结果
2.1 血涂片镜检
绵羊血涂片染色后,在显微镜下发现梨籽形和点状羊泰勒虫虫体,见图1。
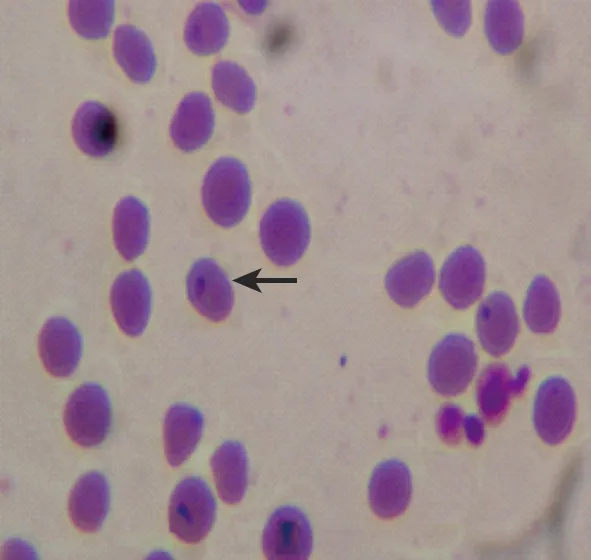
图1 血液涂片吉姆萨染色镜检结果(1 000×)
2.2 PCR扩增
DNA经外引物PCR扩出约为852 bp目的条带,退火温度为55 ℃;经内引物PCR扩出约为492 bp目的条带,最佳退火温度为58 ℃(见图2)。
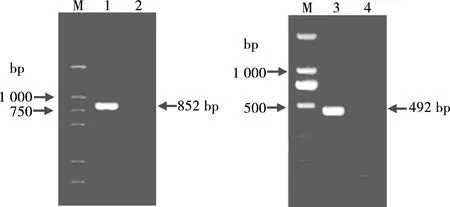
M. DL 2000 DNA Marker;1. 第1轮PCR 产物;2,4.空白对照;3.第2轮PCR扩增产物
图2 套式PCR扩增结果
2.3 目的基因序列测定
经序列测定显示,所测得的羊泰勒虫MPSP基因与NCBI网站收录的羊吕氏泰勒虫(GQ281044)核苷酸同源性为100%。
2.4 特异性试验
该方法可特异性检测出羊泰勒虫基因组DNA,而以羊巴贝斯虫、弓形虫和绵羊无浆体的DNA为模板时未能扩增出相应基因片断(图3),具有较好的特异性。
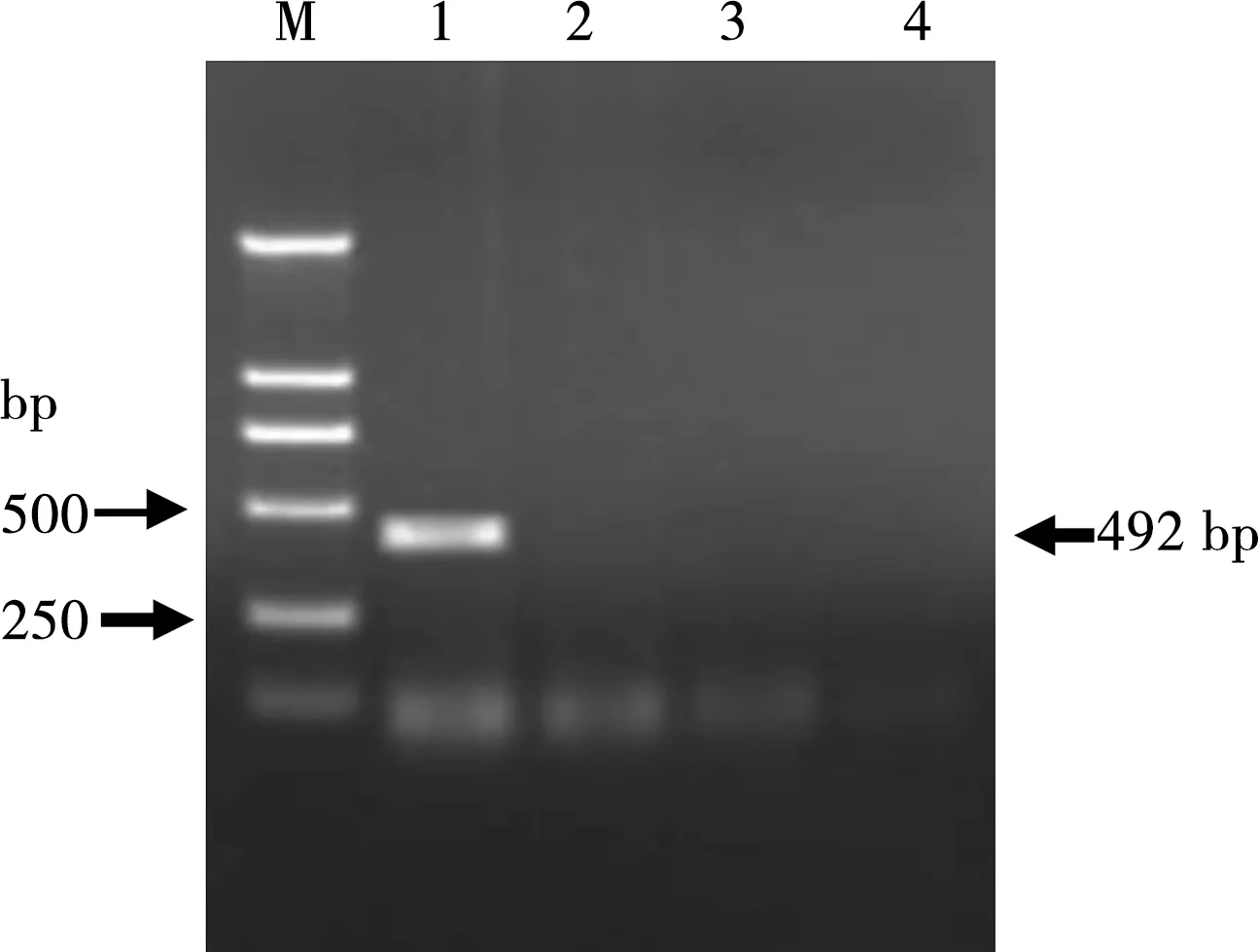
M. DL 2000 DNA Marker;1.羊泰勒虫;2.羊巴贝斯虫;3.弓形虫;4.无浆体
图3 特异性PCR扩增
2.5 敏感性试验
应用所建立的套式PCR和普通PCR同时检测被稀释的质粒DNA,普通PCR检测质粒DNA的最低浓度为103copies/μL(见图4);套式PCR检测质粒DNA最低浓度为1 copies/μL(见图5)。
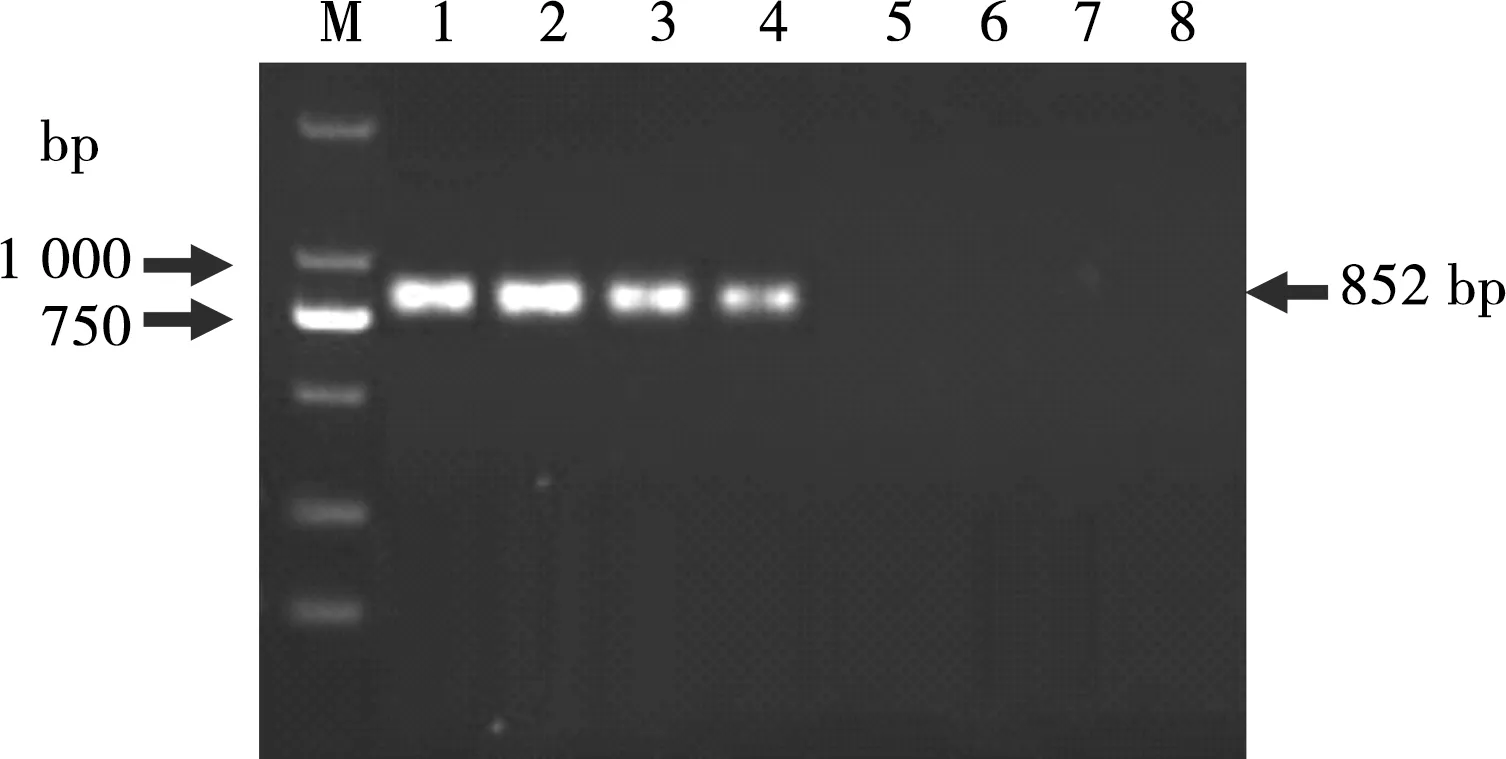
M. DL 2000 DNA Marker;1~7. 106~100copies/μL;8. 空白对照
图4 普通PCR敏感性

M. DL 2000 DNA Marker;1~7. 106~100copies/μL;8. 空白对照
图5 套式PCR敏感性
2.6 临床样本检测
通过对30份绵羊血液样本的羊泰勒虫检测结果(见表2)显示,套式PCR检测阳性样本14份,高于普通PCR(12份)和血液涂片染色(7份),三者间阳性符合率为100%。
表2 临床样本检测结果

方法被检数阳性数阴性数阳性率/%套式PCR30141646.67普通PCR30121840.00血液涂片3072223.33
3 讨论
我国最早发现羊泰勒虫是在1958年,目前已在多个省份都有该病的流行报道,给养羊业造成较大的损失[9]。羊感染一定数量泰勒虫才会表现出临床症状,多表现为隐性感染。羊感染该虫主要表现为免疫器官受损,引发免疫抑制,免疫功能下降,严重影响生产性能。对羊泰勒虫病原的收集与鉴定是防治该病的基础,羊泰勒虫病的诊断多采用血液涂片镜检方法,该方法需要检查人员掌握各种寄生虫形态学方面的知识,因此不适用基层兽医人员对该病的临床诊断。
目前,国内针对羊泰勒虫建立了多种分子生物学检测方法。盛明宏等[3]建立了以18S rRNA为目的基因的PCR检测方法,敏感性能达到0.12fg DNA;田万年等[4]建立了以18S rRNA为目的基因的羊泰勒虫荧光定量PCR方法,最低可检测2.08×101copies/μL,比普通PCR敏感100倍。为提高套式PCR的特异性和敏感性,本研究所选的目的基因为泰勒虫特有MPSP基因,该方法最低检测限量为1拷贝数,是普通PCR的1 000倍,具有较好的特异性。应用本试验建立的套式PCR方法通过对30份临床血液样本检测,阳性率为46.6%(14/30),高于普通PCR(40.00%,12/30)和血液涂片染色(23.33%,7/30),三者间阳性符合率为100%。综上,本研究所建立的套式PCR方法具有较好的敏感性、特异性和准确性,为兽医人员对羊泰勒虫病的诊断和流行病学调查提供了有效手段。

