动物源性粪肠球菌Ebp菌毛亚单位蛋白多抗的制备及其对生物被膜形成的影响
郭珍珍, 张留君, 楚红燕, 王鑫盛, 董家君, 王亚宾,2, 陈丽颖,2
肠球菌是人类和动物肠道重要的正常菌群,其数量仅次于大肠杆菌[1],也是一种机会性致病菌。由于肠球菌对人和动物感染的严重性[2-5]以及多重耐药的严峻性[6],寻求和开发相关免疫性蛋白的新型免疫疗法对肠球菌的预防治疗变得尤为重要。
黏附、侵入和生物膜形成是细菌性病原体致病的关键环节[7-9]。生物信息学分析显示粪肠球菌V583菌株表面毒力因子中有17种编码细菌表面识别黏附矩阵分子(MSCRAMMs)和菌毛亚单位成分的LPXTG型细胞壁锚附蛋白[10],而且仅有Ace、FSS1、FSS2、FSS3和EbpABC菌毛亚单位可以宿主黏附到胞外矩阵(ECM)蛋白[10-12]。进一步研究发现Ace和Ebp在粪肠球菌广泛存在,且在人的心内膜炎和尿道炎感染中起着重要的作用[13-14],它们均有可能成为预防粪肠球菌感染的免疫原性蛋白。
粪肠球菌Ebp菌毛由ebpC基因编码的骨架蛋白以及ebpA和ebpB基因编码的辅助蛋白组成[15]。来自其它革兰氏阳性菌如肺炎链球菌、A群链球菌(GBS)和B群链球菌的研究表明,分拣酶催化锚定的菌毛亚单位(Sortaes-Assembled Pilus subunits),其菌毛亚单位组合能够诱导出依赖补体的调理吞噬杀死抗体和免疫保护抗体,可能成为发展新的免疫治疗选项[16-18]。Ebp为粪肠球菌表面菌毛,其在粪肠球菌毒力因子中发挥着关键作用[19-20],而且由粪肠球菌引发的心内膜炎病人血清中存在着较高滴度的抗EbpA、EbpB和EbpC抗体,证明Ebp在体内感染中可以良好表达[10]。目前,EbpA氮末端区域(EbpANTD)和EbpC已被证明具有预防小鼠导尿管相关的尿路感染(CAUTIs)和大鼠心内膜炎感染作用[21-22],但对Ebp菌毛其他亚单位蛋白作用和动物源菌株作用尚未见报道。
本次通过生物学信息软件对Ebp菌毛亚单位蛋白信号肽序列、胞外区和胞内区和抗原表位等进行预测,根据胞外区(去除信号肽区域)抗原表位预测结果,对抗原表位区域进行克隆、原核表达和纯化,免疫新西兰大白兔制备多抗,并进行了Western Blot特异性和生物膜阻断试验的功能性的初步验证,以期为动物源性粪肠球菌的Ebp菌毛进行系统的研究和免疫预防等打下坚实的基础。
1 材料与方法
1.1试验动物和菌株 试验用清洁级新西兰大白兔购自河南省实验动物中心,本试验中所使用的粪肠球菌N9(ebpA、ebpB和ebpC阳性)、N30(ebpA、ebpB和ebpC阳性)、4-2a(ebpB、ebpC阳性)分离株与大肠杆菌 BL21均由本实验室保存。
1.2试验主要试剂与仪器 脑心浸出液肉汤(BHI)、溶菌酶、卡那霉素、蛋白酶抑制剂(PMSF)和Ni-Agarose填料均购自康为世纪生物科技有限公司;佐剂购自美国SIGMA公司;DNA抽提试剂盒(细菌)、DNA胶回收试剂盒、2×SDS PAGE Sample Loading Buffe购自生工生物工程有限公司;HRP-羊抗兔IgG和DAB显色试剂盒均购自武汉博士德生物工程有限公司。PTC-200型PCR扩增仪(美国BIO-RAD公司),DYY-6C型电泳仪,超净化工作台和-80 ℃超低温冰箱(美国Thermo公司),H1650-W型常温离心机,JY98-Ⅲ型超声波细胞粉碎机(购自上海新芝生物技术研究所),电热恒温培养箱(购自上海跃进医疗仪器厂)。
1.4目的基因的PCR扩增 根据GenBank已发表的粪肠球菌OG1RF株的EbpA(ID:CP002621)、EbpB(ID:CP002621.1)和EbpC(ID:CP002621.2)序列,由 Primer Premier 5.0软件进行引物的设计(加粗部分为保护性碱基,下划线部分为酶切位点),见表1。使用生工生物工程(上海)有限公司的 Ezup 柱式基因组 DNA 抽提试剂盒(细菌)提取粪肠球菌N9株的基因组DNA,通过PCR反应对目的基因进行扩增,总反应体系为50 μL:2×Tap PCR Master Mix 15 μL、上下游引物各1 μL、模板DNA3 μL、双蒸水30 μL。PCR程序: 94 ℃预变性5 min,94 ℃变性1 min,退火1 min,72 ℃延伸,共35个循环,72 ℃延伸10 min。反应结束后,取8 μL产物进行1%琼脂糖凝胶电泳检测。
1.5重组表达质粒的构建与鉴定 抗原表位片段基因经1%琼脂糖凝胶电泳后,切胶使用生工生物工程股份有限公司的SanPrep柱式DNA胶回收试剂盒对目的基因进行纯化回收,将回收产物和pET-28a分别进行双酶切,使用T4DNA连接酶将其连接,构建重组表达质粒 pET-28a-EbpA1、pET-28a-EbpA2、pET-28a-EbpA3、pET-28a-EbpC1、pET-28a-EbpC2 和 pET-28a-EF1092A(EbpB),转化入E.coliDH5α感受态细胞,同时利用含有50 μg/mL的卡那霉素LB固体琼脂板进行筛选,挑取单个菌落在LB培养基中扩大培养。经菌液 PCR 初步鉴定后,提取阳性菌液的质粒进行双酶切鉴定。将菌液PCR和双酶切鉴定均为阳性的重组质粒送生工生物工程(上海)有限公司进行测序并对测序结果进行比对分析。

表1 引物序列及反应程序Tab.1 Primer sequence and reaction program
1.6重组蛋白的原核表达及纯化 将测序正确的质粒转化至E.coliBL21,37 ℃培养至对数生长期,经SDS-PAGE电泳检测以确定最佳诱导条件。将得到的菌液4℃、3 000 r/mim离心收集菌体进行超声破碎,分别取上清和沉淀进行蛋白电泳鉴定。包涵体蛋白采用尿素纯化方法纯化,可溶性重组蛋白采用镍柱纯化。
1.7多克隆抗体的制备 免疫前由耳缘静脉采血分离血清作为阴性对照。首次免疫时将蛋白与弗氏佐剂乳化完全后免疫新西兰大白兔,间隔14 d后使用弗氏不完全佐剂,之后每间隔7 d免疫1次。免疫完成后间隔1周进行采血分离血清,采用双向免疫扩散法检测抗体效价,若达到标准,大量心脏采血制备血清,-80 ℃保存。按照常规方法进行Western Blot分析,将重组蛋白经SDS-PAGE电泳转至NC膜,兔免疫血清为一抗,HRP-羊抗兔IgG作为二抗检测抗体的特异性。
1.8抗EbpA1蛋白、EbpA3蛋白和EbpC1蛋白的多抗对粪肠球菌生物膜阻断情况 粪肠球菌N9、N30及4-2a株于TSB液体培养基37 ℃培养过夜,调整菌液浓度为1.5×108CFU/mL。取200 μL上述菌液接种于TSB液体培养基37 ℃培养过夜,用含0.25%葡萄糖的TSB液体培养基稀释菌液,取其100 μL加入96孔板,同时每孔加入100 μL多抗,多抗的终浓度分别为1.5、0.75、0.375、0.187 5和0.093 8 mg/mL,每个梯度做6个平行,同时将含有相同数量不同菌株的粪肠球菌接种到含0.25%葡萄糖的TSB液体培养基中,按照与试验组一致的生物膜培养方法培养,但不加入制备的多抗进行阻断此作为阴性对照,将仅加入含有0.25%葡萄糖的TSB液体培养基,不加入粪肠球菌,然后与试验组一起按生物膜培养方法培养,最后加入制备的多抗(进行阻断),此作为空白对照。37 ℃培养36 h后,PBS洗涤3次,待风干后用甲醇固定,1%结晶紫染色15 min,蒸馏水洗涤至无色,然后加入无水乙醇溶解结晶紫,读取570 nm处的吸光度(A)值,所有试验均一式3份进行。
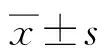
2 结 果
2.1抗原表位预测结果 在去除Ebp菌毛胞内区和信号肽序列后,共预测了6个抗原表位,分别位于EbpA、EbpB和EbpC的N端,EbpA亚单位蛋白有3个抗原表位,氨基酸位置为1~389aa、390~755aa和751~1072aa,分别命名为EbpA1、EbpA2和EbpA3;EbpB有1个抗原表位,氨基酸位置28~438aa,命名为EbpB1;EbpC有2个抗原表位,氨基酸位置33~359aa和304~600aa,命名为EbpC1和EbpC2。
创新考核导向机制,解决“给足力”的问题。为避免“人在心不在,手到力不到”的问题,尽可能集聚起最强大的攻坚力量,强化了脱贫的考核权重,把促进贫困村经济发展、农村贫困人口减少、农村居民人均可支配收入等作为重要考核内容,将乡镇和市直部门单位脱贫攻坚考核权重均提高至60%,并设立脱贫攻坚先进工作奖,把力量全部引导到脱贫攻坚上来,引导到真脱贫上来。
2.2抗原表位的PCR扩增 以粪肠球菌N9株的基因组DNA为模板,使用本试验1.4的引物反应条件和反应体系对各抗原表位进行PCR扩增,扩增结果经琼脂糖凝胶电泳,其结果与预期结果大小一致,见图1。
M为DL2000 DNA Marker; 1为ebpA1; 2为 ebpA2; 3为 ebpA3; 4为ebp B1; 5为ebp C1; 6为ebp C2; 7为Negative control图1 基因片段PCR扩增结果Fig.1 PCR amplification results of gene fragment
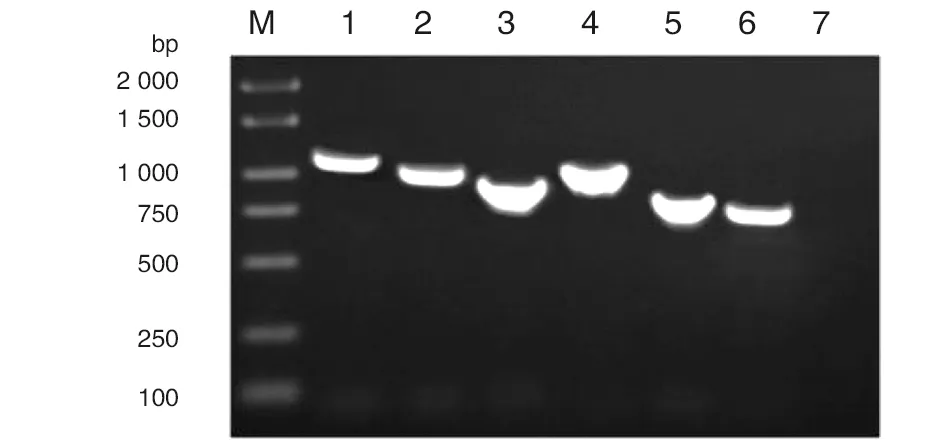
2.2重组表达质粒的鉴定 重组表达质粒 pET-28a-EbpA1、pET-28a-EbpA2、pET-28a-EbpA3、pET-28a-EbpC1、pET-28a-EbpC2和pET-28a-EF1092A (EbpB)双酶切结果与预期结果相一致(图2),即在相应的质粒和片段处分别出现了相应的条带,而且经比对后序列正确。
M为DL5000 DNA Marker; 1为 pET-28a-ebpA1; 2为pET-28a-ebp A2; 3为 pET-28a-ebp A3;4为pET-28a-ebp B1; 5为pET-28a-ebp C1; 6为pET-28a-ebpC2图2 重组表达质粒的双酶切鉴定结果Fig.2 Identification results of Recombinant expression plasmid through double Enzymatic digestion
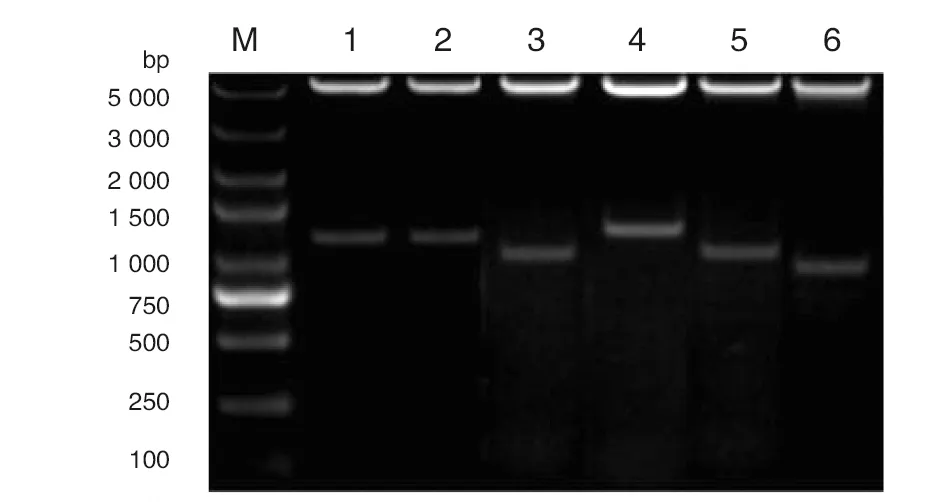
2.3重组蛋白的表达及鉴定 优化条件后,重组质粒pET-28a-EbpA1、pET-28a-EbpA2、pET-28a-EbpA3、pET-28a-EbpC1、pET-28a-EbpC2和pET-28a-EbpB1的表达菌最佳诱导表达条件为:诱导温度37 ℃、IPTG终浓度0.2 mmol/L、诱导时间6 h。重组蛋白EbpA1和EbpA2主要以包涵体形式表达,重组蛋白EbpA3、EbpC1、EbpC2和EbpB1主要以可溶性形式表达。各重组蛋白大小分别为46.7、45.0、39.4、50.0、39.3、36.0 kD,与预期结果一致,其纯化结果见图3。
M为Marker; 1-6为Represent the recombinant protein EbpA1、EbpA2、Ebp A3、EbpB1、EbpC1、Ebp C2 respectively;7为 BL21; 8为 pET-28a empty vector is induced; 9为 pET-28a empty vector is not induced图3 重组蛋白的鉴定结果Fig.3 Identification results of recombinant protein
2.4多抗效价的测定 家兔免疫重组蛋白后进行采血制备血清,采用双向免疫扩散实验检测抗血清效价,结果重组蛋白EbpA1、Ebp A2、EbpA3、EbpB1、EbpC1和 EbpC2的多抗的效价分别为1∶16、1∶8、1∶32、1∶64、1∶32和1∶64,证明6个抗原表位蛋白均具有较好的特异性。
2.5Western Blot分析结果 经原核表达并纯化的EbpA1、Ebp A2、Ebp A3、Ebp B1、Ebp C1和EbpC2共6种重组蛋白经免疫印迹检测,结果发现6种重组蛋白均可与多抗血清进行反应,其大小与预期结果一致,分别为46.7、45、39.4、50、39.3、36 kD,见图4。
2.6各亚单位蛋白多抗对粪肠球菌N9、N30及4-2a株生物膜阻断结果 粪肠球菌菌毛亚单位蛋白EbpA1、EbpA2、EbpA3、EbpB1、EbpC1、EbpC2多抗浓度对N9、N30以及4-2a菌株生物膜形成影响不同,而且仅有多抗EbpA1、EbpA3和EbpC1对粪肠球菌生物膜的形成有阻断作用,因此仅研究多抗EbpA1、EbpA3和EbpC1的生物膜形成阻断作用。多抗EbpA1和EbpC1在浓度为0.375 mg/mL时对N9和N30菌株生物被膜形成的阻断作用最强,多抗EbpA3在浓度为0.75 mg/mL时对N9和N30菌株生物被膜形成的阻断作用最强,而4-2a菌株只有在多抗EbpC1浓度为0.375 mg/mL时对生物被膜形成的阻断作用最强,与阴性组相比,差异有统计学意义(FEbpA1-N9=6.645、FEbpA1-N30=5.089、FEbpA3-N9=3.633、FEbpA3-N30=4.441、FEbpC1-N9=4.338、FEbpC1-N30=6.149、FEbpC1-4-2a=5.880,均P<0.05),如表2。
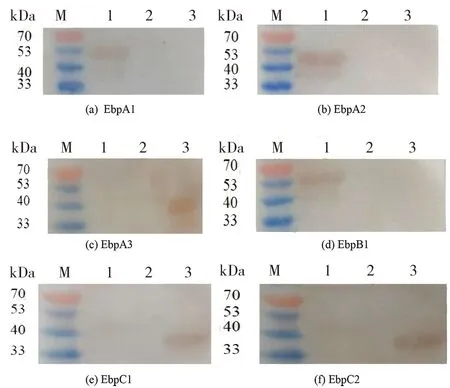
(a)(b)(d) M为Marker; 1为 Recombinant protein EbpA1、EbpA2、EbpB1; 2为 pET-28a empty vector is induced; 3为The recombinant plasmid was not induced;(c)(e)(f) M为Marker; 1为pET-28a empty vector is induced; 2为The recombinant plasmid was not induced; 3为Recombinant protein EbpA3、EbpC1、EbpC2图4 各重组蛋白的免疫原性Fig.4 Immunogenicity of the recombinant proteins
3 讨 论
一般来说毒力因子是预防细菌感染的良好免疫原,但在粪肠球菌众多的公认毒力因子中,临床感染菌株毒力因子携带数量和携带率仅是较其它来源的的菌株较高[6],而且,血液菌株中肠球菌毒力因子表达与致病性没有必然的相关性[23]。目前仅有AS被作为免疫原进行了评估,而AS在人心内膜炎和菌血症菌株中的携带率仅分别为26%~52%和32%~77%[24],在猪的临床菌株中携带率仅为20.6%[6]。荚膜多糖是革兰氏阳性细菌细胞壁主要成分,对肠球菌的致病性起着推动作用,但聚糖在各微生物之间是不同的,并且只有与载体蛋白结合后才能起到良好的免疫作用[23]。
菌毛是许多革兰氏阳性细菌肽聚糖壁锚附的一种多聚蛋白结构,由于它的致病作用和抗体的易接近性,很容易成为抗体介入的目标[22]。Hendrickx等[25]已经评估了革兰氏阳性无乳链球菌、化脓链球菌和肺炎链球菌菌毛疫苗的有效性,而且在多个动物模型中都可以提供明显的保护作用。肠球菌与其他革兰氏阳性细菌菌毛具有直系同源结构,而且,粪肠球菌Ebp菌毛在临床分离菌株中的携带率超过94.59%,在屎肠球菌临床分离菌株和环境分离菌株中的分离率也高达81.81%[26]。
表2 多抗EbpA1、EbpA3、EbpC1对粪肠球菌株生物膜生成的影响Tab.2 Effect of polyclonal antibody of EbpA1、EbpA3、EbpC1 on the biofilm information of E.faecalis strain
亚单位疫苗较传统疫苗具有高安全性和高效性特点[27]。本次在ebpA、ebpB和ebpC基因共预测了6个抗原表位,其中EbpA1、EbpA3和EbpC1亚单位多抗在生物膜形成中有阻断作用。多抗对N9、N30及4-2a菌株生物膜的不同阻断能力可能是由于粪肠球菌Ebp表达效率不同,其表达效率在30%~72%之间[28]。本试验中所用4-2a菌株由于缺失ebpA基因,导致多抗EbpA1和EbpA3对其生物膜形成的阻断作用不明显。Sillanpää Jouko[21]等人观察到ΔebpA缺失株与ΔebpABC三重缺失株的生物膜形成水平一致,而且发现ebpA的缺失能影响其他ebp菌毛亚单位的整体水平,进一步验证了在生物膜形成过程中EbpA比EbpC重要,这在本试验阴性对照中4-2a菌株生物膜形成量较N9和N30菌株低这一现象相一致。Flores-Mireles等[21]报道了人源粪肠球菌EbpA的氨基末端域具有免疫原性,其血清可以阻止小鼠尿道炎发生,Pinkston等[22]也报道了EbpC单克隆抗体可以保护小鼠免受心内膜炎的干扰,其中Flores-Mireles试验结果与我们预测的结果基本一致。
菌毛在生物膜形成、黏附及侵入均有作用,本次仅对Ebp亚单位多抗对粪肠球菌生物膜形成的阻断作用进行验证,下一步工作将是对Ebp亚单位多抗对包括粪肠球菌在内的其他肠球菌的肠道细胞黏附、侵入阻断作用以及对动物攻毒的保护作用进行实验,以便进一步分析6个亚单位蛋白的免疫保护作用,为开发肠球菌免疫预防和治疗以及血清学诊断方法奠定基础。
利益冲突:无

