镉胁迫后旱柳转录组变化分析
曹继敏,李双财,何德
·农业生物技术·
镉胁迫后旱柳转录组变化分析
曹继敏,李双财,何德
西南林业大学 生命科学学院,云南 昆明 650224
随着重金属镉(Cd) 应用范围的扩大,由此引发的土壤镉污染问题日益严重。以具有植物恢复潜力的旱柳作为研究对象,探究不同浓度的Cd (2.5 mg/L, 50 mg/L) 胁迫后旱柳无性系1 d、7 d和30 d后基因表达与代谢通路的变化。转录组测序结果表明:共获得102 595个非冗余基因 (Unigenes),相同浓度不同时间的差异基因总数为26 623个和32 154个;相同时间不同浓度的差异基因总数为8 550个、3 444个和11 428个。从中筛选得到与Cd胁迫响应密切相关的基因25个,其中金属硫蛋白、ABC转运蛋白、锌和锰转运蛋白等基因的表达不仅会随着Cd胁迫浓度变化而且同时受到胁迫时间的改变而发生改变;油菜素内酯合成通路的ROT3和黄酮类化合物合成通路的FLS、F3H均明显上调。此外Cd胁迫引起旱柳在代谢过程、细胞过程、膜、细胞器、细胞、细胞部分、催化活化和结合蛋白这8个方面发生改变,参与这些GO条目的差异表达基因数随着Cd浓度和胁迫时间的增加而增加。并对转录组信息的可靠性用RT-PCR和酶活性生理实验数据进行了验证。文中通过转录组测序分析旱柳Cd胁迫后的响应机制,从而为旱柳修复土壤Cd污染提供理论指导。
旱柳,镉,转录组,差异表达基因
近年来随着金属镉(Cd) 应用的扩大与加速,Cd污染途径迅速增多,如工业废气会将Cd带到气流层中,并以大气沉降、降雨以及下雪等方式进入土壤中,造成土壤Cd污染;同时,农业上的污水灌溉以及含Cd药剂的使用都会使Cd进入土壤,从而加重土壤的Cd污染,Cd已成为造成全球污染最主要的重金属之一。此外土壤中的Cd主要通过根的吸收进入植物体内,然后与根细胞的细胞壁结合,后经木质部运输到茎、叶、果实等器官中积累,抑制植物的生长发育[1]。Cd可以通过食物链进入动物和人体内,对机体造成严重伤害。过量Cd积累导致肺纹理增多、紊乱而模糊,白细胞和中性粒细胞数量增多,引起肺泡Ⅱ型上皮细胞毛细血管内皮细胞受损,使肺泡间隔增厚,间质纤维增生,也会直接作用于骨骼,使有机体骨骼矿化发生障碍、骨钙溶出的增加以及骨胶原和骨的固化作用异常等[2–3]。20世纪60年代发生在日本神通川流域的“骨痛病”,原因就是当地居民食用富含重金属Cd的大米造成的。在我国,土壤Cd污染日益严重,并造成了一系列问题,例如“镉大米”、农作物减产等[4]。
重金属污染问题亟待解决,但是传统的物理、化学修复的方法存在不可避免的缺陷[5]。例如常用的工程治理法存在成本高昂且工程量大的问题。同时由此带来的土壤自身结构破坏问题也不容忽视。电动修复、土壤淋洗等方法操作复杂,可行性较差。植物修复以其成本低、安全可靠、对环境干扰小且改善生态环境等优点备受关注[6],木本植物作为多年生植物不仅有庞大的根系、巨大的生物量、发达的维管组织、坚固的木质组织、高效的蒸腾作用,还具有吸收多种重金属的优势,成为环境重金属污染治理的重要研究对象[7]。旱柳作为一种常见的木本植物,具有生长快、易繁殖、生物量大、根系发达、再生能力强和对多种重金属耐受的特点,在重金属污染治理方面具有较大的潜力[8-9]。
转录组测序 (RNA-Seq) 技术可以研究所有mRNA转录本的丰度信息,其样本检测甚至不以完整基因组序列为前提,能够发掘新的转录本和可变剪接体[10],且可以得到定量更准确、分析更可靠、重复性更高及检测范围更广的结果[11]。当前对旱柳重金属耐受性的研究主要集中在对重金属的植物体内富集情况的调查、影响因素、生理变化等方面,对重金属富集后植物耐受的分子机理研究较少,尤其在转录水平上研究很少。旱柳在受重金属Cd胁迫后,mRNA的表达水平发生了重大的变化,因此本研究从转录水平着手,探究旱柳在Cd胁迫条件下的耐受性反应情况,为旱柳修复土壤Cd污染提供理论指导。
1 材料与方法
1.1 试验材料
本研究所用的旱柳枝条均来源于云南省昆明市北京路延长线附近的一株旱柳。截取长度为25 cm的一年生旱柳枝条用改良的霍格兰德营养液[12]进行水培。水培后的旱柳随机分成3组(每组5盆,每盆3棵),1组为对照组,其余2组为实验组。用Cd (NO3)2对实验组进行Cd处理,使盆里的Cd浓度分别为2.5 mg/L和 50 mg/L,每3 d换一次营养液。用随机混取法采集3组的第0、1、7、30天并处于同一位置的叶片作为研究材料;所有试验叶片采集完成后液氮急速冷冻后放置于−80 ℃冰箱内保存备用。对照组用CK表示, 2.5 mg/L处理组用L表示,50 mg/L处理组用H表示;样品编号如下:第0天分别为CK0、L0、H0,第1天分别为CK1、L1、H1,第7天分别为CK7、L7、H7,第30天分别为CK30、L30、H30。
1.2 总RNA提取及样品检测
总RNA提取按照OMEGA公司的E.Z.N.ATMPlant RNA Kit试剂盒说明书进行。获得的总RNA用琼脂糖凝胶电泳检测,并用液相色谱Agilent 2100和260/280的比值检测RNA的纯度。
1.3 文库构建及转录组测序
样品检测合格后,加入破碎缓冲液将mRNA打断成短片段,用六碱基随机引物以mRNA为模板合成cDNA第一条链,然后加入缓冲液、dNTPs和DNA polymeraseⅠ合成cDNA第二条链,双链cDNA经AMPure XP beads纯化后进行cDNA的末端修复、加A尾后连接测序接头,用AMPure XP bead选择片段大小,最终cDNA文库通过PCR富集得到。cDNA文库质量通过Agilent 2100检测,再经深圳华大基因生物科技有限公司的Illumina Hi-Seq2500平台完成RNA-Seq测序。
1.4 De novo组装
获得的原始数据(Raw reads) 经过滤得到干净数据 (Clean reads)。使用Trinity对clean reads组装得到contigs,之后再用Tgicl对转录组样本进行两次聚类去冗余得到最终Unigene。Unigene分为两部分,一部分是clusters,是进一步去冗余后的结果;其余的是singletons,指没有聚类、单独的Unigene。每个样品测序产出不少于6 Gb Clean data,Q30碱基百分比要达到85%。
1.5 生物信息学分析
使用BlAST对Unigene序列与Nr、Nt、KOG、KEGG、GO、Swiss-Prot及InterPro数据库进行比对(E value<1e-5),获取与旱柳Unigene具有最高序列相似性的蛋白,从而得到该Unigene的蛋白功能注释信息。
本研究从两个角度分析旱柳在Cd胁迫后的差异基因表达情况:1) 同一时间不同浓度Cd胁迫的差异基因表达情况的对比分析,命名为L1-CK1 (即L1和CK1两个样品的基因表达对比,下同)、H1-CK1、L7-H7、L30-CK30、H30-CK30;2) 同一浓度不同时间的差异基因表达情况对比分析,分为2.5 mg/L组和50 mg/L组,命名为L1-CK0、H1-CK0、L7-L1、H7-H1、L30-L7、H30-H7。
使用Blast2GO和WEGO软件对差异表达的Unigene进行GO功能分类[13],并将其注释到KEGG数据库中,之后进行pathway分析[14]。最终得到2.5 mg/L和50 mg/L浓度Cd胁迫后不同时间旱柳的生理生化响应结果。
1.6 差异表达基因qPCR验证
在BIO-RAD公司的C1000TM荧光定量PCR仪进行real-time PCR反应,每个样品重复3次,反应体系20 μL。以内参基因为对照[15],利用公式2-△△Ct计算其相对表达量。
1.7 抗氧化酶活性测定
植物在受到重金属胁迫后,会通过调动各种酶来保护自身机体,因此植物抗氧化酶的酶活性变化是一个非常重要的反映植物生理状态与抗逆性的指标。为验证旱柳镉胁迫后转录组信息的可靠性,对旱柳的SOD、POD、CAT的酶活性进行了测定[16]。
2 结果与分析
2.1 转录组测序与De novo组装
9个样品的raw reads数在72.22 Mb到85.59 Mb之间,过滤后的总clean reads在65.17 Mb到67.15 Mb之间;Q20、Q30以及过滤前后的reads的比率分别为95.04%到97.38%,86.40%到90.91%,72.75%到89.4% (表1),这说明低质量的碱基比率低,测序质量好,可以用于下一步的组装。使用Trinity对其进行组装,所有样品的总reads数均超过10万,总长度超过7 000万,平均长度超过600,N50超过1 000,GC含量42%左右。接下来使用Tgicl对转录本进行聚类去冗余得到Unigene,聚类后的Unigene质量见表2,10个样品的Unigene数为53 705个到62 933个,总长度从43 247 382 nt 到50 853 969 nt,N50值都在 1 200之上,这表明组装质量高,可用于后续分析。
2.2 对Unigene的功能注释
得到的Unigene有83.93%能在7个数据库(Nr、Nt、KOG、KEGG、GO、Swiss-Prot及InterPro)中任意一个注释到,其中Nt数据库注释到的Unigenes最多,占所有Unigenes的81.12%,但被全部数据库注释到的Unigenes仅为29.04%,表明有许多旱柳Unigenes的功能还没有完全明确。Nr数据库比对结果进行筛选,筛选条件为E值小于10−5,结果显示有74 919条Unigenes在Nr数据库中找到了同源蛋白序列,占总Unigenes数的73.02%。
2.3 差异表达基因分析
FDR (False discovery rate) 值越小,表明基因表达差异越大,差异越显著。本研究在筛选差异表达基因时设置的阈值为Fold Change≥2.00、FDR≤0.001、Q-value<0.05。
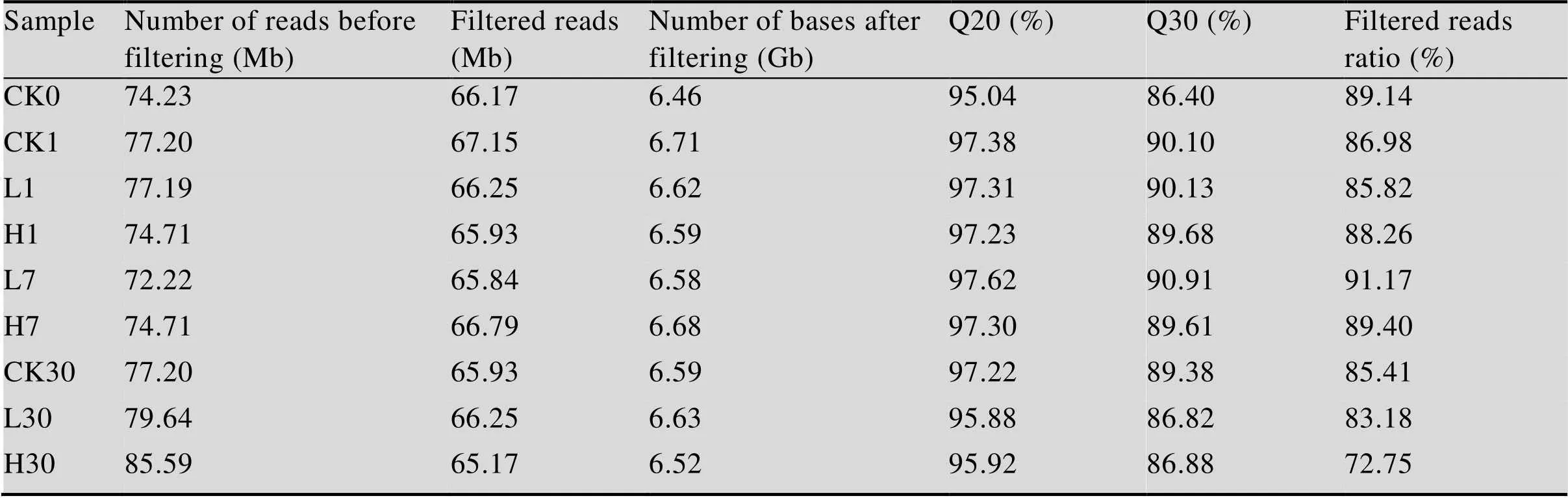
表1 过滤前后的reads质量统计表

表2 Unigene的质量指标
根据表3可知,相同时间不同浓度的差异表达基因 (Differentially expressed genes,DEG) 分析表明:第1天组(L1-CK1和H1-CK1) 中的差异基因数为8 550个(3 660个上调和4 890个下调);第7天组(L7-H7) 的差异基因数为3 444个(1 307个上调和2 137个下调);第30天组(L30- CK30和H30-CK30) 中的差异基因数为11 428个(5 055个上调和6 373个下调)。相同浓度不同时间的DEG分析表明:2.5 mg/L组(L1-CK0、L7-L1、L30-L7) 中的差异基因数为26 623个 (14 531个上调和12 092个下调;50 mg/L组(H1-CK0、H7-H1、H30-H7) 中的总差异基因数为32 154个(18 318个上调和13 836个下调),这表明50 mg/L浓度的镉胁迫比2.5 mg/L的对旱柳的影响更加明显,这些差异表达基因可能在胁迫过程中起关键作用。此外,在L1-CK1、H1-CK1、L30-CK30和H30-CK30这4组中有共同的170个DEG (其中46个共同上调和29个共同下调),它们的基因表达量差异达2倍 (|Log2ration|≥1)以上。170个DEG中又有25个其表达量差异是大于1 000倍 (|Log2ration|≥10)以上的,其中19个是上调,6个下调(表4)。金属硫蛋白基因、ABC转运家族、锌和锰转运蛋白家族的基因表达会随着Cd浓度的增高和胁迫时间的增加而有较大的变化,L7-L1、L30-L7、H7-H1、H30-H7组中金属硫蛋白共9个上调、11个下调;ABC转运家族共90个上调、88个下调,其中H30-H7中32个上调、50个下调;锌和锰转运蛋白家族有28个下调、8个上调,这些结果表明旱柳在应对Cd胁迫的过程中金属硫蛋白基因、ABC转运家族及锌和锰转运蛋白起了很大的作用,也说明Cd胁迫会影响旱柳对其他金属离子的吸收,锌和锰转运蛋白表达量的变化可能是因为Cd在生命体内会置换锌,导致生命体需锌的蛋白质发生“饥饿”,为了生命正常活动的进行,旱柳加快了锌的转运过程,从而使锌、锰蛋白转运蛋白家族的表达发生变化。
2.4 Unigene GO功能分类
根据Nr数据库注释的信息结果显示,有51 494条Unigene 映射到GO不同的功节点(Term)上,根据生物过程(Biological process)、细胞组成(Cellular component)、分子功能(Molecular function)进行分类。由于经常有同一个转录本映射到不同节点现象,所以在生物过程中有106 517条,占42.69%,参与代谢过程(Metabolic process) (22 955,21.54%)、细胞过程(Cellular process) (21 034,19.75%)的Unigene最多;在细胞组成中有92 900条,占37.24%,参与膜(Membrane) (15 182,16.34%)、细胞器(Organelle) (13 010,14.01%)、细胞(Cell) (16 820,18.11%) 和细胞部分(Cell part) (16 671,17.95%) 的Unigene最多;在分子功能中有50 054条,占20.06%,参与催化活性(Catalytic activity) (20 318,40.59%) 和结合蛋白(Binding) (20 533,41.02%) 的Unigene最多(图1)。
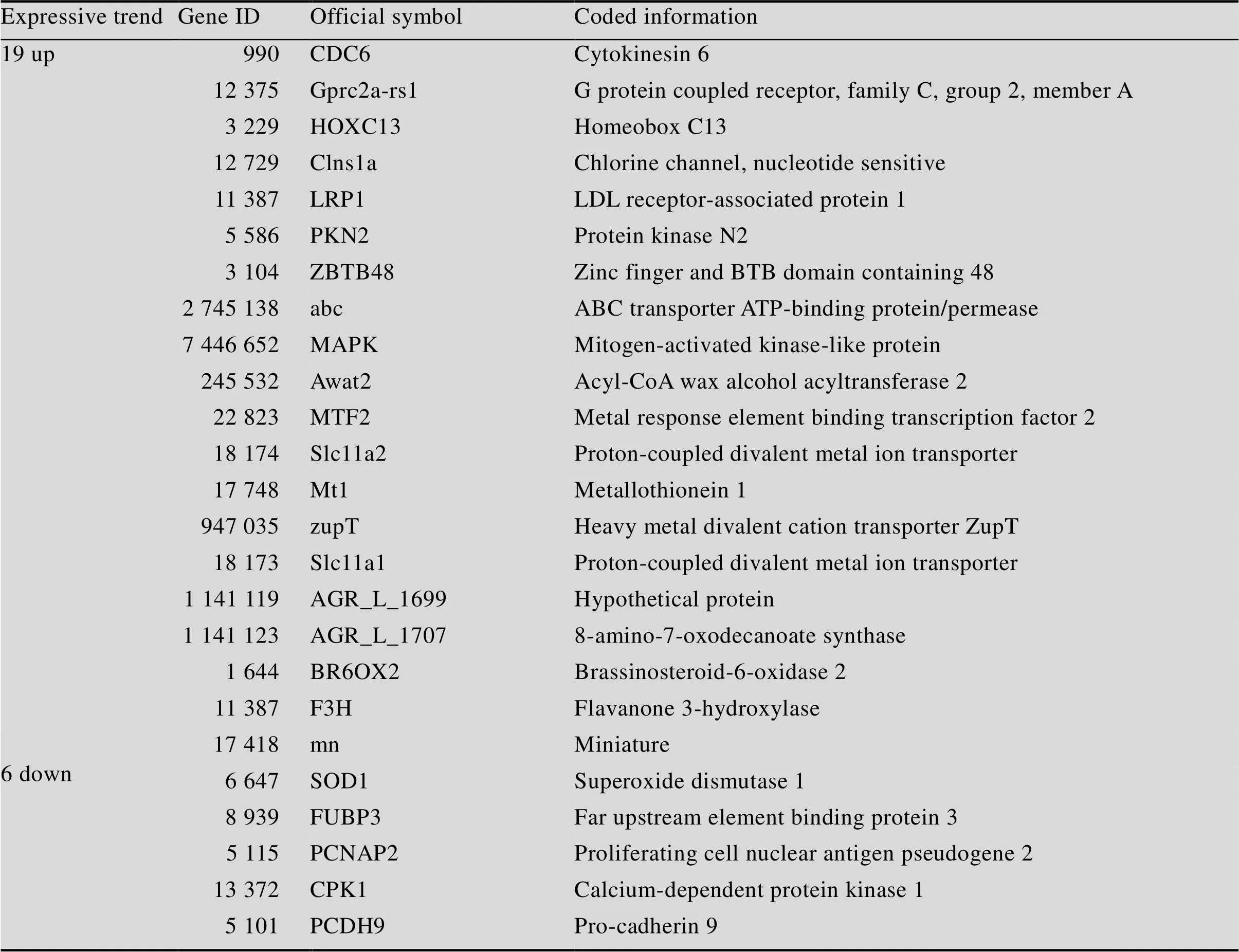
表4 抗逆相关基因详细情况
2.5 Unigne的KEGG注释和代谢通路分析
将旱柳差异表达基因在KEGG数据库中进行比对,53 966个Unigene注释到KEGG数据库的6个一级层级和21个二级层级中,共包含137条通路。其中在同一个通路中10个以上差异表达基因主要涉及细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢以及有机系统6个方面。这6个方面中代谢类的涉及最多,包括碳水化合物、氨基酸、多糖生物合成、能量、次生物质等;涉及人类疾病的最少,仅仅只有2个,为“内分泌和代谢性疾病” (Endocrine and metabolic diseases) 和耐药性:抗菌素(Drug resistance:Antimicrobial)。旱柳Cd胁迫后KEGG分析中有涉及人类疾病的基因发生变化,这也说明Cd对旱柳当中有关涉及人类疾病的内分泌和抗菌素的代谢有影响。同时,pathway富集结果也显示,前述的25个Cd胁迫响应候选基因主要参与代谢途径(Metabolic pathway) (10 541,19.53%)、次级代谢产物的合成(Synthesis of secondary metabolites) (5 473,10.14%)、植物MAPK信号通路(Plant MAPK signaling pathway) (1 592,2.95%)、植物病原互作(Plant pathogen interaction) (1 761,3.26%)、植物激素信号转导(Plant hormone signal transduction) 等通路(1 862,3.45%) (表5)。由此推测旱柳可能主要是通过这些代谢通路调控Cd抗逆性过程。
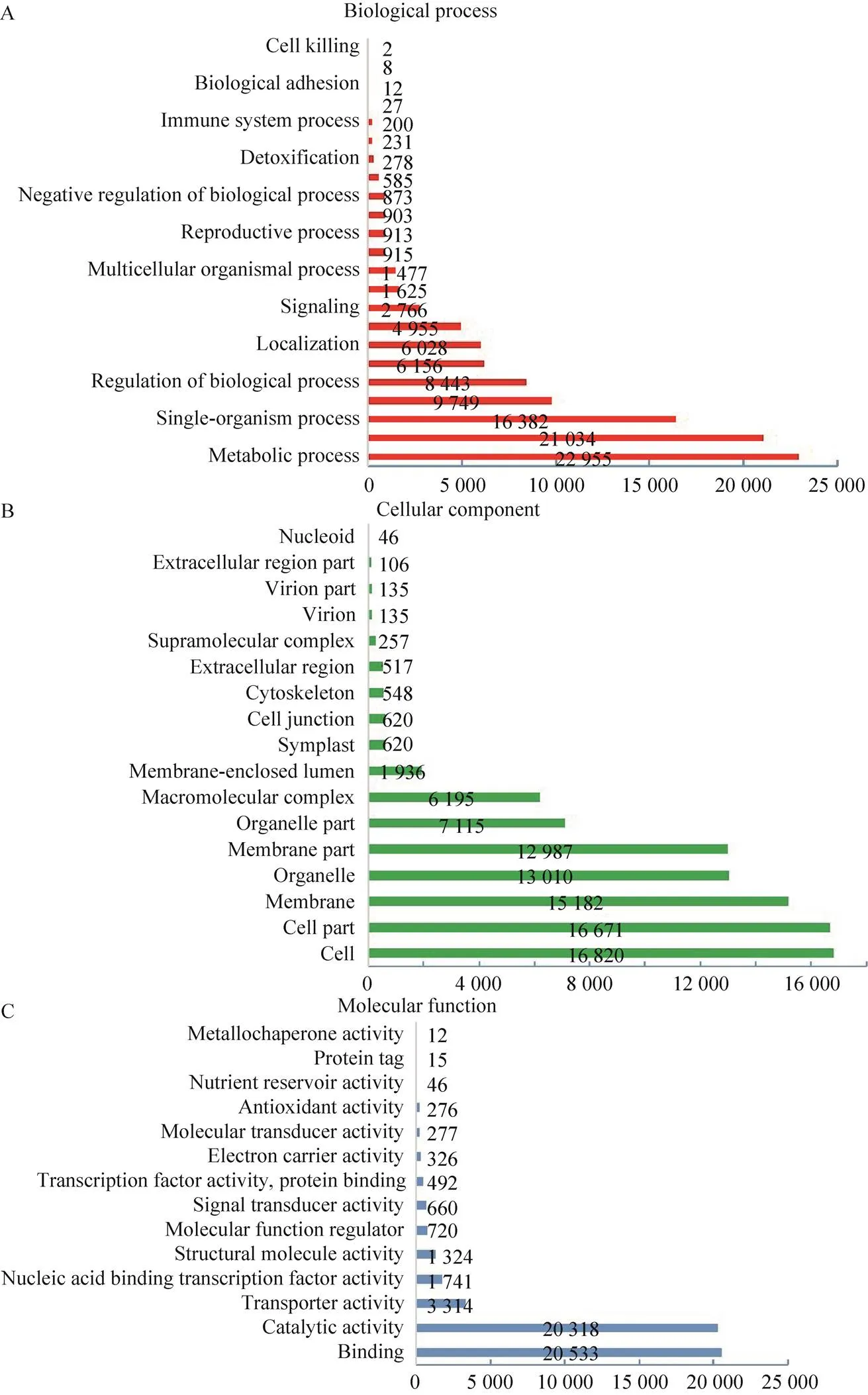
图1 Unigene的GO分类图
2.6 差异基因的qPCR
从25个旱柳Cd胁迫响应候选基因中选择在代谢通路中显著上升的3个(黄酮类化合物生物合成和油菜素内酯合成的关键基因:flavonoid synthase (FLS) (Unigene3229_All)、flavanone-3-hydroxylase (F3H) (CL11387.Contig1_All)和3-epi-6- deoxocathasterone 23-monooxygenase (ROT3) (CL1644.Contig4_All) 基因和1个calcium- dependent protein kinase 2 (CL13372.Contig3_All) 共同下调基因进行qPCR验证转录组测序分析的准确性和可靠性,以肌动蛋白基因() (CL10874.Contig2_All) 为内参基因。图2–6的qPCR结果显示,4个差异表达基因在转录组测序中的表达变化与荧光定量结果基本一致,说明转录组测序分析的结果真实可靠。
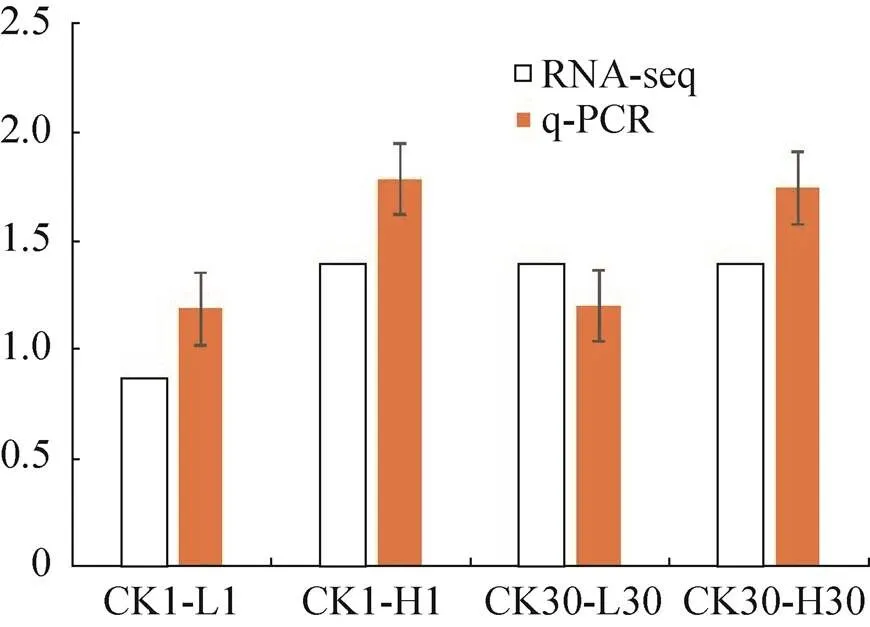
图4 CL1644.Contig4_All基因qPCR结果
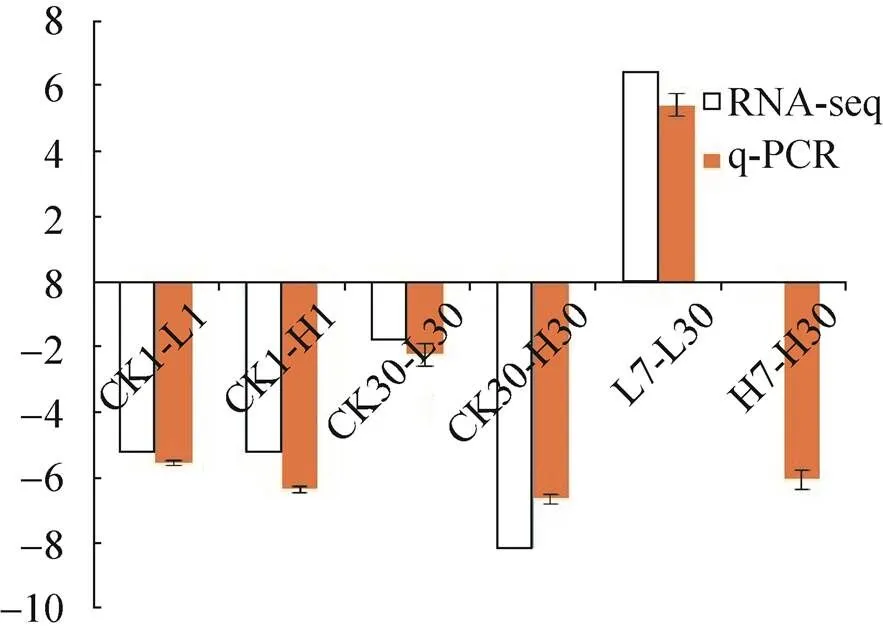
图5 CL13372.Contig3_All基因qPCR结果
2.7 抗氧化酶活性
根据表6可知,在镉胁迫条件下,旱柳在7 d之前(包括第7天) 会因为镉的胁迫而导致其SOD的活性下降,而到了第30天,它们的活性会超过对照组,达到显著水平(<0.05)。这可能是由于旱柳的保护酶在应对镉胁迫过程中需要一段时间的适应。旱柳POD活性会随着镉胁迫时间的延长而出现上升-下降-上升的趋势。根据表7可知,其基因表达也是如此,CAT的表达量受镉胁迫的影响较少,仅有个位数的CAT基因表在受到镉胁迫后发生改变,但对其活性影响较大,这可能是由于镉影响旱柳细胞环境造成CAT活性改变而引起的在镉的胁迫下。旱柳的SOD活性和基因表达量会随着胁迫时间的增加而出现先下降在上升的趋势;POD的活性和基因表达量会随着 胁迫时间的增加而出现上升-下降-上升的趋势;镉对CAT的活性影响较大,但对基因表达影响却不大。
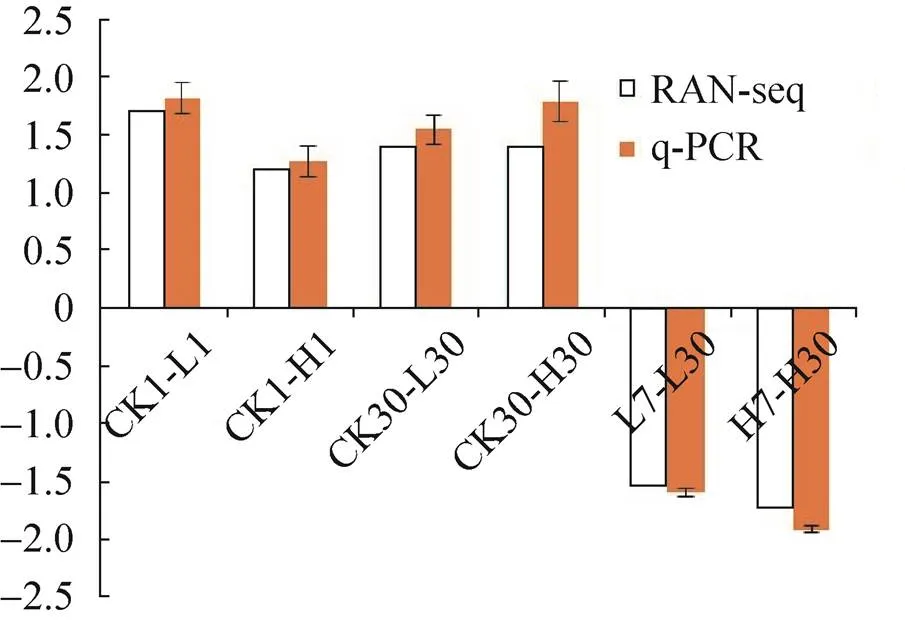
图6 CL10874.Contig2_All基因qPCR结果
表6 不同镉浓度胁迫及其胁迫时长对旱柳SOD、POD、CAT活性影响
Different lowercase letters indicate significant difference (<0.05), and the same letter or no letter indicates that the difference is not significant (>0.05).
3 讨论
近年来对植物响应重金属胁迫后的基因表达研究已取得不少成果,鉴定和推测出不少关于重金属响应的基因,包括ABC转运家族、锌和锰转运蛋白家族、重金属ATP酶(HMAs) 家族、阳离子扩散促进者(CDF) 家族、植物螯合肽合成基因(PCS)、金属硫蛋白基因(MT) 和金属忍耐蛋白基因(MTP)等[17]。金属硫蛋白基因对于细胞内重金属离子以及自由基的清除具有重要的作用,无论Cd诱导与否,金属硫蛋白基因在杞柳体内表达量均很高,前人研究表明杞柳[18]叶片中金属硫蛋白基因在Cd胁迫条件下表达上调。旱柳响应Cd胁迫的过程中,金属硫蛋白基因表达会随着Cd浓度的增高和胁迫时间的增加而上调。
ABC转运家族基因表达量发生明显变化,说明旱柳在Cd胁迫响应中细胞物质跨膜转运主要是通过ABC转运家族蛋白来实现的,也说明ABC转运家族在旱柳细胞运送重金属相关物质中起重要作用。杞柳在Cd胁迫条件下反应与旱柳基本一致,其中在生物学过程中分布最多的是细胞学过程、代谢过程和环境响应相关的基因。在分子功能大类中大部分基因与结合、催化活性和转运子活性相关、细胞组分中主要集中在细胞、细胞分区以及细胞器相关的基因。
旱柳在高盐胁迫下表现出与重金属胁迫不同的反应模式,研究表明高盐胁迫主要影响的是旱柳细胞途径、遗传信号响应、环境信号响应、新陈代谢和生物系统5个方面;其中包括碳水化合物、氨基酸、多糖生物合成、能量、次生物质等新陈代谢类最大,生物系统类是最小的。镉胁迫主要影响的是细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢以及有机系统6个方面;其中代谢类的涉及最多,包括碳水化合物、氨基酸、多糖生物合成、能量、次生物质等;涉及人类疾病的最少,仅仅只有2个。盐胁迫差异基因主要参与的核糖体、植物激素信号转导、淀粉蔗糖代谢、碳代谢以及植物病原菌的相互作用等通路[19],镉胁迫差异基因主要参与代谢途径、次生代谢产物的合成、植物MAPK信号通路、植物病原互作、植物激素信号转导等通路。
旱柳在受高盐胁迫后,其不定根展现出与不同的抗性机制来对抗盐胁迫,随着盐胁迫时间的延长SOS系统的负调因子基因编码GI蛋白持续下调,说明SOS系统的活性在不断增强。参与ROS清除的基因包括过氧化氢酶、超氧化物歧化酶、过氧化物酶、谷胱甘肽过氧化物酶、谷胱甘肽S-转移酶家族蛋白、SRO5蛋白等。说明旱柳不定根通过启动SOS系统与ROS清除系统两套机制来对抗盐胁迫[20]。旱柳镉胁迫后与其一致。
黄酮类化合物是植物体内一类在抗菌、抗逆性上具有重要的作用的化合物,是一种良好的抗氧化剂,能够清除生物膜周围和细胞内的H2O2[21-22]。有研究表明,黄酮化合物的代谢通路在水稻响应Cu2+和Cd2+的胁迫以及组培旱柳苗响应Cd2+中起了积极作用[23-24]。孙爱清等[25]的研究发现干旱也会对类黄酮代谢相关基因的表达量产生影响,而本研究发现Cd胁迫同样提高了旱柳黄酮类相关基因的表达量,这些结果充分说明黄酮类代谢相关基因在植物发挥抗逆性的过程中产生重要作用。
同时,我们也发现油菜素内酯合成通路的(ROT3) 在除L1-CK1外,在其他样品中都是上调。本研究的结果与靳开川等[26]的研究结果一致,旱柳在受Cd胁迫后ROT3基因显著上调,而他们结合遗传学、基因与蛋白质组学、细胞生物学等多学科方法和手段,研究发现多种极端环境(干旱、高盐、高温、低温、重金属) 均影响油菜素内酯在植物中的含量,充分表明了ROT3在植物发挥抗逆性过程中不可或缺。王喆等[27]研究表明油菜素内酯可能会与膜蛋白结合,然后通过减轻重金属胁迫来提高代谢活性,从而降低植物对重金属的摄取能力[28]。本文对旱柳受Cd胁迫的转录组进行了差异基因的分析,找到了受胁迫的相关基因以及与之相关的代谢通路,但这些基因是如何互相作用调节旱柳Cd胁迫,还需要在分子方面进行更加深入的分析。
[1] Zhang CL, Chen L, Jiang Y, et al. Research progress of phytoremediation for soil pollution caused by lead and cadmium. China Biogas, 2019, 37(2): 40–44 (in Chinese). 张彩丽, 陈磊, 江懿, 等. 土壤铅镉污染修复中植物修复技术的研究进展. 中国沼气, 2019, 37(2): 40–44.
[2] Liu SS, Li B, Feng X, et al. Three kinds of plants: remediation on soil contaminated by cadmium. Chin Agric Sci Bull, 2018, 34(22): 103–108 (in Chinese). 刘沙沙, 李兵, 冯翔, 等. 3种植物对镉污染土壤修复的试验研究. 中国农学通报, 2018, 34(22): 103–108.
[3] Cui YJ, Zhao ZQ, Liu WJ, et al. Transfer of cadmium through soil-plant-human continuum and its affecting factors. Acta Ecol Sin, 2003, 23(10): 2133–2143 (in Chinese). 崔玉静, 赵中秋, 刘文菊, 等. 镉在土壤-植物-人体系统中迁移积累及其影响因子. 生态学报, 2003, 23(10): 2133–2143.
[4] Li J, Zhou YW, Chen S, et al. Actualities damage and management of soil cadmium pollution in China. Anhui Agri Sci Bull, 2015, 21(24): 104–107 (in Chinese). 李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述. 安徽农学通报, 2015, 21(24): 104–107.
[5] Yan Q, Zhou NN. The technology progress of phytoremediation on heavy metal contaminated soils. Nonferrous Met Sci Eng, 2012, 3(5): 60–65 (in Chinese). 严群, 周娜娜. 植物修复重金属污染土壤的技术进展. 有色金属科学与工程, 2012, 3(5): 60–65.
[6] Wang QH, Que XE. Phytoremediation—a green approach to environmental clean-up. Chin J Eco-Agric, 2013, 21(2): 261–266 (in Chinese). 王庆海, 却晓娥. 治理环境污染的绿色植物修复技术. 中国生态农业学报, 2013, 21(2): 261–266.
[7] Wei XW, Yao B, Liu HW, et al. Application of dendroremediation to the soil contaminated Soil by heavy metals and organic pollutants. Sci Sil Sin, 2011, 47(5): 124–130 (in Chinese). 韦秀文, 姚斌, 刘慧文, 等. 重金属及有机物污染土壤的树木修复研究进展. 林业科学, 2011, 47(5): 124–130.
[8] Jia ZM, Wang L, Wei H, et al. Comparative analysis of salix babylonica and salix matsudana for their cadmium accumulation, growth and photosynthesis in response to cadmium contamination. Sci Sil Sin, 2013, 49(11): 51–59 (in Chinese). 贾中民, 王力, 魏虹, 等. 垂柳和旱柳对镉的积累及生长光合响应比较分析. 林业科学, 2013, 49(11): 51–59.
[9] Li SC, He D. Analysis on the dynamic change of cadmium stress on SOD activity in salix matsudana. Guangxi For Sci, 2017, 46(4): 409–411 (in Chinese). 李双财, 何德. 镉胁迫后旱柳SOD活性的变化分析. 广西林业科学, 2017, 46(4): 409–411.
[10] Lu TT, Lu GJ, Fan DL, et al. Function annotation of the rice transcriptome at single-nucleotideresolution by RNA-seq. Genome Res, 2010, 20(9): 1238–1249.
[11] Wang CB, Lu WH, Lin Y, et al. Development and application of transcriptome sequencing. Eucalypt Sci Technol, 2018, 35(4): 20–26 (in Chinese). 王楚彪, 卢万鸿, 林彦, 等. 转录组测序的发展和应用. 桉树科技, 2018, 35(4): 20–26.
[12] Zhang DW. Response to and uptake of cadmium in different popar cultivars[D]. Shenyang: Shenyang Agricultural University, 2006 (in Chinese).张东为. 不同杨树品种对重金属镉的反应和吸 收[D]. 沈阳: 沈阳农业大学, 2006.
[13] Young MD, Wakefield MJ, Smyth GK, et al. Gene ontology analysis for RNA-seq: accounting for selection bias. Genome Biol, 2010, 11(2): R14.
[14] Kanehisa M, Araki M, Goto S, et al. KEGG for linking genomes to life and the environment. Nucleic Acids Res, 2008, 36(D1): D480–D484.
[15] Zhang Y, Chen J, Xie QX, et al. Reference gene selection of real-time quantitative PCR in, 2019, 17(9): 1–15 (in Chinese). 张玥, 陈娟, 谢泰祥, 等. 多花兰实时荧光定量PCR内参基因的筛选. 分子植物育种, 2019, 17(9): 1–15.
[16] Chan N, Hu QJ, Cao L, et al. Effects of aphid (Aphis gossypii Glover) infestation on MDA content and protective enzymes activities in cucumber. Jiangsu J Agr Sci, 2016, 32(2): 278–284. (in Chinese)郸娜, 胡其靖, 曹磊, 等. 蚜虫侵染对黄瓜叶片中丙二醛含量及保护酶活性的影响. 江苏农业学报, 2016, 32(2): 278–284.
[17] Chi CN, Ding GH. Research progress of the molecular biology in heavy metal tolerance of plants. Biotechnol Bull, 2017, 33(3): 6–11 (in Chinese). 迟春宁, 丁国华. 植物耐重金属的分子生物学研究进展. 生物技术通报, 2017, 33(3): 6–11.
[18] Wang SF. Study on the genotypic variations in responses to Pb, Cd and the tolerance mechanisms inspp.[D]. Hangzhou: Zhejiang University, 2015 (in Chinese). 王树凤. 柳树对重金属铅、镉响应的基因型差异及其耐性机制研究[D]. 杭州: 浙江大学, 2015.
[19] Li M, Guo C, Li YJ, et al. Transcriptome sequencing and biological analysis of willow (). Jiangsu J Agric Sci, 2019, 35(2): 271–281 (in Chinese).李敏, 郭聪, 李玉娟, 等. 旱柳转录组测序及生物学分析. 江苏农业学报, 2019, 35(2): 271–281.
[20] Wang ZW. Transcriptomic analysis of adventitious root formation exposed to NaCl stress in salix[D]. Taian: Shandong Agricultural University, 2018 (in Chinese). 王志维. NaCl胁迫条件下旱柳不定根发生的转录组学分析[D]. 泰安: 山东农业大学, 2018.
[21] Bai WB, Li X, Zhu CJ, et al. Progress in understanding the molecular mechanism of nutrition intervention of flavonoids on cadmium toxicity. Food Sci, 2017, 38(3): 245–253. (in Chinese). 白卫滨, 李夏, 朱翠娟, 等. 黄酮类化合物对镉毒性营养干预分子机制的研究进展. 食品科学, 2017, 38(3): 245–253.
[22] Zhou JL, He D. Potential control gene excavation in the process of male and female flower differentiation of. J Green Sci Technol, 2017, 5(10): 218–222 (in Chinese). 周景龙, 何德. 小桐子雌雄花性别分化过程中潜在控制基因挖掘. 绿色科技, 2017, 5(10): 218–222.
[23] Du XM, Yin WX, Zhao YX, et al. The production and scavenging of reactive oxygen species in plants. Chin J Biotech, 2001, 17(2): 121–125 (in Chinese). 杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制. 生物工程学报, 2001, 17(2): 121–125.
[24] Zhou BL, Yao T, Zhang J, et al. Effects of flavonoids of sophora flavescens to fusarium wilt and resistance physiology of cucumber. Acta Agric Boreali-Sin, 2009, 24(6): 78–82 (in Chinese). 周宝利, 姚婷, 张健, 等. 苦参黄酮对黄瓜枯萎病及抗性生理的影响. 华北农学报, 2009, 24(6): 78–82.
[25] Sun AQ, Zhang JD, Wan YS, et al. In silico expression profile of genes in response to drought in peanut. Acta Agronom Sin, 2013, 39(6): 1045–1053 (in Chinese). 孙爱清, 张杰道, 万勇善, 等. 花生干旱胁迫响应基因的数字表达谱分析. 作物学报, 2013, 39(6): 1045–1053.
[26] 靳开川, 何金环. 油菜素内酯在植物抗逆中的作用及信号传导机制综述. 江苏农业科学, 2017, 45(14): 4–7.
[27] Wang Z, Wang L, Song XM, et al. Research progress of plant brassinosteroids signaling pathway and plant immunity. J Anhui Agric Sci, 2019, 47(4): 26–29, 33 (in Chinese). 王喆, 王璐, 宋旭明, 等. 植物油菜素内酯信号通路与植物免疫相关研究进展. 安徽农业科学, 2019, 47(4): 26–29, 33.
[28] Xu AC, Chen YT, Chen QH, et al. Cd tolerance and leaf physiology changes in ten clones of Salix matsudana with Cd stress. J Zhejiang For College, 2009, 26(5): 674–681 (in Chinese). 徐爱春, 陈益泰, 陈庆红, 等. 镉胁迫下旱柳无性系耐镉性变异及生理变化. 浙江林学院学报, 2009, 26(5): 674–681.
Transcriptome analysis ofunder cadmium stress
Jimin Cao, Shuangcai Li, and De He
College of Life Sciences, Southwest Forestry University, Kunming 650224,Yunnan, China
With the expanded application of heavy metal cadmium, soil cadmium pollution is more and more serious. In this study, usingas a phytoremediation candidate, we observed changes of gene expression and metabolic pathway after 1, 7 and 30 days under 2.5 mg/L and 50 mg/L cadmium stress. The result of transcriptome sequencing showed that we obtained 102 595 Unigenes; 26 623 and 32 154 differentially expressed genes (DEG) in the same concentration and different stress time; 8 550, 3 444 and 11 428 DEG with different concentrations at the same time; 25 genes closely related to cadmium stress response were screened. The changes of genes expression (such as metallothionein, ABC transporter, zinc and manganese transporter) depended on both concentration of cadmium and exposure time. The expression of several genes was obviously up-regulated after cadmium stress, for example 3,6-deoxyinosinone ketolase (ROT3) in brassinolide synthesis pathway and flavonoid synthase (FLS), flavanone-3-hydroxylase (F3H) in the synthesis pathway of brassinolide. In addition, GO analysis shows that GO entries were mainly enriched in metabolic processes including cellular processes, membranes, membrane fractions, cells, cellular fractions, catalytic activation and binding proteins in response to cadmium stress, whose number would increase along with cadmium concentration and exposure time. The reliability of transcriptome information was verified by qPCR and physiological experimental data. Response mechanisms ofafter cadmium stress were analyzed by transcriptome sequencing, which provided theoretical guidance for remediation of cadmium pollution in soil by.
, cadmium, transcriptome, differentially expressed genes
10.13345/j.cjb.190486
October 30, 2019;
March 5, 2020
Supported by: National Natural Science Foundation of China (No. 31260041), First-level Discipline Construction Project of Yunnan Province’s Advantageous Key Disciplines (No. 50097505), Scientific and Technological Innovation for the Protection and Utilization of Undergrowth Biological Resources in Southern Universities (No. 51400605).
De He. E-mail: 1419615009@qq.com
国家自然科学基金 (No. 31260041),云南省优势特色重点学科生物学一级学科建设项目 (No. 50097505),云南省高校林下生物资源保护及利用科技创新 (No. 51400605) 资助。
曹继敏, 李双财, 何德. 镉胁迫后旱柳转录组变化分析. 生物工程学报, 2020, 36(7): 1365–1377.
Cao JM, Li SC, He D. Transcriptome analysis of Salix matsudana under cadmium stress. Chin J Biotech, 2020, 36(7): 1365–1377.
(本文责编 郝丽芳)

