规模化白羽肉种鸡场沙门氏菌的分离与鉴定
郭龙宗


摘 要:本研究对2013~2016年规模化养殖场鸡沙门氏菌感染情况进行了调查研究,并对采集的雏鸡、毛蛋、环境等样品进行了沙门氏菌的分离鉴定,结果显示:2013~2016年所有采集样品沙门菌的平均分离率为3.8%,分离菌株以肠炎沙门氏菌为主。
关键词:沙门氏菌;种鸡场;分离与鉴定
沙门氏菌(Salmonella)感染可引起禽类各种急性和慢性疾病,这些疾病在许多国家引起了重大的经济损失。随着现代家禽商业化养殖规模的扩大,沙门氏菌的传播更加复杂[1]。目前全球已知的沙门氏菌血清型有近2500种,其中禽类已报道有38种,分属于6个血清群[2]。许多血清型的沙门氏菌能通过食物链传染给人,从而引起人类的食物中毒,因此沙门氏菌病是具有重要意义的人畜共患病之一,对医学、兽医学及公共卫生学均具有十分重要的意义[3]。目前我国常见的致病性沙门氏菌血清型包括肠炎、鼠伤寒、鸡白痢和鸡伤寒等[4],不但严重影响我国养禽业的健康发展,而且与食品安全问题密切相关。本研究对2013~2016年规模化养殖场鸡沙门氏菌感染情况进行了调查研究,并对采集样品进行了沙门氏菌的分离鉴定,现将研究成果报道如下。
1 材料与方法
1.1 试剂 普通营养琼脂(NA),购自北京陆桥技术有限责任公司;SS琼脂、麦康凯琼脂、普通营养肉汤,购自北京中海生物科技有限公司;XLT4琼脂、TTB(四硫磺酸钠煌绿增菌液)、BS(亚硫酸铋)琼脂、SC增菌肉汤、XLD琼脂,购自青岛海博生物技术有限公司;沙门氏菌单因子血清购自福建宁波天润生物药业有限公司;微量生化反应管购自杭州天河;PCR引物,由上海英淮捷基贸易有限公司合成;Easy Pure Genomic DNA Kit核酸提取试剂盒,购自北京全式金生物技术有限公司;PCR反应试剂盒,购自北京全式金生物技术有限公司;琼脂糖、氯化钠、无水乙醇等均为国产分析纯。
1.2 样品的采集与处理
1.2.1 樣品的采集 采集自烟台、威海、潍坊地区的55个祖代、父母代和商品代生产场,共计91个批次种鸡群。每个场连续跟踪4年,自2013~2016年,种鸡场每批种鸡孵化的健康雏鸡、中途死亡毛蛋每月送检4~6次,每次送检25枚,从卵黄囊进行沙门氏菌分离试验,同时每月对鱼粉、笼养鸡舍灰尘、平养鸡舍垫料等环境样本进行沙门氏菌分离。
1.2.2 环境样本中沙门氏菌的分离 鱼粉、饲料、垫料、灰尘样本:无菌称取25g样品放入225mL的液体连四硫酸盐增菌液或SC增菌液中,混匀,于37℃温箱中培养24h。笼养场采集的粪便拭子、肛门拭子可以直接放入液体连四硫酸盐增菌液中,根据送检样品采取5个样品合样;平养场鞋套法采集样品,可用灭菌的棉签蘸取无菌的生理盐水使棉签的棉团稍湿润,涂抹鞋套采样的一面,然后放入液体连四硫酸盐增菌液中,根据送检样品采取5个样品合样,棉签增菌一般采用试管增菌,试管内加入10mL增菌培养液。胎粪样本:取1mL样品接种至10mL增菌液试管中。增菌培养液于37℃温箱中培养24h,接种麦康凯、SS、DHL、普通培养基进行鉴别培养,37℃培养24h后观察记录结果。
2 沙门氏菌的鉴定
2.1 沙门氏菌的分离纯化及生化鉴定 在SS平板上挑取无色半透明或中间带黑色的可疑菌落进行染色镜检,取上述可疑菌落分别划线接种于普通营养琼脂平板、DHL琼脂平板、SS琼脂平板以及麦康凯琼脂、XLT4琼脂平板上,以获取单个菌落,置37℃温箱培养24h再进行鉴别观察,挑取DHL(或SS或麦康凯或普通营养琼脂)平板上可疑单个菌落(同时在其他鉴别培养基上符合沙门氏菌特征),传入肉汤,置37℃温箱中培养24h后进行生化鉴定。
2.2 沙门氏菌单因子血清平板凝集 首先用A-F多价O血清做玻片凝集试验,同时用生理盐水做对照,以确定该分离菌为沙门氏菌,能够被A-F多价O血清凝集者,再依次用O1、O2、O4、O5、O9、O12因子血清做凝集试验后来判定O群。
H因子血清检查包括第1相和第2相。先用8种多价H血清检查,如有其中一种或两种血清凝集,则再用这一种或两种血清所包括的各种H因子血清逐一检查,以最终确定其血清型。
2.3 PCR鉴别
2.3.1 样品DNA的提取 参照Easy Pure Genomic DNA Kit的使用说明提取样品DNA,-20℃保存备用。
2.3.2 引物及PCR反应体系 根据黄金林等设计的引物(P1、P2)进行PCR扩增,P1引物序列为:5'-ACT GGC GTT ATC CCT TTC TCT GCT G-3',P2引物序列为:5'-ATG TTG TCC TGC CCC TGG TAA GAG A-3', 扩增目的片段为495bp,作为沙门氏菌的通用检测方法;参照陆广富等设计的引物(P3、P4),P3引物序列为:5'-TGT GTT TTA TCT GAT GCT GCA AGA G-3',P4引物序列为:5'-CGT TCT TCT GGT ACT TCA GAT GAC-3',扩增目的片段为293bp,将扩增结果与沙门氏菌生化试验结果及分离鉴定进行比较确定最终结果。引物由上海英淮捷基贸易有限公司合成。
PCR体系为25μL:2×Easy Taq PCR Super Mix 12.5μL,上下游引物各1μL,ddH2O为7μL,模板为3.5μL。P1、P2 PCR反应条件为:94℃预变性5min;94℃变性1min,53℃退火2min,72℃延伸1.5min,共计30个循环;最后72℃延伸10min。P3、P4 PCR反应条件为:94℃预变性5min;94℃变性1min,54℃退火1min,72℃延伸1.5min,共计30个循环;最后72℃延伸10min。
反应结束,取7μL PCR产物经1%琼脂糖凝胶电泳后,于凝胶成像仪中观察并记录结果。
3 结果
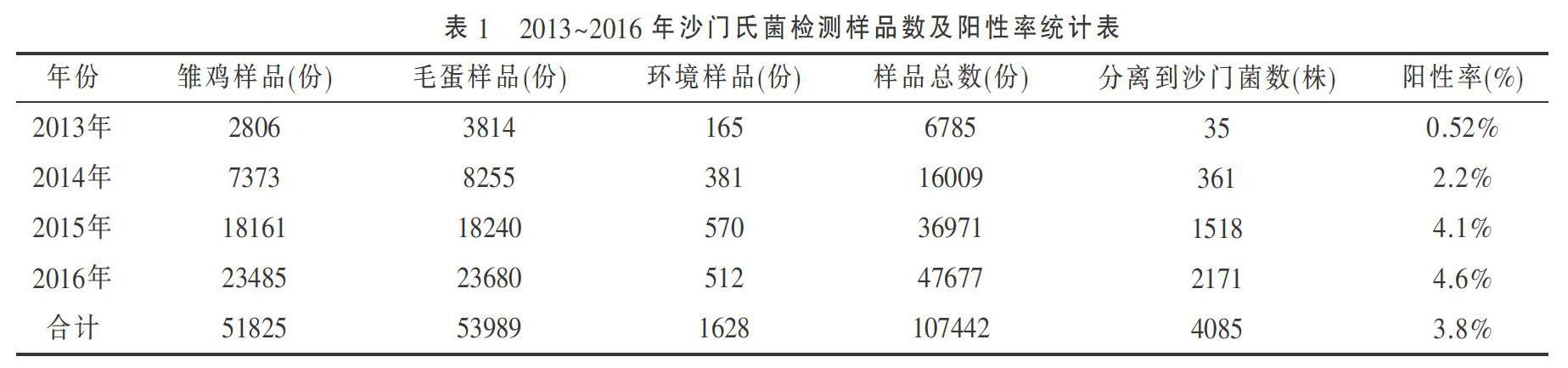
3.1 2013~2016年种鸡场沙门氏菌分离结果 2013~2016年共检测种鸡场沙门氏菌样品107442份,其中雏鸡样品51825份、毛蛋样品53989份、环境样品1628份,从所有样品中共分离到4085株沙门氏菌,沙门氏菌分离率为3.8%,见表1。沙门氏菌分离阳性样品主要来源于毛蛋,其次是垫料和鱼粉。
3.2 沙门氏菌的分离纯化结果 将雏鸡、毛蛋卵黄囊等样品分别接种到营养琼脂平板和SS平板;鸡舍垫料、灰尘、鱼粉等环境样本则首先通过液体连四硫酸盐肉汤进行预扩增,然后接种不同的鉴别培养基,经37℃ 24h培养后,挑取阳性菌落进行镜检,并分别划线接种于普通营养琼脂、DHL琼脂、SS琼脂以及麦康凯琼脂等鉴别培养基上进行分离纯化。沙门氏菌在普通培养基和麦康凯、SS培养基上形成直径为2~4mm、圆形且边缘平滑、稍隆起且有光泽菌落,在DHL培养基上则呈现中心黑色的菌落,部分菌株在SS培养基上也能长成黑色菌落,见图1。
3.3 生化反应试验结果 沙门氏菌革兰氏染色可见革兰氏阴性、平直不形成芽孢的杆菌,见图2。沙门氏菌经鉴别培养基培养后,获取单个阳性菌落,对于可疑菌落,继续进行血清凝集试验,并同时再挑取单个菌落置于肉汤中继续培养,进行生化鉴定。
大多数沙门氏菌分离株能发酵葡萄糖(产酸和产气)、卫矛醇、甘露醇、麦芽糖和黏酸盐,不发酵乳糖、蔗糖、丙二酸盐、水杨苷,不水解尿素或明胶,不产生吲哚,符合副伤寒沙门氏菌的生化特性。部分沙门氏菌不能发酵卫矛醇,而能发酵丙二酸盐,符合亚利桑那菌的生化特性,见图3、表2。
3.4 单因子血清凝集法鉴定沙门氏菌 参照沙门氏菌血清型與单因子血清凝集试验结果对照表。将经生化试验初步鉴定的菌株进行单因子血清凝集试验以确定分型,选取部分菌株的单因子血清凝集试验结果,如表2所示,大多数沙门氏菌分离株为肠炎沙门氏菌和亚利桑那沙门氏菌,与生化反应试验结果一致。
3.5 PCR鉴定结果 挑取8个沙门氏菌菌株提取细菌基因组DNA,进行PCR反应,结果显示:P1、P2引物均扩增出长度为495bp的条带,符合目的片段大小,见图4。
P3、P4引物均扩增出长度为293bp的条带,符合目的片段大小,见图5。8个分离株均为肠炎沙门氏菌。
3.6 2013~2016年分离及鉴定沙门氏菌情况 挑选2013~2016年部分典型菌落,经接种鉴别培养基培养以及生化反应试验、单因子血清凝集试验鉴定的菌株有66株,鉴定结果为:肠炎沙门菌59株,亚利桑那菌6株,疑似沙雷氏菌1株。
4 讨论
2013~2016年规模化白羽肉种鸡场共送检107442份沙门菌样品,共分离出4085株沙门氏菌,沙门氏菌的平均分离率为3.8%。沙门氏菌分离阳性样品主要来源于毛蛋,其次是垫料和鱼粉。毛蛋对于种鸡群是否感染沙门氏菌具有明显的病原学指示效应,鸡蛋的孵化温度为37.5℃,该温度同样适合细菌的繁殖,沙门氏菌在孵化鸡胚中生长、扩散,更容易被检出。欧盟27个成员国在2009年和2010年对肉鸡进行沙门氏菌监测的结果表明,沙门氏菌平均分离率为5.0%和4.1%[5]。越南对302份肉鸡粪便进行沙氏氏菌的检测,沙门氏菌的检出率是7.9%[6]。我们通过对种鸡群沙门氏菌的持续跟踪检测,沙门氏菌分离率为3.8%,均低于欧盟和越南的分离率,这也反映出种鸡群的生物安全措施明显要好于商品代鸡场。
本研究中2013~2016年规模化白羽肉种鸡养殖场的沙门氏菌分离菌株以肠炎沙门氏菌为主,这与张春萍等对北京地区不同养殖场沙门氏菌的血清型研究结果一致,美国2010年从肉鸡中分离的沙门菌主要以肠炎和肯塔基沙门氏菌为主,而欧盟2010年分离的血清型主要为肠炎和鸭沙门氏菌[7]。我们在规模化白羽肉种鸡场并未分离到鸡白痢和鸡伤寒沙门氏菌,上游国外引种鸡群已经实现对鸡白痢和鸡伤寒沙门氏菌的净化。根据我们的研究结果证明,引进国内后的白羽肉种鸡若采取良好的生物安全控制措施,可以有效预防这两个常见病原的感染。
参考文献:
[1] Y.M.Saif. 禽病学[M](第十二版).北京:中国农业出版社,2012:951-952.
[2] 张燕,朱超.我国沙门菌病和菌型分布概况[J].现代预防医学,2002,29(3):400-401.
[3] 陆承平.兽医微生物学[M].北京:中国农业出版社,2001:224-225.
[4] 郑世军,徐志超,李晓齐,等.一种检测鸡白痢沙门菌抗体的ELISA试剂盒[P] .CN103995126B,2015.
[5] Euro survellance editonal team.The European Union Summary Report on Trends and Sourees of Zoonoses,Zoonotic Agents and food-bome Outbreaks in 2010[J].EuroSurveill,2012,17(10):71-94.
[6] Tran T P,Nguyen T T,et al.Prevalence of Salmonella spp in pigs, chickens and ducks in the Mekong Delta,Vietnam[J].Vet Med Sci,2004,66(8):1011-1014.
[7] 张纯萍,宁宜宝,宋立.北京地区健康肉鸡携带沙门菌状况调查[J] .中国兽医杂志,2012,46(10):9-12.

