Omi/HtrA2基因过表达腺病毒载体的构建与鉴定
霍雨艳 饶冬梅
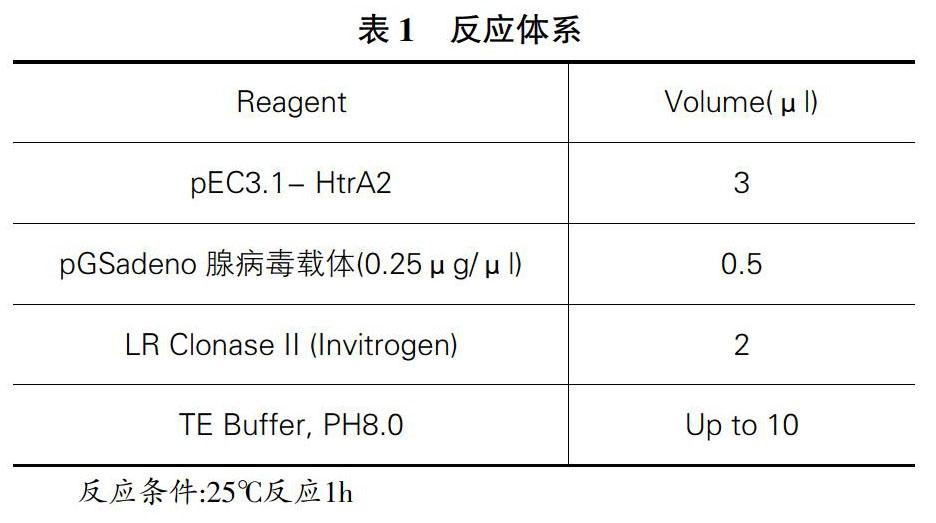


摘 要
目的:构建在哺乳动物细胞中表达的-Omi/HtrA2基因融合表达载体,为后续研究Omi/HtrA2基因过表达对结肠癌细胞HT29的影响奠定基础。方法:PCR扩增HtrA2基因编码框,用KpnI和BamHI将TS- HtrA2及目的载体pEC3.1(+)两步法双酶切,然后进行连接转化,构建基因重组载体radE5- HtrA2,包装重组腺病毒,RT-PCR 检测重组腺病毒基因mRNA的表达并提取蛋白进行Western blot 检测。结果:重组真核表达载体radE5- HtrA2经限制性内切酶分析,双酶切之后的条带与理论值相符,测序结果未见碱基变异,提取转染后细胞总蛋白进行Western blot 检测,可测到目标条带。结论:成功构建了基因重组载体radE5- HtrA2,并能在结肠癌细胞HT29中正常表达,为后续研究Omi/HtrA2基因功能奠定基础。
关键词
omi/HtrA2;结肠癌;重组质粒;转染
中图分类号: R735.35 文献标识码: A
DOI:10.19694/j.cnki.issn2095-2457.2020.16.084
0 前言
丝氨酸蛋白酶Omi又称Htr A2,在机体各组织器官中普遍表达,并在细胞质和线粒体中与多种底物蛋白发生反应[1]。目前研究发现Omi/HtrA2与多种疾病的发生发展密切相关,在肿瘤中高表达,其表达与肿瘤的发生、发展以及预后关系密切[2]。Omii通过其IAP结合位点与IAPs的BIR域结合,以便使已结合caspase的BIR域释放caspase,使其恢复活性而使细胞凋亡[3]。本研究通过构建Omi表达载体转染入结肠癌细胞HT29中,检测其表达情况,为后续研究该基因高表达对结肠癌细胞HT29的影响奠定基础。
1 材料与方法
1.1 HT29细胞培养
细胞培养在DMEM(GibcoBRL)+10%灭活胎牛血清(FBS)(Gibco)+双抗(青霉素100U/ml+链霉素100ug/ml)的培养基中,37℃,5%CO2的培养条件,用25cm2的组织培养瓶单层培养,并定期用1%胰酶-EDTA溶液分离细胞进行传代培养,传代比例1:2~1:3。
1.2 实验材料试剂与仪器设备
HT29细胞(佳木斯大学友情提供),DMEM(GibcoBRL),10%灭活胎牛血清(FBS)(Gibco),双抗(Sigma),胰酶(Sigma),PBS(Sigma),荧光显微镜(OLYMPUS ),37℃细胞培养箱(SANYO),低速离心机(TD5A- WS式),Adenovirus Expression System重组腺病毒构建系统(genesil),T4 DNA Ligase及部分内切酶(NEB公司),部分内切酶(Takara),HEK 293(美国ATCC),质粒提取试剂盒(维特洁),PCR仪(ABI)。
1.3 HtrA2基因表達载体构建
1.3.1 PCR扩增HtrA2基因
引物对:HtrA2-f:5'-GG GGTACC acccctgacctccgg-3'K pnI HtrA2-r:5'-GG GATCC GGCAGCTCATTTTC--3'EcoRI,Product:Length=2006bp;模板:pX-CMV- HtrA2载体;循环参数:预变性94℃ 5min,变性94℃ 20s,退火58℃ 25s,延伸72℃ 2min 30 cycles,72℃ 3min。将PCR产物进行1%琼脂糖凝胶电泳。
1.3.2 连接PCR产物至T(中间过渡)载体
反应体系:Pmd-19T simple vector 0.5μl,HtrA2 (PCR产物) 4.5μl,Ligation Mixture 5μl,16℃,过夜。连接产物转化至DH5α中,挑取克隆进行BamHI,KpnI双酶切鉴定。
1.3.3 亚克隆HtrA2至穿梭载体pEC3.1(+)
用KpnI和BamHI将TS- HtrA2及目的载体pEC3.1(+)两步法双酶切,然后进行连接,连接产物命名为pEC3.1-HtrA2(见图1),载体结构:---attL1—CMV—HtrA2—IRES---EGF P—stop---attL2-连接产物转化至DH5α中,挑取克隆进行鉴定。
1.3.4 通过LR体外同源重组将HtrA2表达框转移至pGSad eno(radE5)腺病毒(见图2)表达载体上
(1)LR体外同源重组:将它命名为radE5- HtrA2。
(2)蛋白酶K消化重组酶,加入1μL蛋白酶K,37℃反应15min。
(3)将5μL上步反应产物转化感受态细胞DH5а,涂布于含Ampr抗性(终浓度为100μg/ml)的LB平板上,37℃恒温箱培养过夜。从每个培养皿上各挑取3个单克隆菌落接种于50ml含Ampr抗性(终浓度为100ug/ml)的LB培养液中,37℃恒温摇床(250rpm)培养过夜。
(4)用中提试剂盒提取质粒,对提取的质粒进行酶切鉴定。
1.4 包装重组腺病毒
(1)准备进行转染的线性化腺病毒DNA
用PacI酶切重组腺病毒质粒;酚:氯仿:异戊醇抽提,乙醇沉淀。
(2)将PacI线性化的腺病毒DNA转染HT29
(3)培养的HT29,出现明显的CPE现象,且有>50%脱壁时即收细胞进行裂解收病毒,裂解上清感染HT29。
(4)放大培养重组腺病毒
当细胞有明显的CPE现象,且有>50%脱壁时即收细胞进行裂解,收病毒于1 ml 无菌PBS中。
(5)腺病毒radE5-HTRA2感染HT29细胞
感染前一天接种6孔细胞培养板,第二天细胞量达到70%-80%密度;感染前将细胞更换培养基为无血清无双抗的DMEM,将病毒放在冰盒上慢慢融化,按确定的最适体积加入细胞中,分别设MOI=0.1、MOI=1、MOI=10、MOI=100、MOI=500组轻轻混匀,5% CO2 37℃ Incubator中培养过夜。观察感染病毒后荧光表达,计数荧光百分率,细胞分别在转染后24h、72h、96h收集细胞样品进行RT-PCR和Western blot检测。
2 结果
2.1 PCR扩增HtrA2基因凝胶电泳结果
目的基因长度:2006bp,由下图可见,扩增的基因为目的基因。(见图1)
2.2 连接PCR产物至T载体进行酶切鉴定结果
由图2看出克隆1,克隆2,克隆3均为正确条带,小条带大小为1Kbp,选取克隆1(TS-HtrA2)测序。测序结果显示,扩增得到的HtrA2片段有一碱基突变,但不影响氨基酸序列,故可以此克隆进行后续实验。
2.3 亚克隆HtrA2至穿梭载体pEC3.1(+)后酶切鉴定
BamH,KpnI双酶切鉴定结果如下(见图3)(应该切出一约2Kbp的条带),图片可见克隆①②均为正确克隆,命名为pEC3.1-HtrA2。
2.4 PI-SceI/I-CeuI双酶切radE5-HtrA2电泳
通过LR体外同源重组将HtrA2表达框转移至pGSadeno腺病毒表达载体(radE5)上,PI-SceI/I-CeuI双酶切radE5-Htr A2电泳图谱(见图4),酶切分析:正确的克隆将切出一条3kb的小条带,且大带大于15kb(说明载体为腺病毒载体),由图4可知目的克隆是正确的,质粒构建成功。
2.5 RT-PCR测定HtrA2重组腺病毒基因蛋白表达
逆转录-聚合酶链反应(RT-PCR)测定HtrA2重组腺病毒基因蛋白表达良好(见图5)。
2.6 Western检测HtrA2重组腺病毒基因蛋白表达
Western-blot 检测rAdE5-HTRA2感染HT29细胞后蛋白表达良好(见图6)。
3 讨论
结肠癌是一种常见的恶性消化道疾病,近几年在国内发病率逐年升高。结肠癌患者生存率偏低,治疗效果及预后均较差,严重影响健康[4]。目前临床上治疗结肠癌主要以手术为主,早期可通过手术切除进行根治,但大部分结肠癌患者发现时已是晚期,常规手术无法根治,因此寻找新的治疗手段具有重要意义[5-6]。结肠癌的发生发展与多种因素有关,包括癌基因和抑癌基因的表达[7-9]。
丝氨酸蛋白酶Omi,隶属于Htr A(High Temperature Req uirement A)家族,又称Htr A2,在机体各组织器官中普遍表达,并在细胞质和线粒体中与多种底物蛋白发生反应。Omi/Htr A2作为促凋亡蛋白,可降解细胞内重要的凋亡抑制蛋白,进而导致细胞凋亡,Omi可通过与线粒体的抗凋亡蛋白HAX-1相互作用,使HAX-1降解,从而增加细胞对凋亡刺激的敏感性[10-12],诱导细胞凋亡。本实验通过体外构建Omi基因表达重组载体radE5- HtrA2,转染入结肠癌细胞HT29中并能正常表达,为后续研究Omi/HtrA2基因过表达与肿瘤细胞凋亡的关系奠定基础,为进一步动物实验以及结肠癌的临床治疗提供基础研究依据。
参考文献
[1]Ding Y1,Wang B1,Chen X1,Zhou Y1,Ge J1 Staurosporine suppresses survival of HepG2 cancer cells through Omi/HtrA2-mediated inhibition of PI3K/Akt signaling pathway.Tumour Biol.2017 Mar;39(3):1010428317694317.
[2]Wang K1,Yuan Y2,Liu X1,Lau WB2,Zuo L3,Wang X3,Ma L1,Jiao K1,Shang J1,Wang W1,Ma X1,2,4,Liu H1,4.Cardiac Specific Overexpression of Mitochondrial Omi/HtrA2 Induces Myocardial Apoptosis and Cardiac Dysfunction. Sci Rep.?2016 Dec 7;6:37927.
[3]Xu Z1,Chen Y1,Xu G1,Peng C2,Liu E2,Li Y2,Niu J2,Li C3.Omi/HtrA2 pro-apoptotic marker differs in various hepatocellular carcinoma cell lines owing to ped/pea-15 expression level. Oncol Rep.?2015 Feb;33(2):905-12.
[4]张玥,石菊芳,黄慧瑶,等.中国人群结直肠癌疾病负担分析[J].中华流行病学杂志,2015,36(7);709-714.
[5]程雪,纪捷,张静敏,等,Lgr5蛋白和Her-2蛋白在结肠癌中的表达及其临床意义[J].现代医学,2017,45(1):17-22.
[6]王勇,傅赞,封益飞,等.腹腔镜完整结肠系膜切除(CME)治疗局部晚期右半结肠癌的临床疗效[J].中国地方病杂志,2016(11):1302-1303.
[7]王千里.结肠癌组织NPRL2表达及其临床意义研究[D].郑州:郑州大学,2014.
[8]耿乐乐,陈彦平.Omi/HtrA2 及其在恶性肿瘤中的研究进展[J].河北医药,2015,37(16): 2507-2509.
[9]饶冬梅.Omi/HtrA2表达与肿瘤关系的研究进展[J].广东医学,2016,37(8):1239-1242.
[10]郑亚萍,刘春杰.Raf1基因重組腺病毒SIRNA载体构建及其对大鼠心肌细胞肥大的影响[J].中国比较学杂志,2016,26(4):18-23.
[11]曾萍,杨简,杨俊等.大鼠CD47 RNAi 腺病毒载体的构建与鉴定[J].临床心血管病杂志,2019,33(9):892-895.
[12]LUO T,LIU G,LONG M,et al.Treatment of cadmumrinduced renal oxidative damage in rats by admin-stration of alpha lipoic acid J.Environ Sci Pollut ResInt,2017,24(2):183218.

