功能性腹泻脾虚证模型大鼠肠组织钠离子通道蛋白的变化
李家立 王亮 白艳香

[摘要] 目的 观察功能性腹泻脾虚证模型大鼠肠组织NHE3、Na+-K+-ATPase、ENaC等离子通道蛋白的表达变化。 方法 采用随机数字表法将24只3周龄雄性Wistar大鼠分为正常组和模型组,利用小平台站立法联合高乳糖饲料喂养建立功能性腹泻脾虚证模型,造模14 d后取材,采用Western blot检测肠组织中的各指标蛋白表达变化。 结果 造模后1 d,两组大鼠体重均显著重于造模前1 d(P < 0.01),但模型組显著轻于正常组(P < 0.01)。模型组大鼠腹泻率为100%。造模后,模型组大鼠结肠NHE3、Na+-K+-ATPase相对表达量均低于正常组(P < 0.05或P < 0.01),NHERF2、PKAR2相对表达量均高于正常组(P < 0.05或P < 0.01)。 结论 Na+-K+-ATPase、NHE3等Na+通道蛋白的表达下调可能是功能性腹泻脾虚证发生的分子生物学基础,值得进一步研究证实。
[关键词] 腹泻;脾虚;Na+通道;NHE3;Na+-K+-ATPase
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2020)06(a)-0008-04
[Abstract] Objective To observe the changes of NHE3, Na+-K+-ATPase and ENaC in intestine of functional diarrhea model rats with spleen deficiency. Methods Twenty-four male Wistar rats (3 weeks old) were divided into normal group and model group according to the random number table method. The model rats of functional diarrhea with spleen deficiency syndrome were made using the modified multiple platform method and high lactose feed. After the model was made, the materials were taken and the expression of various indexes in intestinal tissue was detected by Western blot. Results The first day after molding, the weight of rats in both groups was significantly heavier than that in the first day before modeling (P < 0.01), but the weight of rats in model group was significantly lighter than that in normal group (P < 0.01). The diarrhea rate of rats in model group was 100%. After molding, the relative expression of NHE3 and Na+-K+-ATPase in colon of model group was lower than that of normal group (P < 0.05 or P < 0.01), the relative expression of NHERF2 and PKAR2 in colon of model group was higher than that of normal group (P < 0.05 or P < 0.01). Conclusion The down-regulation of Na+-K+-ATPase, NHE3 and other sodium channel proteins may be the molecular biological basis of spleen deficiency syndrome of functional diarrhea, which is worth further study and confirmation.
[Key words] Diarrhea; Spleen deficiency; Sodium channel; NHE3; Na+-K+-ATPase
功能性腹泻是极其常见的消化系统疾病,近年来随着人们饮食结构的改变、社会节奏的加快,功能性腹泻脾虚证的发病率不断升高。腹泻是胃肠道对水和电解质分泌吸收的正常生理平衡被打破的结果,而Na+是维持组织液、血浆渗透压、肠黏膜内外水电解质平衡的关键因素。肠道对电解质的吸收,主要是建立在对Na+的吸收基础上,而对水溶性有机物质的吸收也基本上都是与Na+相偶联。因此,Na+的吸收状态直接影响肠道对于其他电解质、有机溶质的吸收情况;Na+吸收障碍会造成肠道渗透压升高,进而导致腹泻的发生。本实验利用小平台联合高乳糖饲料喂养建立功能性腹泻脾虚证模型[1],观察脾虚腹泻模型大鼠肠组织中不同Na+通道蛋白表达变化。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 雄性Wistar大鼠(3周龄),24只,体重54.9~64.0 g,斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2016-0002。饲养于济宁医学院实验动物中心,饲养环境:光照周期12 h/12 h,室温22~25℃,相对湿度45%~60%,自由进食、饮水。伦理批号:2018-FY-012(济宁医学院医学伦理委员会)。
1.1.2 实验试剂 兔抗大鼠NHE3多克隆抗体(Abcam公司,ab95299);兔抗大鼠NHERF1多克隆抗体(Abcam公司,ab3452);兔抗大鼠NHERF2多克隆抗体(Invitrogen公司,PA5-50067);兔抗大鼠PKAR2多克隆抗體(Abcam公司,ab38949);兔抗大鼠Na+-K+-ATPase多克隆抗体(CST公司,3010S);兔抗大鼠ENaC-γ多克隆抗体(Abcam公司,ab3468);兔抗大鼠GAPDH多克隆抗体(Bioswamp公司,PAB36269);山羊抗兔IgG(Bioswamp公司,SAB43714);BCA蛋白浓度测定试剂盒(增强型)(Bioswamp,W1712);蛋白质Marker(Thermo,26634)。
1.1.3 实验仪器 电泳仪(BIO-RAD,mini protean 3 cell);酶标仪(芬兰雷勃,MK3);干式恒温器(杭州爽盛仪器,K30);离心机(杭州奥盛,Icen-24R);水浴锅(Leica,HI1210);全自动化学发光分析仪(上海天能,Tanon-5200)。
1.2 方法
1.2.1 造模方法 用高乳糖饲料喂养幼龄Wistar大鼠14 d;每日22:00至次日7:00将大鼠放置在特制方形箱体水槽中的小平台上,箱体水槽大小为112 cm×62 cm×41 cm,箱内共设置15个圆形小平台,每个小平台台面直径8 cm,柱高10 cm;平台周边注水,水深1.5 cm,水温维持在(22±2)℃;大鼠在平台上可以自由活动,而一旦大鼠进入睡眠状态则会因为肌肉舒张、松弛而落入水中,不得休息,以此建立脾虚腹泻模型[1-3]。见图1。
1.2.2 实验分组 采用随机数字表法将大鼠分为正常组、模型组,每组12只,共24只。正常组:同期正常饲养。模型组:高乳糖饲料喂养,每日22:00至次日7:00置入水环境小平台站立,持续14 d。
1.2.3 实验取材 造模14 d后,按每10毫升每千克体重大鼠给予4%水合氯醛腹腔麻醉,腹主动脉取血,低温静置2 h后,4℃ 3000 r/min离心15 min,离心半径为10 cm,取上清。取血后即刻断头处死,冰上取肠组织,结肠至肛门向上2 cm开始,取结肠4 cm,用生理盐水将肠内容物清洗干净后,再分别放入福尔马林固定液或液氮中,后转入-80℃冰箱保存。
1.2.4 蛋白表达检测 采用Western blot检测各个观察指标的表达变化,将组织剪成细小的碎片后,进行蛋白抽提,BCA法蛋白定量,将制备好的蛋白样本经SDS-PAGE电泳分离后转膜,5%脱脂奶粉室温封闭2 h(或4℃过夜),按各指标说明书(稀释比例:NHE3、PKAR2、Na+-K+-ATPase、ENaC-γ、GAPDH为1∶1000;NHERF1、NHERF2为1∶2000)稀释抗体后,加入一抗室温孵育1 h(或4℃过夜),PBST洗脱后二抗室温孵育1 h(或4℃过夜),PBST洗涤后ECL化学发光法显色。最后将膜置于全自动化学发光分析仪中检测,通过TANON GIS软件读取相关条带灰度值。
1.3 统计学方法
采用SPSS 25.0统计软件进行分析。计量资料用均数±标准差(x±s)表示,采用独立样本t检验。以P < 0.05为差异有统计学意义。
2 结果
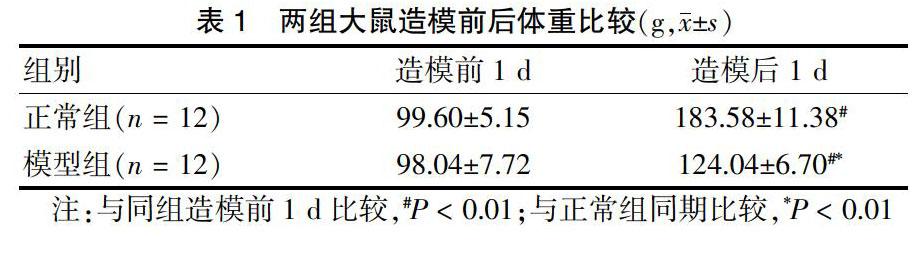
2.1 两组大鼠造模前后体重比较
造模前1 d,两组大鼠体重比较,差异无统计学意义(P > 0.05);造模后1 d,两组大鼠体重均显著重于造模前1 d(P < 0.01),但模型组显著轻于正常组(P < 0.01)。见表1。
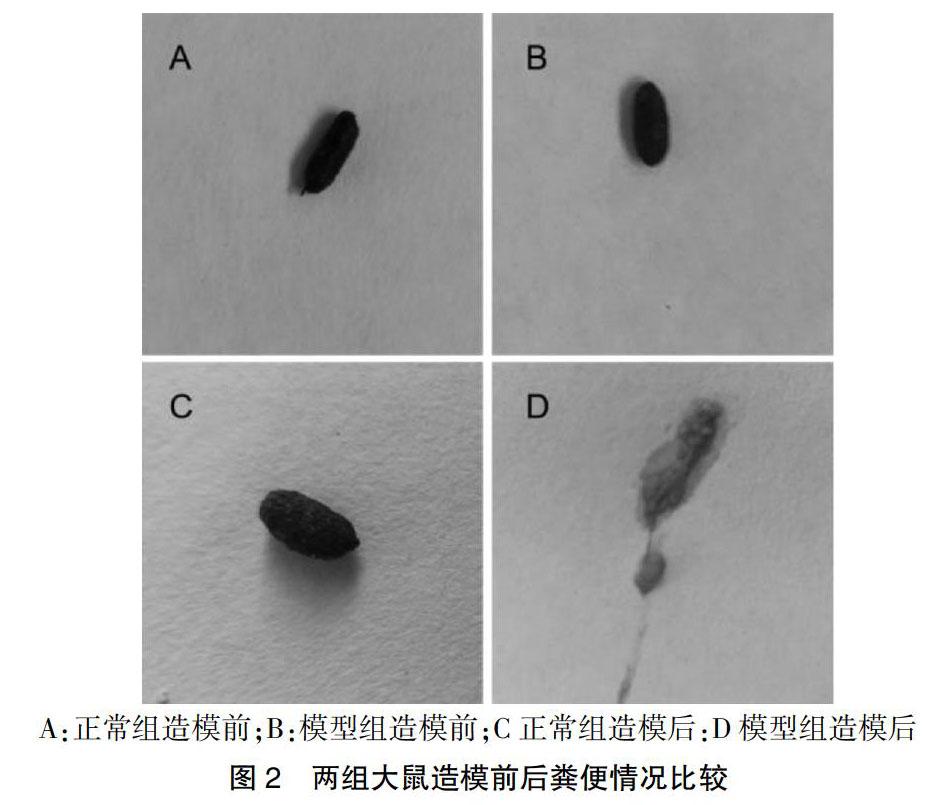
2.2 两组大鼠造模前后粪便情况比较
造模前,两组大鼠的粪便均为颗粒样大便;造模后,同期饲养的正常组大鼠的粪便为颗粒样大便,模型组大鼠的粪便为黄色稀便;造模操作使模型组大鼠出现明显腹泻情况,且腹泻率为100%。见图2。
2.3 两组大鼠结肠组织各观察指标蛋白相对表达量比较
造模后,模型组大鼠结肠NHE3、Na+-K+-ATPase相对表达量均低于正常组(P < 0.05或P < 0.01),NHERF2、PKAR2相对表达量均高于正常组(P < 0.05或P < 0.01)。见图3。
3 讨论
利用小平台站立法联合高乳糖饲料喂养制作的功能性腹泻脾虚证模型大鼠,其体重增长趋势缓慢,毛色枯槁,精神倦怠,便溏泄泻,肠吸收功能减退[4-6]。其中腹泻是该模型的典型症状,本研究采用此模型大鼠探讨脾虚泄泻肠组织中Na+通道蛋白的变化。
Na+是维持组织液、血浆渗透压的重要组成部分,Na+的吸收状态直接影响肠道对于其他电解质、有机溶质的吸收情况;Na+吸收障碍会造成肠道渗透压升高,导致腹泻的发生。肠细胞对Na+的吸收主要有三种方式[7]:①以ENaC为结构基础的Na+生电性非偶联吸收;②以NHE为结构基础的电中性的NaCl吸收[8];③Na+与有机溶质的偶联吸收,主要是以SGLT为结构基础的Na+与葡萄糖的偶联吸收[9]。本研究主要观察前两种方式。Na+的非偶联吸收,是通过细胞腔面膜的ENaC,顺化学梯度进入细胞内,再由基底膜钠钾泵(Na+-K+-ATPase)泵出细胞外。Na+-K+-ATPase对Na+的主动运输,使细胞内Na+浓度维持在较低水平,为Na+及其他电解质等进出细胞提供电化学梯度,对于维持水钠平衡、血容量及血压起重要作用。本研究中模型组大鼠结肠组织中的Na+-K+-ATPase较正常组大鼠表达下降,会导致结肠黏膜组织的能量代谢异常、Na+泵出细胞外障碍,使大量Na+滞留在细胞内,引起细胞肿胀,细胞正常的生理功能受到抑制,肠道对水的吸收能力也显著下降,可能是脾虚泄泻的微观表现之一。另外Na+-K+-ATPase表达减少,细胞内外的电化学梯度变化可能会影响胃肠平滑肌细胞的动作电位以及细胞内Ca2+的浓度,也可能会导致胃肠道动力紊乱[10]。Na+-K+-ATPase已被诸多进行中医脾虚证研究的学者关注,研究发现,在脾虚状态下大鼠细胞能量代谢障碍[11],Na+-K+-ATPase活性降低[12],回肠结肠组织Na+-K+-ATPase活性下降[13],认为Na+-K+-ATPase活性下降可能是脾虚证的病理机制之一。很多中药[14-15]、方剂[16-17]也是通过作用于Na+-K+-ATPase发挥对脾胃的调节作用。
电中性的NaCl吸收,是Na+和Cl-的偶联吸收过程,包括了Na+-H+交换与Cl--HCO-3交换两种逆向转运。Na+-H+交换依赖于肠道中的多种Na+/H+交换体,其中NHE3更多地参与肠上皮细胞对Na+的吸收[8]。有研究[18]发现,NHERF在小肠对Na+的吸收方面发挥重要作用,NHERF对NHE的调节直接或间接地导致了腹泻的发生[19]。本研究结果显示,小平台站立联合高乳糖喂养造模后,出现脾虚泄泻的大鼠肠组织中NHERF2表达升高,PKAR2表达升高,NHE3表达下降。笔者推测,NHERF2通过PKAR2对NHE3产生抑制效应,NHE3表达下调,造成Na+吸收减少而产生腹泻,可能是脾虚泄泻发生的分子机制。
综上所述,Na+吸收的正常与否在腹泻的发生、发展过程中发挥十分重要的作用,Na+-K+-ATPase、NHE3等Na+通道蛋白的表达下调可能是功能性腹泻脾虚证发生的分子生物学基础,值得进一步研究证实。
[参考文献]
[1] 白世敬,李峰,唐旭东,等.功能性腹泻脾虚证动物模型制作方法[J].辽宁中医药大学学报,2015,17(1):86-88.
[2] 白世敬,李峰,马捷,等.功能性腹泻脾虚证动物模型的制作与评价思路初探[J].河北中医,2014,36(4):592-593,597.
[3] 杨茜,李峰,马捷,等.水环境小平台建立脾虚证大鼠模型及其评价[J].山东中医杂志,2016,35(5):452-457.
[4] 白世敬.功能性腹泻脾虚证动物模型制作及评价方法研究[D].北京:北京中医药大学,2014.
[5] 康楠,王凤云,陈婷,等.脾虚四号方干预大鼠腹泻模型后结肠黏膜微观结构的变化[J].中国中西医结合消化杂志,2015,23(1):1-4.
[6] 康楠,王凤云,陈婷,等.脾虚四号方干预对功能性腹泻脾虚证模型大鼠肠上皮细胞微绒毛形态的影响[J].中国实验方剂学杂志,2015,21(17):79-83.
[7] Goff JP. Invited review:mineral absorption mechanisms,mineral interactions that affect acid-base and antioxidant status,and diet considerations to improve mineral status [J]. J Dairy Sci,2018,101(4):2763-2813.
[8] Pedersen SF,Counillon L. The SLC9A-C mammalian Na+/H+ exchanger family:molecules,mechanisms,and physiology [J]. Physiol Rev,2019,99(4):2015-2113.
[9] Lehmann A,Hornby PJ. Intestinal SGLT1 in metabolic health and disease [J]. Am J Physiol Gastrointest Liver Physiol,2016,310(11):G887-G898.
[10] 刘正玉,郭力,何小川,等.大鼠烫伤早期肠道组织内ATP酶对肠道动力及其功能的影响[J].中国临床康复,2005,9(6):88-89.
[11] 杨旭,王琦越,刘渊,等.从“脾主化”角度探讨湿阻中焦证大鼠线粒体能量代谢路径的影响及平胃散的干预作用[J].时珍国医国药,2019,30(6):1305-1308.
[12] 胡齐,孙莹,宋雅芳,等.四君子汤对脾虚大鼠线粒体氧化损伤及能量代谢的影响[J].中华中医药学刊,2017, 35(8):1972-1976.
[13] 翟美丽,于漫,王彩霞.基于能量代谢相关酶活性改变探析脾阳虚证病理机制[J].辽宁中医药大学学报,2016, 18(9):90-92.
[14] 夏亚楠,余凌英,王德键,等.补骨脂不同炮制品对肾阳虚、脾虚大鼠的影响研究[J].亚太传统医药,2016,12(9):5-7.
[15] 姜宇珺,张北雪,马善鹏,等.四种不同来源的苍术和白术对偏于实证的脾虚大鼠药效学比较研究[J/OL].中华中医药学刊:1-8. http://kns.cnki.net/kcms/detail/21.1546. R.20191113.0953.012.html.
[16] 赵琼,黄勤挽,代渊,等.加味人参乌梅汤对腹泻大鼠AQP4及其相关调控因子的影响[J].中国实验方剂学杂志,2015,21(7):99-102.
[17] 廉永红.加味四君子汤对脾虚型IBS-D的治疗作用及机理的研究[D].广州:广州中医药大学,2012.
[18] Ghishan FK,Kiela PR. Small intestinal ion transport [J]. Curr Opin Gastroenterol,2012,28(2):130-134.
[19] Chen T,Lin R,Avula L,et al. NHERF3 is necessary for Escherichia coli heat-stable enterotoxin-induced inhibition of NHE3:differences in signaling in mouse small intestine and Caco-2 cells [J]. Am J Physiol Cell Physiol,2019,317(4):C737-C748.
(收稿日期:2019-12-12 本文編辑:李亚聪)

