脊髓损伤增强α-肾上腺素受体的股动脉表达和反应性变化
秦础强 朱 翔 曾展鹏 赵洪普 吕玉明 曾 敬
1.广州医科大学附属第三医院,广东 广州 510000;2.广州市番禺区中医院,广州 番禹 511400
自主反射障碍(AD)是一种危险的临床现象,通常表现为无法控制的高血压和其他危及生命的后果,如癫痫、肺水肿、急性肾损伤、心肌梗死和颅内出血[1]。临床上,AD定义为收缩压比基线升高至少20%,心率变化,并与其他器官功能不全症状或体征相关[2]。在脊髓高强度损伤的急性期,患者通常发生神经源性休克,需要肌力支持。从脊髓损伤后的几周到6个月,48%~98%的高截瘫或四肢瘫痪患者出现自主反射障碍[3]。AD发展过程中心血管反应异常的病理生理机制尚不完全清楚[4]。有一种观点认为,脊髓损伤程度高的受试者失去了脊髓上抑制控制血管舒缩通路下降,导致中枢和外周自主神经回路的神经可塑性改变[5]。因此,在病变较低水平的刺激可产生无法控制的交感神经流出,引起严重的血管收缩反应和血压显著升高。先前的研究已经证明了大规模的降低交感神经活性与极低的血管阻力在急性神经源性休克阶段,但最终发展成高反应性α-肾上腺素刺激与SCI后急性期病人或动物[6]。然而,α-肾上腺素受体的调节和响应性周围动脉水平以下的脊髓损伤阶段的自主反射性异常以前还没有被描述过。
1 材料与方法
1.1一般资料 选取体重在200~250 g的SD大鼠为研究对象。本研究共使用48只大鼠(n=24),随机分为对照组和脊髓损伤组(n=24),实验过程中大鼠无死亡。
1.2实验方法
1.2.1动物模型的建立 将体重在200~250 g的SD大鼠麻醉,吸入异氟醚(2%~3%体积/体积氧气),俯卧位。在下胸椎上做了一个切口,采用高速钻孔机进行T10全椎板切除术。通过夹紧T8~T12的棘突稳定脊柱,使用力校准的重量下降装置诱导脊髓挫伤。脊髓损伤是通过将一根10 g重的杆子从50 mm处扔到暴露在外的脊髓上造成的。然后缝合切口,让大鼠从麻醉中恢复。无死亡,没有出现完全下肢瘫痪的大鼠。所有程序均经机构动物护理和使用委员会批准,并通过美国国家卫生研究院出版的《实验室动物护理和使用指南》予以确认。
1.2.2血流动力学测量 将一根24 G的导管插入颈动脉测量血压,并连接一个血压传感器记录动脉血压。在颈静脉注射苯肾上腺素(10 g/kg),以诱导全身α刺激并增加血压。股动脉内的血流通过超声血流系统在POD 1、7和14处测定。记录至少1.5min的血流轨迹,并使用数据采集系统分析平均血流。大鼠全麻时用异氟醚(氧气中为1.5% v/v)测量所有血流动力学参数,每次分析后移除所有血流动力学测量仪器。
1.2.3血管反应性测量 分离股动脉环(3 mm长),用钢丝轻轻摩擦内膜,取出内皮细胞。血管环被安装在含有25 ml克雷布斯溶液的器官腔内。舱室保持在37 ℃,持续充气94% O2/6% CO2。用等轴力-位移传感器记录等轴力的变化。每个环被逐渐拉伸到1.5 g,平衡45 min后,加入KCl (40 mM)和浓度增加的苯肾上腺素(PE, 10-9至10-5M)使环收缩。
1.2.4蛋白质印迹分析 将采集的股动脉粉碎并在溶解缓冲液中均匀化。在聚丙烯酰胺凝胶(9%~12%)中加入等量的总蛋白(50~100 g)。抗体使用兔多克隆抗α-肾上腺素受体(AB3462,1∶400)。用增强化学发光法观察谱带。
1.2.5组织学测定 动脉组织浸泡在10%甲醛溶液中24 h。石蜡包埋组织切片,苏木精、伊红染色(H&E)。将新鲜冷冻的动脉置入最佳切割温度(OCT)下,进行免疫组化染色。将切片组织与兔多克隆抗α-肾上腺素能受体抗体(1∶200;abcam)孵育,用亲和素-生物素法观察α-肾上腺素能受体的表达。

2 结 果
2.1血流动力学检测 股动脉血流量在POD 1几乎检测不到,在POD 7和14逐渐增加,结果如图1所示。然而,在脊髓损伤后14 d,股动脉血流量仍然显著降低(P<0.05)。
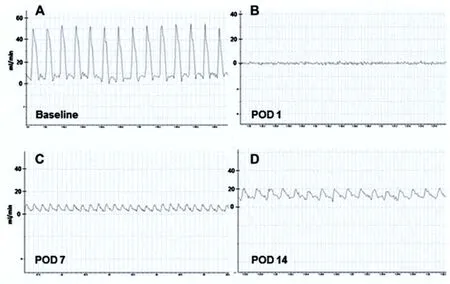
图1 基线(A)和POD 1-14 (B-D)测量的股动脉代表性原始血流示踪图
2.2血管反应性测量 通过添加KCl(40 mM)和苯肾上腺素(PE,10-9-10-5M)来测试股动脉环的等长收缩反应。脊髓损伤大鼠股动脉KCl去极化诱导的次优收缩略有增加,但差异无统计学意义(P>0.05)。随着苯肾上腺素的累积增加,脊髓损伤大鼠股动脉的收缩力以浓度依赖的方式增加(P<0.05)。在脊髓损伤大鼠中,苯肾上腺素诱导的离体股动脉最大收缩增强(P<0.05)。(表1、表2)
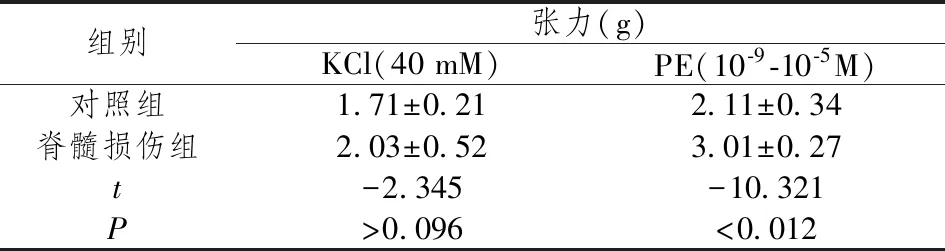
表1 离体股动脉对KCl (40mM)和苯肾上腺素的收缩反应
随着苯肾上腺素的累积增加,脊髓损伤大鼠股动脉的收缩力以浓度依赖的方式显著增加(P<0.05),结果如表2所示,苯肾上腺素刺激后收缩曲线也左移结果如表3所示。此外,在脊髓损伤大鼠中,苯肾上腺素诱导的离体股动脉最大收缩显著增强(空白组2.1±0.5,脊髓损伤组3.0±0.6,P<0.05)。
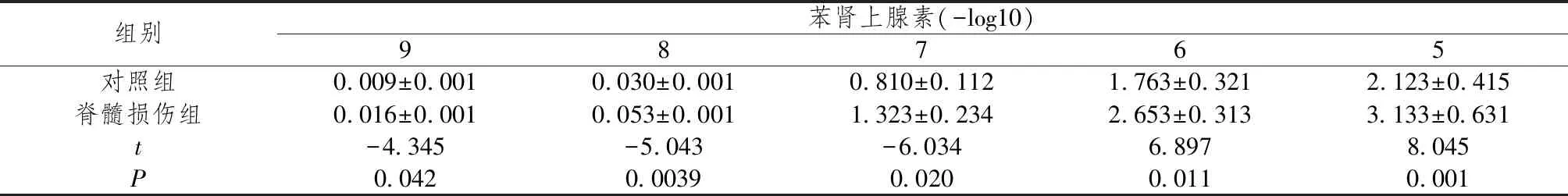
表2 浓度依赖收缩曲线(绝对张力)

表3 苯肾上腺素引起的收缩到最大张力的百分比
为了模拟体内α-肾上腺素的刺激作用,我们通过静脉注射苯肾上腺素(10 g/kg),测量全身血压。与对照组相比,脊髓损伤大鼠的基线平均动脉血压降低,对照组和脊髓损伤(SCI)大鼠输注α-肾上腺素能激动剂苯肾上腺素后,静息时平均动脉压(基线水平)降低,全身血压显著升高。结果如表4所示。静息时平均动脉压,对照组与脊髓损伤组平均血压分别为(90.32±10.32)mmHg、(60.45±8.43)mmHg两组间存在显著性差异(P<0.05)。输注α-肾上腺素能激动剂苯肾上腺素后,对照组与脊髓损伤组平均血压分别为(120.45±10.34)mmHg,(140.24±12.34)mmHg,两组间存在显著性差异(P<0.05),且输注α-肾上腺素能激动剂苯肾上腺素后与静息时平均血压相比,均显著增加(P<0.05)。

表4 大鼠静脉注射苯肾上腺素(10 μg/kg)后全身血压的测定结果
与对照组相比,在这些大鼠中,苯肾上腺素能更显著地诱导血压升高,结果如表5所示。对照组血压平均值在(59.54±3.54)mmHg,脊髓损伤组血压平均值在(93.45±8.43)mmHg,两组间存在显著性差异(P<0.05)。

表5 静脉输注苯肾上腺素后脊髓损伤大鼠的血压测定结果
2.3Western blot 测定结果 在股动脉中定量表达α-肾上腺素能受体,进一步表征脊髓挫伤后血管运动的变化。通过western blot实验对α-肾上腺素能受体蛋白表达量进行测定,与对照组相比,脊髓损伤大鼠α-肾上腺素能受体蛋白水平明显上调(P<0.05),结果如图2。通过Image软件对各组蛋白条带的灰度值进行计算,结果如表6所示,由结果可以看出,对照组与脊髓损伤组灰度值分别为1.11±0.23,2.51±0.67,两组间存在显著性差异(P<0.05),由此进一步说明脊髓损伤后,大鼠α-肾上腺素能受体蛋白显著增加。

表6 α-肾上腺素受体蛋白表达的Western blot分析灰度值测定结果

图2 股动脉组织匀浆中α-肾上腺素受体蛋白表达的Western blot分析。
2.4组织学分析 组织学测定结果表明,股动脉内侧层α-肾上腺素能受体表达增强,脊髓损伤大鼠股动脉HE染色显示相似的形态。
3 讨 论
脊髓损伤是一种高致残率的创伤性疾病。细胞凋亡和坏死性细胞凋亡是神经细胞在其继发性病理变化过程中丢失的主要原因[7]。自主反射障碍是高水平脊髓损伤患者常见的不良血流动力学反应。然而,这一现象背后的机制尚未被完全理解。结果表明,收缩反应对α-肾上腺素的刺激在分离股动脉(损伤水平以下的动脉)来自脊髓损伤大鼠。股动脉对α-肾上腺素能刺激的反应性增强与内侧层α-肾上腺素能受体表达增强有关。
本研究发现,在脊髓损伤后的第10天,股动脉的血流量几乎检测不到,与脊髓损伤急性期神经源性休克的临床表现相当。SCI诱导的神经源性休克的病因是多因素的,包括周围血管阻力的降低、血管电容的丧失和心脏起源事件[8]。脊髓损伤急性期出现低血管张力是由于中枢交感神经张力下降(脊髓上控制中断)和正常副交感神经影响(完整的迷走神经支配)导致自主神经控制失衡所致[9]。有研究指出,损伤后1周股动脉血流量逐渐增加,最终恢复到POD14对照大鼠血流量的40%左右[10]。
本研究通过分离股动脉并分析其体外血管舒缩功能的结果表明,与对照组相比,脊髓损伤大鼠股动脉对KCl去极化和苯肾上腺素α肾上腺素刺激的收缩反应增强。KCl诱导收缩的变化略有增加,但无统计学差异。KCl激活电压操作的Ca2+通道,增加血管平滑肌细胞内游离Ca2+浓度[11]。由于KCl介导的血管收缩与受体无关,大鼠受伤后2周时股动脉血管平滑肌细胞质量可能没有变化。然而,本研究中使用的KCl(40 mM)浓度是次最大值;在最大浓度的氯化钾作用下,氯化钾诱导收缩的差异会增大。苯肾上腺素是一种选择性的α-肾上腺素受体激动剂,通过激活GqP蛋白偶联的IP3转导信号通路介导血管平滑肌收缩反应[12]。脊髓损伤大鼠股动脉等长张力曲线在苯肾上腺素累积添加后明显增高。最大收缩力提高50%,浓度反应曲线也左移,提示脊髓损伤大鼠离体股动脉对α-肾上腺素刺激更敏感。为了模拟体内α-肾上腺素的刺激,对麻醉大鼠静脉输注苯肾上腺素后的全身血压进行了测量。在基线水平上,脊髓损伤大鼠的平均动脉血压降低,这与低血管阻力和低血压发作的临床表现一致[13]。
突触后α-肾上腺素能受体的超敏反应,通过测量大鼠结肠直肠扩张和输注苯肾上腺素后的血压反应,在T5脊髓横断模型中已进行过研究[14]。前人的研究结果表明,在实验性脊髓损伤动物中,注射α-肾上腺素能激动剂可以显著增加血压[15]。最近,Rummery等人对T4 脊髓损伤的大鼠隐动脉对苯肾上腺素的等轴反应性进行分析[16]。第2周和第8周,大隐动脉的神经诱发收缩增强。这两项先前研究的结果支持我们的主要结果,即血管收缩对α-肾上腺素刺激的反应显著增强,导管动脉低于SCI水平。除了血流动力学和血管舒缩功能分析外,我们的研究还提供了重要的分子证据,证明周围动脉血管平滑肌中α1-肾上腺素受体在脊髓损伤水平以下上调。在多系统萎缩和脊髓横断患者中,血小板上α-肾上腺素受体数量增加,说明去神经支配对去甲肾上腺素输注超敏。中枢交感神经失神经支配下降患者α-肾上腺素能受体表达增加的确切机制尚不清楚,去甲肾上腺素低血浆水平可能是这种代偿现象的潜在发病机制之一[17]。
此外,我们还研究了股动脉血管壁确定结构脊髓损伤后外周动脉重构过程。在光镜检查下,血管壁脊髓损伤大鼠的形态与对照组相似。先前的研究指出,瘫痪肢体的外周动脉在脊髓损伤后发生重构,导致动脉壁向内重构[18]。然而,当与残疾肢体的肌肉体积相关时,SCI患者的外周动脉直径与健康个体的外周动脉直径相似[19]。因此,我们的研究可能表明,由神经轴向去神经支配下降引起的外周动脉的异常血管反应性很可能是由血管壁的功能改变而不是形态重塑引起的。
综上所述,肾上腺素受体在动脉平滑肌层的补偿表达增多的脊柱损伤水平下的延伸抗原,增强了对α-肾上腺素激动剂的响应性,并增强了自主异常发育的潜力。

