三维斑点追踪成像评价主动脉瓣置换术后左室扭转运动
糜素霖 周树良
主动脉瓣反流(aortic regurgitation,AR)是由于瓣叶和(或)其支持结构(主动脉根部或瓣环)的异常引起瓣叶闭合不全所致[1]。慢性重度AR会对左室产生过重的压力和容量负荷[2],在出现临床症状或左室功能不全前,左室往往已经发生不可逆的重构,因此早期识别左室功能障碍十分重要。研究[3-4]证明,应变及应变率指标在检测AR患者亚临床左室功能障碍中具有一定价值,但目前关于AR患者左室扭转和旋转运动的研究较少。与MRI相比,三维斑点追踪成像(three-dimensional speckle tracking imaging,3D-STI)在左室功能评价方面具有较好的可靠性和可重复性[5]。本研究应用3D-STI评价慢性重度AR患者左室扭转运动及主动脉瓣置换术前后左室扭转指标的变化,探讨左室扭转和旋转指标与左室构型、左室射血分数(LVEF)的关系,分析主动脉瓣置换术对左室扭转功能的影响。
资料与方法
一、研究对象
选取2016年11月至2017年11月我院收治的慢性重度AR患者76例,根据LVEF分为AR-A组40例(LVEF ≥55%),男25例,女15例,年龄25~72岁,平均(49.4±14.8)岁;AR-B组36例(LVEF<55%),男23例,女13例,年龄26~75岁,平均(48.0±14.1)岁。排除标准:冠状动脉造影显示一支以上血管狭窄率≥50%,合并轻度以上主动脉瓣狭窄,合并轻度以上二尖瓣反流和(或)狭窄及其他心肺疾病患者。另选同期无心肺疾病且性别、年龄与之匹配的健康志愿者30例(健康对照组),男16例,女14例,年龄27~69岁,平均(49.8±14.3)岁。本研究经我院医学伦理委员会批准,所有受检者均签署知情同意书。
二、仪器与方法
使用Philips iE 33彩色多普勒超声诊断仪,S5-1和X5-1探头,频率1~5 MHz;配备TomTec工作站。受检者取左侧卧位,同步连接心电图。常规超声心动图测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室舒张末期容积(LVEDV)和收缩末期容积(LVESV),经体表面积校正后获得左室舒张末期容积指数(LVEDVI)、收缩末期容积指数(IVESVI)及左室质量指数(LVMI),计算左室球形化指数(LV-SpI),LVSpI=LVEDV/[4/3π×(Dd/2) ],Dd为舒张末期四腔心切面二尖瓣环中点至左室心尖的连线。应用双平面Simpson法测量LVEF。于三维超声全容积模式下采集标准心尖四腔心切面,于呼气末屏气存储连续4个心动周期的图像,完整显示左室结构,图像帧频≥20帧/s。应用TomTec工作站进行图像后处理,选取三维图像(排除内膜显示不清者),顺序勾画舒张末期和收缩末期心尖四腔、三腔、两腔观左室心内膜边界;软件自动计算心尖部旋转角度(Api-Rot)及心尖部旋转达峰时间(Api-Rot TP)、基底部旋转角度(Basal-Rot)及基底部旋转达峰时间(Basal-Rot TP)、整体扭转(Torsion)及整体扭转达峰时间(Twist TP)。
31例行主动脉瓣置换术患者于术后2周复查常规超声心动图和3D-STI,测量上述参数。所有超声图像测量和分析均由同一超声医师完成,所有数据均测量3次取平均值。
三、统计学处理
结 果
一、各组常规超声心动图检查参数比较
AR-A组和AR-B组患者LVEDD、LVESD、LVEDVI、LVESVI、LVMI、LV-SpI均大于健康对照组(均P<0.05);AR-B 组 LVEDD、LVESD、LVEDVI、LVESVI、LVMI、LV-SpI均大于AR-A组(均P<0.01);AR-A组LVEF低于健康对照组(P<0.05),AR-B组LVEF显著低于AR-A组和健康对照组(均P<0.01)。见表1。
表1 各组常规超声心动图检查参数比较()
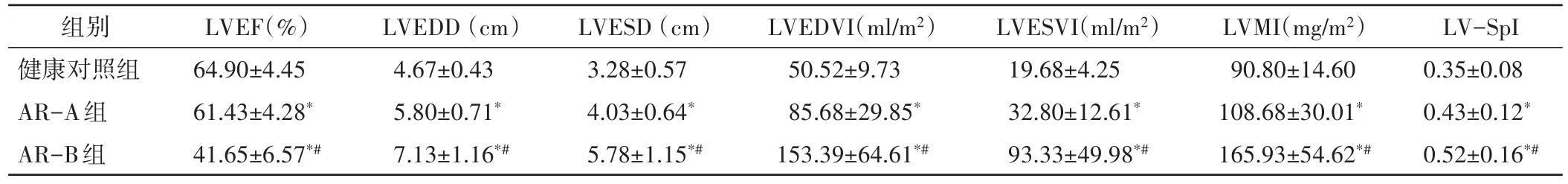
表1 各组常规超声心动图检查参数比较()
与健康对照组比较,*P<0.05;与AR-A组比较,#P<0.05。LVEF:左室射血分数;LVEDD:左室舒张末期内径;LVESD:左室收缩末期内径;LVEDVI:左室舒张末期容积指数;LVESVI:左室收缩末期容积指数;LVMI:左室质量指数;LV-SpI:左室球形化指数
LV-SpI 0.35±0.08 0.43±0.12*0.52±0.16*#组别健康对照组AR-A组AR-B组LVEF(%)64.90±4.45 61.43±4.28*41.65±6.57*#LVEDD(cm)4.67±0.43 5.80±0.71*7.13±1.16*#LVESD(cm)3.28±0.57 4.03±0.64*5.78±1.15*#LVEDVI(ml/m2)50.52±9.73 85.68±29.85*153.39±64.61*#LVESVI(ml/m2)19.68±4.25 32.80±12.61*93.33±49.98*#LVMI(mg/m2)90.80±14.60 108.68±30.01*165.93±54.62*#
二、各组3D-STI表现比较
健康对照组心尖部旋转曲线表现为正向波形,基底部旋转曲线表现为负向波形,左室整体扭转曲线表现为正向波形。AR-A组Api-Rot和Torsion均小于健康对照组(均P<0.05),Basal-Rot与健康对照组比较差异无统计学意义;AR-B 组 Api-Rot、Basal-Rot和Torsion均小于健康对照组(均P<0.05),Basal-Rot和Torsion均小于AR-A组(均P<0.05),Api-Rot与AR-A组比较差异无统计学意义。见表2和图1。
健康对照组Api-Rot TP与Basal-Rot TP一致,Twist TP出现于收缩期末。AR-A组Api-Rot TP与健康对照组比较,差异无统计学意义,Basal-Rot TP、Twist TP均延长(均P<0.05),其中25例患者Twist TP出现于舒张期;AR-B组各达峰时间均较AR-A组和健康对照组缩短(均P<0.05)。见表2和图1。
三、行主动脉瓣置换术患者术前、术后各检测参数比较
表2 各组3D-STI检查参数比较()

表2 各组3D-STI检查参数比较()
与健康对照组比较,*P<0.05;与AR-A组比较,#P<0.05。Api-Rot:心尖部旋转角度;Basal-Rot:基底部旋转角度;Torsion:整体扭转;Api-Rot TP:心尖部旋转达峰时间;Basal-Rot TP:基底部旋转达峰时间;Twist TP:整体扭转达峰时间
Twist TP(ms)316±45 353±69*274±66*#组别健康对照组AR-A组AR-B组Api-Rot(°)10.74±2.64 8.38±3.59*7.22±2.74*Basal-Rot(°)-7.25±2.11-6.55±3.18-4.66±2.55*#Torsion(°/cm)2.33±0.52 1.63±0.47*1.17±0.46*#Api-Rot TP(ms)316±44 348±70 266±71*#Basal-Rot TP(ms)312±59 354±84*261±70*#
31例手术患者术后LVEDD、LVESD均较术前减小,且均大于健康对照组(均P<0.05);LVEDVI较术前明显减小(P<0.01),与健康对照组比较差异无统计学意义;LVESVI、LVMI、LV-SpI均较术前减小,且均大于健康对照组(均P<0.05);LVEF亦较术前减小(P<0.05)。与健康对照组比较,术前Torsion和Api-Rot均减小(均P<0.01),Basal-Rot差异无统计学意义;术后Torsion较术前增大,且小于健康对照组,Api-Rot亦较术前增大(均P<0.05),与健康对照组比较差异无统计学意义;术后Basal-Rot与术前和健康对照组比较差异均无统计学意义。见表3和图2。
四、相关性分析
相关性分析显示,Torsion、Api-Rot、Basal-Rot与LVEF均呈正相关(r=0.591、0.327、0.369,均P<0.05);Torsion、Api-Rot与 LV-SpI均呈负相关(r=-0.506、-0.320,均P<0.05)。
讨 论
研究[6]发现,相较于LVEF,左室整体扭转主要受心肌收缩力和肌纤维排列方向的影响,不依赖负荷条件的变化。Kim等[7]发现,与LVEF相比,心尖部旋转和左室整体扭转与反映心肌收缩力的金标准相关性更佳。研究[8]还发现,扩张型心肌病患者左室收缩期峰值扭转受损程度与左室整体功能障碍的程度成正比。因此,定量评估左室扭转可以敏感地反映心肌力学改变和左室整体心肌功能。本研究发现,LVEF保留的AR患者即AR-A组和LVEF减低的AR患者即AR-B组Api-Rot均低于健康对照组(均P<0.05),且上述两组间比较差异无统计学意义,表明AR-A组与AR-B组心尖旋转受损程度相当,提示与基底部旋转功能相比,心尖部旋转更易受心肌功能受损的影响。Lilli等[9]也认为心尖部旋转可能是左室整体扭转的主要决定因素,能敏感地反映心肌功能的受损程度。
表3 31例行主动脉瓣置换术患者术前、术后及其与健康对照组超声检查参数比较()

表3 31例行主动脉瓣置换术患者术前、术后及其与健康对照组超声检查参数比较()
与术前比较,*P<0.05;与健康对照组比较,#P<0.05。LVEF:左室射血分数;LVEDD:左室舒张末期内径;LVESD:左室收缩末期内径;LVEDVI:左室舒张末期容积指数;LVESVI:左室收缩末期容积指数;LVMI:左室质量指数;LV-SpI:左室球形化指数;Torsion:左室整体扭转;Api-Rot:心尖部旋转角度;Basal-Rot:基底部旋转角度
LVEF(%)LVEDD(cm)LVESD(cm)LVEDVI(ml/m2)LVESVI(ml/m2)LVMI(mg/m2)LV-SpI Api-Rot(°)Basal-Rot(°)Torsion(°/cm)1.37±0.58#1.90±0.87*#2.33±0.52研究对象ARV患者术前术后健康对照组56.74±8.57#51.39±8.00*#64.90±4.45 6.16±1.24#4.91±0.66*#4.67±0.43 4.42±0.96#3.81±0.79*#3.28±0.57 97.27±52.62#53.09±26.12*50.52±9.73 48.42±38.78#27.96±18.63*#19.68±4.25 129.30±47.45#92.93±35.78*#90.80±14.60 0.43±0.11#0.37±0.10*#0.35±0.08 7.61±3.11#9.68±5.27*10.74±2.64-6.01±3.50-6.16±3.59-7.25±2.11
既往研究[10-11]认为左室扭转和旋转主要受心肌收缩和松弛能力、心内膜下和心外膜下肌纤维收缩的平衡及心肌纤维朝向的影响。本研究结果显示,Torsion和RoA-Rot均与LV-SpI相关,表明心尖部旋转和左室扭转均受左室构型的影响。研究[2]表明,心内膜下心肌纤维与长轴线形成约60°夹角,心外膜下心肌纤维与长轴线形成约反向60°夹角,当此夹角趋于90°时,左室收缩期峰值旋转角度会减少一半。本研究中,慢性重度AR患者LV-SpI明显增大,提示左室进行性扩张,趋于球形化,斜行的心肌纤维趋于横向排列,与长轴的夹角增大,导致旋转和扭转功能受损。患者行主动脉瓣置换术后,LVEDVI、LVESVI、LVMI及LV-SpI均较术前减小(均P<0.05),术后早期Torsion较术前增大,提示随着左室形态的恢复,心肌纤维朝向随之改变,扭转功能也逐渐恢复,进一步证明左室扭转和旋转均与左室构型相关。研究[12]表明,心内膜下肌纤维产生心底的逆时针旋转和心尖的顺时针旋转,心外膜下肌纤维产生心底的顺时针旋转和心尖的逆时针旋转,由于心外膜下心肌纤维旋转半径大,可产生更大的扭转力矩,因此其主导左室心底、心尖旋转、整体扭转的大小和方向。随着AR的进展,左室壁出现不同程度的纤维化,AR早期出现心内膜下心肌纤维化,其对扭转和旋转的调控作用减弱,心外膜下肌纤维的主导作用增强,左室旋转、整体扭转将会增强。随着AR程度增大,心肌间质纤维化累及左室壁全层,左室旋转和扭转功能同时失去心内膜下肌纤维与心外膜下肌纤维的主导,导致左室扭转功能受损。
本研究发现LVEF保留的重度AR患者即AR-A组扭转达峰时间延长,分析原因可能为心肌间质纤维化累及室壁全层,由心内膜下心肌向心外膜下心肌传播的时间间期延长。Pacileo等[8]对原发性心肌病患者进行研究,发现即使射血分数保留,部分患者也表现出扭转时间延长和解扭转的延迟,推测延长的收缩期扭转可能为维持正常射血分数的一种代偿机制。同时,本研究结果显示LVEF减低的重度AR患者即AR-B组心底与心尖旋转达峰时间明显不一致,Basal-Rot TP、Api-Rot TP及Twist TP均较AR-A组和健康对照组缩短(均P<0.05),达峰时间早于收缩末期,分析原因可能是AR左室功能失代偿期,为了代偿增加的室壁应力,左室壁向心性肥厚,心肌收缩功能受损同时伴随舒张期松弛能力和顺应性减低,左室心肌的旋转及解旋能力均减低,收缩期心肌纤维无法产生足够的动力来充分缩短左室心肌,致旋转达峰时间提前。
综上所述,3D-STI能准确评价慢性重度AR患者主动脉瓣置换术前后左室扭转和旋转指标的改变,有助于评估手术对左室旋转和扭转功能的影响。但本研究样本量较小,且未对患者进行术后长期随访,今后应进一步扩大样本量深入研究。

