水莲石斛的组织培养与快速繁殖
莫远琪 李汉文 江南 郑枫 房林 李琳 周依清 吴坤林 曾宋君
摘 要:以水蓮石斛(DendrobiumHibiki)幼嫩假鳞茎为外植体进行组织培养和快速繁殖研究。结果表明:利用75%乙醇结合0.1% HgCl2,以及适宜程序进行外植体消毒,成功率达92.50%;诱导腋芽的最适培养基为改良MS添加3.0 mg/L 6-BA和0.5 mg/L NAA,腋芽诱导率为91.90%;丛生芽增殖最适培养基为MS培养基添加5.0 mg/L 6-BA和0.5 mg/L NAA,平均增殖系数为2.77;生根壮苗最适培养基为1/2 MS+0.5 mg/L IBA+1.5 g/L活性炭+30 g/L蔗糖+100 g/L土豆泥,生根率100%,生根效果最好;体积比1∶1的植金石与椰壳混合基质适合于移栽,移栽成活率为95.56%。
关键词:水莲石斛;假鳞茎;快速繁殖;移栽
中图分类号:Q813.1+2 文献标识码:A
Tissue Culture and Rapid Propagation ofDendrobiumHibiki
MO Yuanqi1, 2, LI Hanwen3, JIANG Nan3, ZHENG Feng2, FANG Lin2, LI Lin2, ZHOU Yiqing2, WU Kunlin2, ZENG Songjun2, 4*
1. Institute of Crop Germplasm Resources, Guizhou Academy of Agricultural Sciences, Guiyang, Guizhou 550006, China; 2. Key Laboratory of South China Agricultural Plant Molecular Analysis and Gene Improvement, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou, Guangdong 510650, China; 3. Dongguan Agricultural Science Research Center, Dongguan, Guangdong 523000, China; 4. Guangdong Provincial Key Laboratory of Applied Botany, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou, Guangdong 510650, China
Abstract: The young pseudobulbs ofDendrobiumHibiki were taken as the explants for tissue culture and rapid propagation. The results showed that the success rate of explants disinfection reached 92.50% when treating the explants with proper disinfection methodsby 75% alcohol and 0.1% HgCl2. The modified MS supplemented with 3 mg/L 6-BA and 0.5 mg/L NAA was the most suitable medium for axillary bud induction, in which the induction rate was 91.90%. MS supplemented with 5.0 mg/L 6-BA and 0.5 mg/L NAA was the most suitable medium for the multiplication of clustered shoots, in which the multiplication coefficient was 2.77. 1/2 MS supplemented with 0.5 mg/L IBA, 1.5 g/L activated carbon, 30 g/L sucrose and 100 g/L potato homogenate was the most suitable medium for the rooting and growth, the rooting rate was 100% and growth status of the plantlets was the best. On the mixture of Zhijing stone: coconut husk=1∶1 (V∶V), the plantlets transplanted grew fastly and the survival percentage was 95.56%.
Keywords: Dendrobium Hibiki; pseudobulbs; proliferation; transplantion
DOI: 10.3969/j.issn.1000-2561.2020.06.016
石斛属(Dendrobium)是兰科中第2大属,全球大约1500~1600个原生种,13 600多个杂交种[1-4]。石斛属原生种主要分布于东南亚的热带、亚热带以及大洋洲[5]。水莲石斛(DendrobiumHibiki)是以长苞石斛(D. bracteosum)为母本、雪山石斛(D. laevifolium)为父本杂交获得的新品种。其株型较小、花型紧凑,冬天老茎上的叶片掉落,春天出新芽,叶片质地稍硬,茎秆泛浅紫红,花朵呈紫红色,常盛开在老茎上,与叶片交相辉映,绚丽夺目,花期较长,一般可达40~50 d,且一年中可多次开花;同时,其易栽培且长速快,适合作为盆栽,是近年来我国花卉市场中较受欢迎的石斛新品种之一,因其花型和水莲相近,在中国花卉市场上称为水莲石斛。我国花卉市场上的水莲石斛多从中国台湾引进,价格昂贵。水莲石斛可采用普通的分株和扦插繁殖,但繁殖周期较长,繁殖速度慢,且容易受到环境的影响;采用种子进行无菌播种会发生性状分离;只有采用组织培养技术进行优质种苗的快速繁殖,才能满足市场需求。目前以假鳞茎为外植体,通过组织培养建立快速繁殖及种苗生产体系在石斛兰杂交种中已广泛应用,但不同种类所需的最适培养基成分和培养条件存在较大差异[6]。国内外关于水莲石斛的组织培养快速繁殖技术尚未见报道。本研究以水莲石斛的幼嫩假鳞茎为外植体进行组织培养与快速繁殖研究,旨在建立其种苗快繁体系,以利于水莲石斛的应用和推广,也为其他优良石斛新品种的种苗生产提供参考。
1 材料与方法
1.1材料
水莲石斛母株(DendrobiumHibiki)(图1A)由广州华大锦兰花卉有限公司提供,引种于中国台湾,栽培于华南植物园科研区温室内(温度15~32 ℃,湿度50%~90%,常规管理),取幼嫩的假鳞茎为外植体(图1B)用于组培实验。
1.2方法
1.2.1 培养基和培养条件 根据实验目的选择不同的培养基,添加不同浓度的植物生长调节剂,以MS[7]、1/2MS(大量元素减半)或改良的MS培养基(包括MS的大量、微量和铁盐及B5维生素:肌醇100 mg/L、烟酸4 mg/L、烟酸吡哆醇4 mg/L、盐酸硫胺素40 mg/L)为基本培养基。培养室培养条件为光周期12 h/d,光照强度40~ 45 μmol/(m2·s),温度(25±2)℃,培养周期45 d。
1.2.2 外植体的消毒 在超净工作台上,去除假鳞茎多余叶片,用75%乙醇浸泡过的棉花擦拭3次后,于75%乙醇中浸泡30 s;无菌水冲洗3次后置于含有1滴吐温的0.1% HgCl2中浸泡6 min,再用无菌水冲洗3次;剥去茎段表面的假鳞片,再次用0.1% HgCl2浸泡2 min,无菌水冲洗3次获得消毒的外植体。
1.2.3 不同培养基对腋芽诱导的影响 分别取外植体的上、中、下3个节位,接种在MS+3 mg/L 6-BA,改良MS培养基及改良MS+6-BA(1.0、3.0、5.0、7.0 mg/L)上,每个处理10瓶,每瓶接入含一个节位的外植体,重复3次。休眠芽萌动的起始时间以芽体明显变大为标准,腋芽诱导率=已诱导出芽的外植体数/接种的外植体总数×100%。
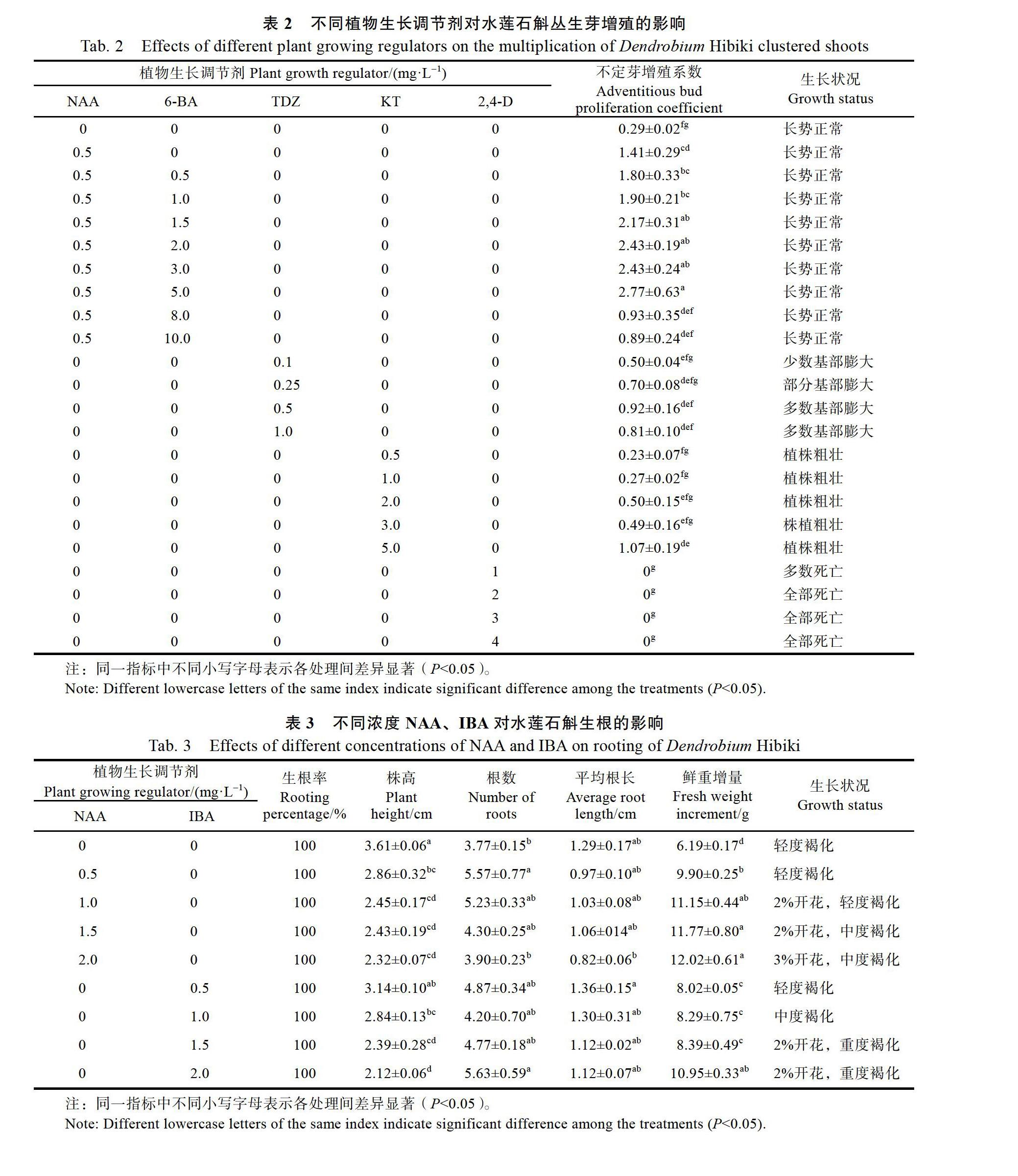
1.2.4 丛生芽的增殖 MS+15%椰汁为基础培养基,添加0.5 mg/L NAA+6-BA(0、0.5、1.0、2.0、3.0、5.0、8.0、10.0 mg/L)、TDZ(0.1、0.25、0.5、1.0 mg/L)、KT(0.5、1.0、2.0、3.0、5.0 mg/L)、2,4-D(1.0、2.0、3.0、4.0 mg/L)进行丛生芽的增殖,以不添加任何植物生长调节剂为对照,每处理10瓶(10丛双芽/瓶),重复3次。生长芽增殖倍数=新增芽数/接种数。
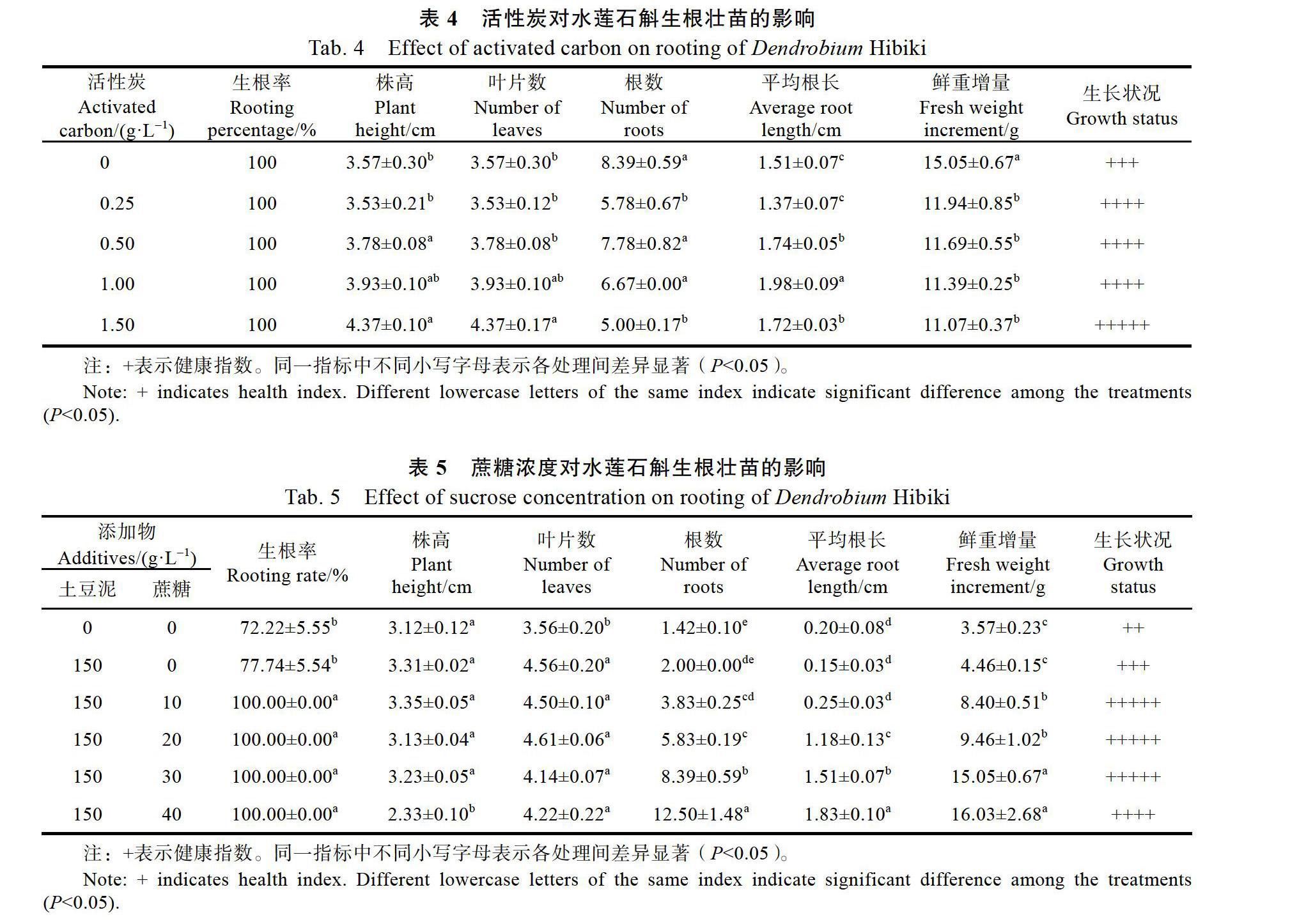
1.2.5 NAA和IBA对生根壮苗的影响 1/2MS+ 15%椰汁为基础培养基,添加NAA(0.5、1.0、1.5、2.0 mg/L)、IBA(0.5、1.0、1.5、2.0 mg/L),以不添加植物生长调节剂为对照。每处理10瓶,20株单芽/瓶,重复3次;实验结束后测量株高、叶片数、根数、根长、鲜重增量并评价其生长状况。
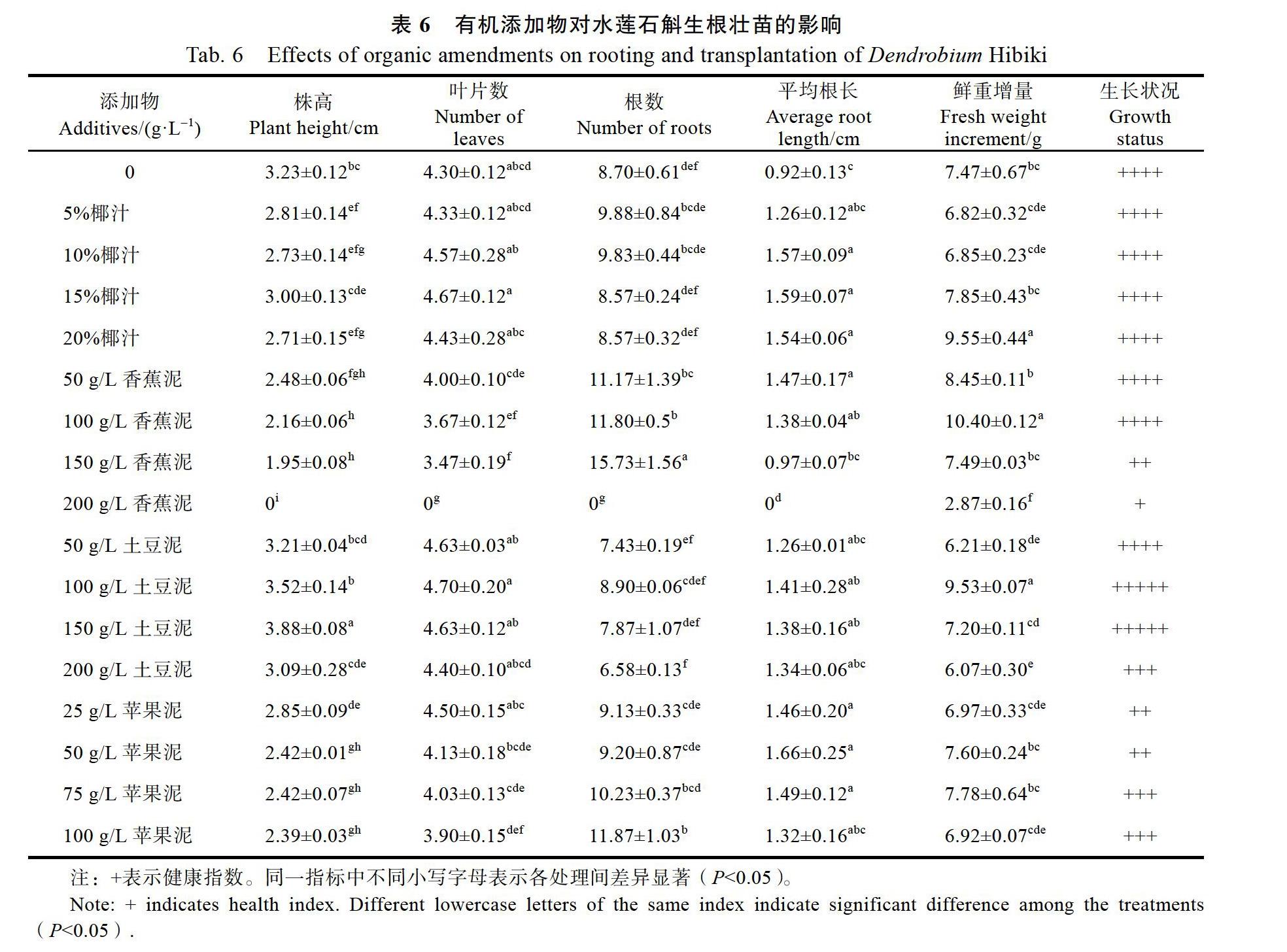
1.2.6 活性炭、蔗糖和其他有机添加物对生根壯苗的影响 以1/2 MS+0.5 mg/L NAA+150 g/L土豆泥为基础培养基,添加活性炭(0.25、0.5、1.0、1.5 g/L),以不添加活性炭为对照;在蔗糖浓度实验中,在1/2 MS培养基中加入蔗糖(0、10、20、30、40 g/L),以不含土豆泥及蔗糖为对照。
以1/2 MS+0.5 mg/L NAA+30 g/L蔗糖+1.5 g/L活性炭为基础培养基,添加椰汁(5%、10%、15%、20%)、香蕉泥(50、100、150、200 g/L)、土豆泥(50、100、150、200 g/L)或苹果泥(25、50、75、100 g/L)进行壮苗培养,以不添加有机添加物为对照。培养条件及测量方法同上。
1.2.7 试管苗移栽 选用兰石、植金石(日本进口)、泥炭土(德国进口)、水苔、椰壳、松树皮共6种基质,设置单一基质或不同配比的两种复合基质共30个处理(表7)。将生长健壮的幼苗(株高约3.5 cm,含4~5片叶,长势大体一致)移栽到各基质中,每个处理30盆(花盆内径10 cm,高9 cm,每盆盛装基质85%),每盆3株,培养于华南植物园温室内,2个月后观测其生长状况。
1.3数据处理
采用SPSS软件进行数据分析,采用Duncans法进行多重比较。
2 结果与分析
2.1外植体的消毒及腋芽的诱导
在消毒后接种的40个外植体,污染3个,污染率为7.5%,未污染的外植体均成活并诱导出腋芽,成功率92.5%。预备实验时发现改良的MS培养基附加3.0 mg/L 6-BA适合于水莲石斛腋芽的诱导和前期增殖(图1B)。
以改良MS为基本培养基,测试了6-BA浓度对诱导不定芽及休眠芽起始萌动时间的影响。结果表明(表1):1.0、3.0、5.0 mg/L的6-BA均能促进腋芽的诱导,其中6-BA浓度为3.0 mg/L时诱导效果最好,对上段、中段、下段外植體腋芽的诱导率分别为24.07%、81.90%、91.90%,均显著高于对照。当6-BA浓度为7.0 mg/L时,与对照相比,有抑制作用。
从外植体的部位上分析,在供试的5种培养基上,均以假鳞茎下段为外植体的腋芽诱导率最高,中段次之,上段最低。从腋芽起始萌动时间上看,下段的腋芽起始萌动时间最短,为11~16 d;中段次之,为11~17 d;上段最长,为20~22 d。综合分析腋芽的诱导率和起始萌动时间可知,水莲石斛腋芽诱导的最适宜培养条件是以假鳞茎下段为外植体在改良MS+3.0 mg/L 6-BA培养基上进行培养。
2.2丛生芽的增殖
在研究不同浓度植物生长调节剂NAA、6-BA、2,4-D、TDZ、KT对丛生芽增殖效率的影响时发现,在供试的5种植物生长调节剂中,除2,4-D对丛生芽增殖有抑制作用并引起外植体全部死亡外,其余4种均能促进丛生芽增殖。
在一定的浓度范围内,NAA与6-BA配合使用效果显著,当NAA的浓度为0.5 mg/L时,在0.5~5.0 mg/L范围内随着6-BA浓度的增加,不定芽增殖系数逐步增大,当6-BA浓度为5.0 mg/L时增殖系数达最大值2.77,生长状况良好,但与添加1.5、2.0、3.0 mg/L 6-BA的培养基无显著性差异(图1C);当6-BA浓度增加到8.0 mg/L及以上时,不定芽增殖系数下降(表2)。单独添加TDZ及KT对其增殖效果不显著,而且添加TDZ会导致母株基部畸形膨大。
2.3 NAA、IBA对生根的影响
在1/2 MS培养基上添加或不添加植物生长调节剂NAA、IBA,水莲石斛均能生根,且生根率达100%,添加NAA、IBA对生根壮苗有显著影响。与对照相比,在测试的0.5~2.0 mg/L浓度范围内,NAA、IBA均能刺激生根,植株根数显著增加,根长缩短,但差异不显著;其中以0.5 mg/L的NAA、2.0 mg/L的IBA处理根数最多,分别为5.57和5.63。NAA、IBA处理显著降低株高和增加植株鲜重,表现出明显的壮苗特征;在测试的0.5~2.0 mg/L浓度范围内,表现出随NAA和IBA浓度升高植株株高降低、鲜重增加的趋势(表3)。
NAA浓度等于或大于1.0 mg/L及IBA浓度等于或大于1.5 mg/L时,个别试管苗出现开花现象(图1D)。综合根数、根长、株高、鲜重等参数,0.5 mg/L IBA最适用于水莲石斛的生根壮苗(表3)。
2.4活性炭、蔗糖和其他有机添加物对生根壮苗的影响
在以1/2 MS+0.5 mg/L NAA+150 g/L土豆泥为基础培养基,添加不同浓度(0.25、0.50、1.00、1.50 g/L)活性炭的培养基上,从植株长势来看,添加活性炭的植株生长状况均优于对照;随着活性炭浓度的增加,株高、叶片数、根长逐渐增加,但根数和鲜重增量显著下降,1.50 g/L活性炭对水莲石斛生长促进作用最佳(表4)。
在1/2 MS培养基中加入不同浓度(0、10、20、30、40 g/L)蔗糖,以不含土豆泥及蔗糖为对照的实验中,添加蔗糖对生根壮苗促进效果显著,在不添加蔗糖,添加或不添加150 g/L土豆泥的培养基上,生根率分别为77.74%和72.22%,均显著低于添加蔗糖的培养基,生长状况均优于不加蔗糖的对照,因此,在生根培养基中必须添加蔗糖;在分别添加10、20、30 g/L蔗糖时,株高与对照无差异,但叶片数、根数、鲜重增量均显著高于对照,而添加40 g/L蔗糖时,株高显著低于对照和其他处理,对生根壮苗具有抑制作用。综合上述实验结果,在培养基中添加30 g/L蔗糖对水莲石斛的生根壮苗效果最好(表5)。
以1/2 MS+0.5 mg/L NAA+30 g/L蔗糖+1.5 g/L活性炭为基础培养基,添加不同浓度的有机添加物对水莲石斛生根壮苗有显著影响。由于培养基中加入了30 g/L蔗糖,生根率均为100%(数据在表6中没有显示)。从表6可看出,与对照相比,添加50、75、100 g/L苹果泥,150、200 g/L香蕉泥,以及200 g/L土豆泥对植株生长有抑制作用,不适于水莲石斛生根壮苗。添加不同浓度的椰汁时,株高均不同程度降低,叶片数变化不显著,根长显著增加;当添加5%、10%浓度椰汁时根数显著增加,但鲜重增量减少,而20%浓度时鲜重增量显著。添加50、100 g/L香蕉泥时,株高显著降低、叶片数稍少,根数和根长、鲜重增量显著增加。添加50、100、150 g/L土豆泥,植株株高、根长显著增加,叶片数、根数变化不显著,添加100 g/L土豆泥时鲜重增量显著。综合考虑各参数,添加15%、20%的椰汁、100 g/L香蕉泥或100 g/L土豆泥对生根壮苗促进效果较好,其中添加100 g/L土豆泥效果最佳(图1E),适用于水莲石斛的生根壮苗培养。
2.5试管苗的移栽
表7显示,在供试的6种单一基质中,试管苗的移栽成活率在62.23%~83.34%之间,松树皮的最低,泥炭土的最高;从生长状况看,叶宽增加的叶片数比例在17.78%~53.33%,以椰壳为基质时最低,以泥炭土和兰石的最高;从叶片光泽度看,以泥炭土为基质时的光泽度最好。综合以上参数,泥炭土是最适于水莲石斛试管苗移栽的单一基质。在实验的24个复合基质中,试管苗的移栽成活率在48.89%~100%之间(表7),泥炭土∶松树皮=1∶1的存活率最高,为100%,其次分别为植金石∶椰壳=1∶1(成活率95.56%)和植金石∶泥炭土=1∶1(成活率95.55%)。从生长状况看,叶宽增加的叶片数比例最高的是植金石∶泥炭土=1∶1(66.67%的叶宽增加),其次依次为泥炭土∶松树皮=1∶1(64.44%的叶宽增加),植金石∶泥炭土=1∶2(48.89%的叶宽增加);从叶片光泽度上看,表现最好的前3种基质分别为植金石∶椰壳=1∶1,植金石∶泥炭土=1∶1和泥炭土∶松树皮=1∶1。综合以上参数,适于水莲石斛试管苗移栽的复合基质为:泥炭土∶松树皮= 1∶1、植金石∶泥炭土=1∶1(图1F)及植金石∶椰壳=1∶1。
3 讨论
3.1不同基本培养基对水莲石斛腋芽生长的影响
石斛组织培养常用基本培养基有MS、1/2MS、2MS、KC[8]、1/2KC、VW、B5[9]、N6[10]、Phytotechnology、Mitra、改良RM[11]等,其中,使用较多的是MS(67%)、1/2MS、KC、VW[6]。本研究结果显示,改良MS培养基(含有B5培养基维生素,维生素含量较高)比MS培养基更适于水莲石斛腋芽的诱导。
组织培养中添加硫胺素(VB1),烟酸(VB3)及烟酸吡哆醇(VB6)、氨基酸等有益于细胞生长[12]。比较多种培养基对石斛芽诱导及增殖时,周俊辉等[13]、杨联河等[14]、刘骅等[15]等均发现B5优于其他基本培养基。周华伟等[16]也报道2.0 mg/L烟酸能促进石斛兰试管苗的生长。在以水莲石斛假鳞茎为外植体诱导腋芽时,由于改良MS培养基中维生素的含量远远大于MS培养基中的量,所以在添加同一植物生长调节剂的条件下,高维生素含量的改良MS培养基比MS培养基在腋芽的诱导速率上有明显优势,说明维生素对丛生芽的诱导有促进作用,本研究结果与周华伟等[16]在石斛兰组织培养中的结果相似。
3.2不同植物生长调节剂对水莲石斛增殖、生根的影响
傅玉兰等[17]发现3.0 mg/L KT、0.2 mg/L 2,4-D能促进霍山石斛试管苗生长和继代增殖。石兰英等[18]在含1.0 mg/L 6-BA及0.1 mg/L NAA的MS培养基中添加较低浓度的TDZ能使石斛兰幼芽基部膨大并分化成芽。水莲石斛丛生芽增殖过程中加入不同浓度的TDZ会导致水莲石斛植株畸形,而在培养基加入1.0~4.0 mg/L 2,4-D时,外植体全部死亡,说明不同种类的石斛对植物生长调节剂的要求存在差异。在培养基中加入2,4-D时导致植株死亡,可能是由于2,4-D虽具有激素活性,但也具毒性[19],其氯代谢中间产物可使植物突变或生长畸形[20],本研究结果与卢文芸[21]的报道相似。
生长素用于诱导细胞的分裂和分化,但若使用浓度过高则会产生乙烯而导致抑制效果[13]。杜启兰[22]报道,石斛兰增殖培养适宜的6-BA和NAA浓度均为0.5 mg/L,根诱导以1.0~2.0 mg/L IAA较好。石玮等[23]在研究0.2~2.0 mg/L NAA以及0.1~1.5 mg/L IBA对霍山石斛试管苗生根影响时发现二者具有相同的效应,低浓度的生长素促进生根,高浓度则抑制生根及苗的发育,0.2 mg/L NAA或0.1 mg/L IBA有利于霍山石斛生根。本研究表明,在不添加任何植物生长调节剂的1/2 MS基本培养基中,水莲石斛能正常生根,添加一定浓度的生长调节剂后其根数增多,但株高及叶片数在一定程度上降低,其伸长生长受到抑制,推测水莲石斛在生根培养时,幼芽中可能具有较高浓度的内源激素所引起,这个结论与黄肇宇等[24]、石玮等[23]的报道一致。
高磷低氮能够刺激兰花试管开花[25-26],冯莹[27]在单茎型杂种兰花花芽诱导和发育的研究中发现添加6-BA可促使石斛兰的花芽发育成熟并开花,Sim等[28-29]也发现相似的研究结果。水莲石斛生根过程中,以MS为基本培养基添加15%椰汁、0.5 mg/L NAA以及不同浓度6-BA,随着6-BA浓度的增加,少量植株有试管内开花现象。推测水莲石斛的试管开花可能与培养基的高磷低氮以及添加6-BA和椰子汁有关,此结果与李璐[30]的报道一致,但有关水莲石斛的试管开花机制有待深入研究。
3.3活性炭及不同有機添加物对水莲石斛壮苗的影响
培養基中富含氨基酸、植物生长调节剂和维生素的天然复合物可促进愈伤组织和器官的生长。在石斛属的组织培养中,已报道的有机添加物有椰子汁、香蕉泥、土豆泥、苹果泥、西瓜汁、白萝卜汁、壳聚糖、极可善、海藻等[31-33]。本研究试验了椰汁、苹果泥、香蕉泥、土豆泥的壮苗效果,结果表明以1/2 MS为培养基时,添加100 g/L土豆泥适用于水莲石斛的生根壮苗培养。
活性炭具有吸附作用,在植物组织培养中,添加一定量的活性炭可吸附植物分泌的有害物质,以解决培养过程中的褐化问题,但由于活性炭对物质的选择性不高,吸附有害物质的同时也能吸附某些植物生长必需的营养成分,包括植物生长调节剂,因此,活性炭的添加量因植物种类而异[34-35]。本研究发现添加1.5 g/L活性炭对水莲石斛的生根壮苗促进效果最佳。
3.4水莲石斛移栽过程中基质的选择
水莲石斛的生长势较弱,采用单一基质时,移栽成活率较低,因此本研究进行了大量的移栽基质实验。研究的6种单一基质各有特点,植金石、兰石持水性透气性好,但营养成分较低;水苔持水能力、透气性较好,但容重不足;椰壳保水性好,但其盐分过高,浸泡后具有较高的电导率,对植物根系伤害较大且不利于作物对营养成分的吸收;松树皮透气性好但持水性不高;进口泥炭土营养成分及保水能力较高,但价格较为昂贵且通气性较差,栽培过程中较难管理。本研究中采用松树皮移栽成活率较低的原因可能与其持水性较差有关,其他基质也存在着一些缺点。根据各种基质的优缺点,将单一组合成混合基质能有效地解决这些问题,结合移栽后植株生长状况来看,泥炭土∶松树皮=1∶1,植金石∶泥炭土=1∶1,植金石∶椰壳=1∶1较佳,这些混合基质既有较好的保水性,又具有较好的透水性。综合考虑种植成本,市场上植金石单价10元/L,德国进口泥炭土单价1.5元/L,椰壳单价0.5元/L,松树皮单价0.4元/L。因此,基质植金石∶泥炭土=1∶1和基质植金石∶椰壳=1∶1两种混合基质,尽管移栽成活率较高,但由于植金石较贵,适用于少量水莲石斛盆栽,而泥炭土∶松树皮= 1∶1成本较低,成活率高,适用于大规模的商业化生产。
参考文献
<!--[if !supportLists]-->[1] <!--[endif]-->Wu Z Y, Raven P H, Hong D Y. Flora of China-Illostrations Asteraceae[M]. Beijing: Science Press, St. Louis: Missouri Botanical Garden Press 2009: 367-397.
<!--[if !supportLists]-->[2] <!--[endif]-->彭红明, 李振坚, 王 雁. 石斛兰: 资源·生产·应用[M]. 北京: 中国林业出版社, 2007.
<!--[if !supportLists]-->[3] <!--[endif]-->Pridgeon A, Morrison A. The Illustrated Encyclopedia of Orchids-Over 1100 Species Illustrated and Identified[M]. Timber Press Ltd, Portland, 2006, 87-103.
<!--[if !supportLists]-->[4] <!--[endif]-->Wood H P. The Dendrobiums[M]. New York: Workman Pub Co, 2006.
<!--[if !supportLists]-->[5] <!--[endif]-->李振坚, 张 毓. 世界流行石斛属观赏种介绍[J]. 中国花卉园艺, 2010(20): 33-35.
<!--[if !supportLists]-->[6] <!--[endif]-->Teixeira da Silva J A, Cardoso J C, Dobra?nszki J, et al. Dendrobium micropropagation: a review[J]. Plant Cell Reports[J], 2015, 5(34): 671-704.
<!--[if !supportLists]-->[7] <!--[endif]-->Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiolgia Plantarum, 1962, 15(3): 473-497.
<!--[if !supportLists]-->[8] <!--[endif]-->Knudson L, Knudson I. A new nutrient solution for germination of orchid seeds[J]. American Orchid Society Bulletin, 1946(15): 214-217.
<!--[if !supportLists]-->[9] <!--[endif]-->Gamborg O L, Miller R A, Ojima K. Nutrient requirements of suspension cultures of soybean root cells[J]. Experimental Cell Research, 1968, 50(1):151-158.
<!--[if !supportLists]-->[10] <!--[endif]-->Zhu Z Q, Wang J J, Sun J S,et al. Establishment of an efficient medium for anther culture of rice[J]. Science in China, Ser. A, 1975 (5): 659-668.
<!--[if !supportLists]-->[11] <!--[endif]-->Kukulczanka K, Wojciechowska U. Propagation of twoDendrobiumspecies byin vitroculture[J]. Acta Horticulturae, 1983(131): 105-110.
<!--[if !supportLists]-->[12] <!--[endif]-->李浚明, 朱登云. 植物组织培养教程[M]. 3版. 北京: 中国农业大学出版社, 2006.
<!--[if !supportLists]-->[13] <!--[endif]-->周俊辉, 钟雪锋, 蔡丁穩. 铁皮石斛的组织培养与快速繁殖研究[J]. 仲恺农业技术学院学报, 2005(1): 23-26.
<!--[if !supportLists]-->[14] <!--[endif]-->杨联河, 王倩嵘, 石 拓, 等. 曲茎石斛组织培养研究[J]. 中国中药杂志, 1998(11): 18-19.
<!--[if !supportLists]-->[15] <!--[endif]-->刘 骅, 张治国. 铁皮石斛试管苗壮苗培养基的研究[J]. 中国中药杂志, 1998(11): 14-16, 62.
<!--[if !supportLists]-->[16] <!--[endif]-->周华伟, 李世君, 钱秀红, 等. 组织培养中若干因素对石斛兰试管苗生长的影响[J]. 浙江农业大学学报, 1995(6): 622-624.
<!--[if !supportLists]-->[17] <!--[endif]-->傅玉兰, 谷 凤, 胡传明, 等. 霍山石斛组培快繁技术研究[J]. 安徽农业科学, 2004(3): 522-523.
<!--[if !supportLists]-->[18] <!--[endif]-->石兰英, 田新民. TDZ在4种观赏花卉芽增殖中的应用[J]. 南方园艺, 2015, 26(4): 15-17.
<!--[if !supportLists]-->[19] <!--[endif]-->Mujib A, Jana B K. Clonal propagation ofDendrobium Madame pompadour through apical meristem culture[J]. Current Advances in Plant Science, 1994, 7(2): 340-346.
<!--[if !supportLists]-->[20] <!--[endif]-->Lynge E. Cancer incidence in Danish phenoxy herbicide workers, 1947-1993[J]. Environmental Health Perspectives, 1998, 106(S2): 683-688.
<!--[if !supportLists]-->[21] <!--[endif]-->卢文芸. 环草石斛的快速繁殖及其愈伤组织次生代谢产物积累特征的研究[D]. 贵阳: 贵州师范大学, 2005.
<!--[if !supportLists]-->[22] <!--[endif]-->杜启兰. 植物生长调节物质对石斛兰微体快繁的影响[J]. 特产研究, 2006(3): 44-45, 52.
<!--[if !supportLists]-->[23] <!--[endif]-->石 玮, 罗建平, 黄秀彦. 生长调节物质对霍山石斛试管苗生根的影响[J]. 中草药, 2003(10): 93-96.
<!--[if !supportLists]-->[24] <!--[endif]-->黄肇宇, 蒋 波, 詹源庆, 等. 生长调节物质对金钗石斛器官分化的影响[J]. 玉林师范学院学报, 2005(3): 83- 86.
<!--[if !supportLists]-->[25] <!--[endif]-->Kostenyuk I, Oh B J, So I S. Induction of early flowering inCymbidium niveo-marginatumMakin vitro[J]. Plant Cell Reports, 1999, 19(1): 1-5.
<!--[if !supportLists]-->[26] <!--[endif]-->Duan J X, Yazawa S.In vitroflowering ofDoriella, PhalaenopsisandDendrobium[J]. Proceedings of NIOC, Nagoya, Japan, 1994: 87-96.
<!--[if !supportLists]-->[27] <!--[endif]-->冯 莹. 石斛兰ACS反义基因的遗传转化及离体开花的研究[D]. 福州: 福建农林大学, 2008.
<!--[if !supportLists]-->[28] <!--[endif]-->Sim G E, Goh C J, Loh C S. Induction ofin vitroflowering inDendrobium Madame Thong-In (Orchidaceae) seedlings is associated with increase in endogenous N6- (Δ2-isopen?tenyl)-adenine (iP) and N6-(Δ2-isopentenyl)- adenosine (iPA) levels[J]. Plant Cell Reports, 2008, 27(8): 1281-1289.
<!--[if !supportLists]-->[29] <!--[endif]-->Sim G E, Loh C S, Goh C J. High frequency earlyin vitroflowering ofDendrobiumMadame Thong-In (Orchidaceae)[J]. Plant Cell Reports, 2007, 26(4): 383-393.
<!--[if !supportLists]-->[30] <!--[endif]-->李 璐, 賴钟雄, 翁 浩. 春石斛和铁皮石斛试管苗壮苗生根条件的优化[J]. 福建农林大学学报(自然科学版), 2011, 40(1): 31-36.
<!--[if !supportLists]-->[31] <!--[endif]-->胡琦敏, 李勇毅, 黄云峰, 等. 海伦兜兰的无菌播种与快
速繁殖[J]. 植物生理学报, 2016, 52(9): 1443-1448.
<!--[if !supportLists]-->[32] <!--[endif]-->李霖明, 刘霖贵, 钟云芳. 四种有机添加物对铁皮石斛的组培苗壮苗阶段的生长影响[J]. 热带林业, 2011, 39(2): 38-39, 37.
<!--[if !supportLists]-->[33] <!--[endif]-->郭洪波, 于晓丹, 陈丽静, 等. 铁皮石斛茎节离体培养的研究[J]. 时珍国医国药, 2007(11): 2659-2660.
<!--[if !supportLists]-->[34] <!--[endif]-->Thomas T D. The role of activated charcoal in plant tissue culture[J]. Biotechnology Advances, 2008, 26(6): 618- 631.
<!--[if !supportLists]-->[35] <!--[endif]-->卜学贤, 陈维伦. 活性碳对培养基中植物生长调节物质的吸附作用[J]. 植物生理学报, 1988(4): 401-405, 409.

