盐酸小檗碱对宫颈癌HeLa细胞外泌体的影响及其机制
王 景,葛 静,王 旭,房桂英,代丽丽,刘 晶
(河北医科大学第一医院妇产科,河北 石家庄 050030)
宫颈癌是女性第二大常见恶性肿瘤,发病率仅次于乳腺癌,近年来宫颈癌的发病趋向于年轻化,严重影响女性健康。癌细胞转移和侵袭容易引起机体多器官功能衰竭和血管破裂,发生失血性休克,死亡率极高。宫颈癌的发生发展过程复杂,涉及到体内多种物质和基因的参与,其中外泌体作为一种细胞外囊泡,是微环境中细胞间通讯的重要载体[1-2]。在肿瘤进展过程中,癌细胞通过外泌体与内皮细胞、间质细胞和免疫细胞相互作用,促进肿瘤发生发展[3]。小檗碱又名黄连素,从黄连和黄柏等中草药中提取获得,是一种常见的异喹啉类生物碱,具有抗病原微生物的功效。研究[4-7]显示:盐酸小檗碱可以通过促进肿瘤细胞凋亡、抑制肿瘤细胞增殖、抑制肿瘤细胞转移以及增强肿瘤细胞对化疗药物的敏感性等方式,发挥其对肺癌、胃癌、鼻咽癌和肝癌等不同肿瘤细胞的预防及治疗作用。目前,国内外尚未见盐酸小檗碱在抑制宫颈癌细胞外泌体分泌方面的相关研究报道。本研究主要通过观察盐酸小檗碱对宫颈癌HeLa细胞释放外泌体的干预作用及其对癌细胞增殖和转移能力的影响,初步探讨其作用机制。
1 材料与方法
1.1 细胞、主要试剂和仪器宫颈癌HeLa细胞株购自中国科学院细胞库。盐酸小檗碱片(规格0.1 g/片),华中药业股份有限公司生产,批准文号:国药准字H42021425。蛋白质定量试剂盒和DAB显色试剂盒均购自武汉博士德生物工程有限公司,培养基购自海科伦公司,胎牛血清(fetal bovine serum, FBS)购自加拿大Stemcell公司,噻唑蓝(MTT)细胞增殖和细胞毒性检测试剂盒购自索德国莱宝公司,兔抗人CD63 单克隆抗体、兔抗人CD81单克隆抗体和兔抗人 β-actin单克隆抗体均购自英国Abcam公司,兔抗人磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase, Akt)和磷酸化Akt(p-Akt)单克隆抗体购自美国Cell Signaling Technology公司。Transwell小室购自美国Millipore公司,TGL-16MS型高台式速离心机(上海卢湘仪离心机仪器有限公司),光学显微镜(日本Nikon公司),DYY-12型多功能电泳仪 (北京六一生物科技有限公司)。
1.2 细胞培养将FBS于4℃、100 000 g离心70 min,弃去沉淀,得到无外泌体的FBS。将宫颈癌HeLa细胞培养于含10% FBS的H-DMEM培养基,置于37℃、5% CO2培养箱孵育,待生长至80%融合度时进行传代培养。
1.3 外泌体蛋白提取和定量取对数生长期HeLa细胞,采用含10% FBS的培养液调整细胞浓度至5×107mL-1,分为对照组和低、中、高剂量盐酸小檗碱组,对照组加入完全培养液,低、中和高剂量盐酸小檗碱组分别采用含有10、20和40 mg·L-1盐酸小檗碱的培养液培养24 h,800 r·min-1离心5 min,收集HeLa细胞,用胰酶消化,参照文献[8]采用超速离心法提取外泌体,500 g离心10 min,取上清液,12 000 g离心20 min,经220 nm滤膜过滤,10 000 g超速离心90 min,去上清液,得到沉淀即为外泌体。加入裂解液裂解30 min后,4℃、12 000 g离心20 min,得到上清液为外泌体蛋白,按照Bio-Rad DC蛋白试剂盒说明书检测外泌体蛋白浓度,经SDS-PAGE电泳2 h,转印至PVDF膜,加入5%脱脂牛奶常温封闭1 h,加入兔抗人CD81抗体(1∶1 000稀释)、兔抗人CD63抗体(1 ∶1 000稀释),PBS洗涤,加入二抗,孵育1 h,PBS洗涤,ECL法显色,采用Quanitity One图像分析软件进行灰度分析,以β-actin作为内参,以目的蛋白条带与内参条带的比值作为目的蛋白表达水平。
1.4 MTT 法检测细胞生长抑制率取对数生长期HeLa细胞,胰酶消化,用含有10% FBS的培养基配制成细胞密度为1×105mL-1的单细胞悬液,接种于96孔板中,37℃、5% CO2孵育过夜,贴壁后,弃去培养液,分为对照组和低、中、高剂量盐酸小檗碱组,对照组加入完全培养液,低、中和高剂量盐酸小檗碱组分别加入含有10、20和40 mg·L-1盐酸小檗碱的培养液,每个浓度设6复孔。于37℃、5% CO2培养箱中分别培养12、24和48 h后,弃去培养液,于各孔加入20 μL MTT溶液(5 mg·L-1)培养4 h,弃去上清液,加入150 μL DMSO,置于摇床室温避光振荡10 min,采用酶标仪检测各孔吸光度(A)值,计算细胞生长抑制率。细胞生长抑制率 =(对照组A值-盐酸小檗碱组A值)/对照组A值 × 100%。
1.5 划痕实验检测细胞迁移率取对数生长期HeLa细胞,加入6孔板中,于37℃孵育过夜,用移液枪头垂直划痕。PBS冲洗,去除划下的细胞,低、中和高剂量盐酸小檗碱组分别加入含10、20和40 mg·L-1盐酸小檗碱的无血清培养基,对照组加入不含药物的无血清培养基,于37℃、5% CO2培养箱中培养,于0和24 h时拍照,每孔设3个平行样,计算细胞迁移率,以细胞迁移率代表细胞迁移能力。细胞迁移率 =24 h刮痕宽度/0 h刮痕宽度×100%。
1.6 Transwell小室实验检测穿膜细胞数取对数生长期HeLa细胞,以血清培养基洗涤,调整细胞密度至1×105mL-1,取细胞悬液200 μL加入Transwell上室,低、中和高剂量盐酸小檗碱组下室分别加入含有10、20和40 mg·L-1盐酸小檗碱的FBS完全培养基,对照组加入不含药物FBS完全培养基,每组3复孔。培养24 h,上室内肿瘤细胞向下室聚集。24 h后,取出培养板,用棉签擦去上室内的细胞,下室细胞用甲醇固定,0.1%结晶紫染色,冲洗封片后,显微镜下随机取5个视野对下室细胞进行计数,计为穿膜细胞数,以穿膜细胞数代表细胞侵袭能力。
1.7 Western blotting法检测细胞中PI3K、Akt和p-Akt蛋白表达水平取对数生长期HeLa细胞,采用含10% FBS的培养液调整细胞浓度至5×107mL-1,低、中和高剂量盐酸小檗碱组分别用含有10、20和40 mg·L-1盐酸小檗碱的培养液培养24 h,对照组加入不含药物的培养液,800 r·min-1离心5 min,收集HeLa细胞,加入RIPA细胞裂解液裂解30 min,超声破碎,12 000 r·min-1离心分离后取上清液,BCA法进行总蛋白质定量,上样量为50 μg,120 V电泳分离蛋白,PVDF膜上转膜2 h,5%脱脂奶粉封闭1 h,加入一抗PI3K、Akt和p-Akt(1 ∶1 000),4℃孵育过夜,加入相应辣根过氧化物酶标记的二抗(1∶1 000)37℃孵育2 h,ECL法显色,用Quanitity One图像分析软件进行灰度值分析,以β-actin作为内参,以目的蛋白条带灰度值与内参条带灰度值的比值作为目的蛋白表达水平。
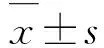
2 结 果
2.1 各组HeLa细胞外泌体中外泌体标志物CD81和CD63蛋白表达水平不同剂量盐酸小檗碱处理HeLa细胞24 h后,与对照组比较,低、中和高剂量盐酸小檗碱组细胞外泌体中CD81和CD63蛋白表达水平明显降低(P< 0.05);与低剂量盐酸小檗碱组比较,中和高剂量盐酸小檗碱组细胞外泌体中CD81和CD63蛋白表达水平明显降低(P< 0.05);与中剂量盐酸小檗碱组比较,高剂量盐酸小檗碱组细胞外泌体中CD81和CD63蛋白表达水平进一步降低(P< 0.05)。各组细胞外泌体中CD81和CD63蛋白表达水平与盐酸小檗碱呈明显的剂量依赖性。见表1和图1。
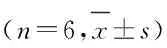
表1 各组HeLa细胞外泌体中CD81和CD63蛋白表达水平
2.2 各组HeLa细胞生长抑制率处理24、48和72 h后,与对照组比较,低、中和高剂量盐酸小檗碱组细胞生长抑制率均明显升高(P< 0.05);与低剂量盐酸小檗碱组比较,中和高剂量盐酸小檗碱组细胞生长抑制率均明显升高(P< 0.05);与中剂量盐酸小檗碱组比较,高剂量盐酸小檗碱组细胞生长抑制率明显升高(P< 0.05)。各组细胞生长抑制率呈明显时间和剂量依赖性。见表2。

Lane 1: Control group; Lane 2-4: Low, medium, and high doses of berberine hydrochloride groups.

表2 作用24、48和72 h后各组细胞生长抑制率
2.3 各组HeLa细胞迁移率与对照组比较,低、中和高剂量盐酸小檗碱组细胞迁移率均明显降低(P< 0.05);与低剂量盐酸小檗碱组比较,中和高剂量盐酸小檗碱组细胞迁移率均明显降低(P< 0.05);与中剂量盐酸小檗碱组比较,高剂量盐酸小檗碱组细胞迁移率明显降低(P< 0.05)。各组细胞迁移率与盐酸小檗碱呈剂量依赖性。见表3和图2。
2.4 各组HeLa细胞的穿膜细胞数与对照组(224±19)比较,低、中和高剂量盐酸小檗碱组穿膜细胞数(157±13、134±12和109±8)均明显降低(P< 0.05);与低剂量盐酸小檗碱组比较,中和高剂量盐酸小檗碱组穿膜细胞数均明显降低(P< 0.05);与中剂量盐酸小檗碱组比较,高剂量盐酸小檗碱组细胞迁移率明显降低(P< 0.05)。各组HeLa细胞中穿膜细胞数与盐酸小檗碱呈剂量依赖性。见图3(插页六)。
2.5 各组HeLa细胞中PI3K、Akt和p-Akt蛋白表达水平不同剂量盐酸小檗碱处理HeLa细胞24 h后,与对照组比较,低、中和高剂量盐酸小檗碱组细胞中PI3K、Akt和p-Akt蛋白表达水平明显降低(P< 0.05);与低剂量盐酸小檗碱组比较,中和高剂量盐酸小檗碱组细胞中PI3K及p-Akt蛋白表达水平明显降低(P< 0.05);与中剂量盐酸小檗碱组比较,高剂量盐酸小檗碱组细胞中PI3K、Akt和p-Akt蛋白表达水平明显降低(P< 0.05)。各组细胞中PI3K、Akt和p-Akt蛋白表达水平与盐酸小檗碱呈剂量依赖性。见表4和图4。
3 讨 论
宫颈癌是女性常见恶性肿瘤,在中国具有高发病率和死亡率[9]。近年来研究[10-11]显示:盐酸小檗碱可抑制肿瘤细胞增殖,如乳腺细胞和宫颈癌细胞等。本研究结果表明:随着盐酸小檗碱剂量的增加,宫颈癌HeLa细胞的生长抑制率明显升高,具有剂量依赖性,说明盐酸小檗碱可明显抑制宫颈癌细胞的增殖和生长,与有关研究[12-13]结果一致。肿瘤的转移和浸润涉及多因素、多步骤和多机制,是目前研究的重点。本研究结果显示:不同剂量盐酸小檗碱干预后,宫颈癌HeLa细胞的迁移、侵袭能力与对照组比较均明显降低,且具有剂量依赖性,与李娜等[14]报道的盐酸小檗碱具有抑制宫颈癌侵袭能力的结果一致。

表3 各组HeLa细胞迁移率

A: Control group; B-D: Low, medium, and high doses of berberine hydrochloride groups.
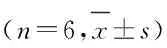
表4 各组HeLa细胞中PI3K、Akt和p-Akt蛋白表达水平
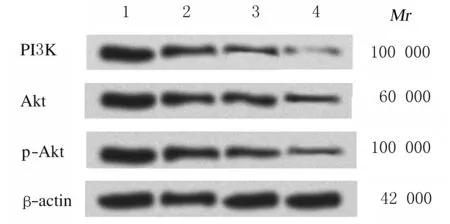
Lane 1: Control group; Lane 2-4: Low, medium, and high doses of berberine hydrochloride groups.
外泌体是近年来热门生物学研究领域之一,其对肿瘤的迁移和侵袭有明显影响[15-16]。研究[17]显示:外泌体中上皮间质转化相关蛋白能够促进癌细胞的迁移能力。本研究采用超速离心法分离宫颈癌HeLa细胞外泌体,Western blotting法检测结果显示:不同剂量盐酸小檗碱组癌细胞外泌体中CD81和CD63蛋白表达水平与对照组比较明显降低,且具有剂量依赖性,说明盐酸小檗碱能够抑制宫颈癌细胞外泌体,从而降低细胞迁移和侵袭能力。
在癌症发生发展过程中,PI3K/p-Akt信号通路被激活。PI3K是异源二聚体蛋白复合物,由PIK3CA基因编码的催化亚基p110α亚单位和由PIK3R1基因编码的调节性p85α亚单位构成[18]。在肿瘤发生时,PI3K介导的信号通路被异常激活,导致Akt依赖的信号传导,导致肿瘤细胞增殖和迁移[19-20]。陈凤霞[21]采用免疫组织法检测患者宫颈癌组织和癌旁组织中PI3K和Akt表达水平,结果显示:肿瘤组织中PI3K和Akt表达水平明显高于癌旁组织。另有研究[22]表明:p-Akt在子宫内膜癌组织中表达率明显升高,并与肿瘤的生长和转移呈正相关关系。PI3K/Akt活性降低则可以降低癌细胞的迁移和侵袭能力。本研究结果表明:宫颈癌HeLa细胞中PI3K和Akt蛋白表达水平增加,说明PI3K和Akt是参与宫颈癌发生发展的信号物质,低、中和高剂量盐酸小檗碱组细胞中PI3K、Akt和p-Akt蛋白表达水平明显降低,说明Akt磷酸化可作为PI3K活性指标,能够反映PI3K信号通路的活性,盐酸小檗碱能够通过下调PI3K/Akt信号通路抑制宫颈癌细胞增殖。
综上所述,盐酸小檗碱能够抑制宫颈癌细胞分泌外泌体,抑制癌细胞增殖,降低癌细胞的迁移和侵袭能力,其作用机制可能与下调PI3K/Akt信号通路有关,但关于PI3K/Akt信号通路下游调控外泌体分泌的分子机制有待进一步研究。

