睾酮人工抗原的合成及酶联免疫方法的建立
高 璐,孙嘉笛,王利平,纪 剑,孙秀兰
(江南大学 食品学院 食品科学与工程国家重点实验室,江苏 无锡 214122)
睾酮(testosterone,T)是哺乳动物体内常见的具有性激素作用的一种类固醇激素,具有提高生殖器官的发育、调节生殖代谢过程的作用[1]。包括睾酮在内的性激素具有较强的蛋白质同化作用,使动物肉质品质得到改善,提高饲料的转化效率和出栏率[2-3],经常被添加在畜禽等饲料中,给商家带来极高的养殖效益。激素滥用导致的动物及人的健康问题越来越严重[4],长期摄入激素会导致人体内分泌紊乱,损害肝、肾等器官,从而大大增加致癌、致畸的风险[5-7]。
针对动物源食品中激素超标的现象,我国已出台了相关的法律法规,如《关于严禁非法使用兽药的通知》《兽用处方药和非处方药管理办法》《中华人民共和国农业部公告第235号》[8-9]和《食品中兽药最大残留限量》[10]等。国际上,欧盟理事会第96/22/EC号指令禁止以促进生长为目的在肉食性动物中添加自然或人工合成的性激素,以确保欧盟内的人类健康保护[11]。如今,国内外社会仍存在非法添加包括睾酮在内的性激素事件,为了确保人类的食品安全和健康,建立相关简便、灵敏的检测技术是当务之急。
目前,睾酮传统的理化检测方法包括液相色谱-质谱(LC-MS)、气相色谱-串联质谱(GC-MS/MS)、毛细管电泳法、荧光光谱分析法和拉曼光谱法等方法[12-14]。其中,LC-MS有较高的分离能力和鉴别能力,电泳法和荧光光谱法所需样品量和试剂消耗量少,拉曼光谱法对样品前处理极为简单[15]。但是上述方法或多或少存在技术缺陷和条件不足,比如耗费较高,实验操作人员需要具有专业的技术,对实验仪器和实验条件的要求高,而且准备工作耗时长等[15]。酶联免疫吸附测定(ELISA)是在免疫酶方法基础上发展起来的一种新型免疫测定手段[16],具有特异性强、灵敏、简便、准确和样品通量高等优点[17]。睾酮是小分子物质,属于半抗原,只有当其与载体蛋白结合后,才能获得其包被原性[18]。梁康建等[19]研制了检测己烯雌酚残留的ELISA试剂盒,历经为期较长的实验,该试剂盒可以用于猪肉、鸡肉、鱼肉及饲料等样品的批量检测,因其目标物为雌激素,无法做到对睾酮的特异性检测,并且国内市面上几乎没有对睾酮残留检测的ELISA试剂盒。
当前,人们对食品安全的呼声越来越高,开发一种用于对食品中残留的睾酮进行高效、便捷检测的技术势在必行。本文中,笔者应用混合酸酐法得到睾酮人工抗原,并进行结构鉴定,同时与睾酮单克隆抗体结合,建立一种睾酮酶联免疫吸附分析试剂盒检测方法。
1 材料与方法
1.1 材料与试剂
睾酮标准品、羧甲基羟胺半盐酸(CMO)、N,N-二甲基甲酰胺、卵清蛋白(OVA)、睾酮单克隆抗体,Sigma公司;氯甲酸异丁酯,Fluka公司;三乙胺,上海化学试剂公司;羊抗兔IgG,北京博奥森有限公司;其他试剂均为市售分析纯。
1.2 仪器与设备
Spectronicl.70型紫外可见分光光度计,意大利GBC公司;NICOLET NEXUS470型傅里叶变换红外光谱仪,美国热电公司;MK3酶标仪,上海智理科学仪器有限公司;微型凝胶电泳仪,美国Bio-Rad公司。
1.3 方法
1.3.1 睾酮肟化及人工抗原的合成
用高浓度反应液一步合成法将睾酮肟化[20]。1 mmol睾酮标准品溶于无水吡啶,加入2 mmol CMO,50 ℃搅拌反应30 min,减压蒸馏去吡啶。残余物用乙酸乙酯溶解,加适量水清洗,取上层油样,加入少量无水硫酸钠干燥,减压蒸馏去乙酸乙酯,残余物用乙醚重结晶捣碎得到肟化后的睾酮半抗原。
采用混合酸酐法[21]将半抗原与OVA偶联,得到睾酮包被抗原。睾酮半抗原用N,N-二甲基甲酰胺搅拌溶解,加入三乙胺,4 ℃下反应1 h,加入氯甲酸异丁酯,继续反应l h,同时将OVA溶于磷酸盐缓冲液中,加入N,N-二甲基甲酰胺,4 ℃下搅拌反应1 h,逐滴滴加上面半抗原反应好的产物,4 ℃条件下反应4 h。先后用磷酸缓冲液和蒸馏水透析2 d,期间多次换液,冷冻干燥即得到偶联蛋白后的睾酮人工抗原(T-OVA)。
1.3.2 人工抗原的鉴定
1)紫外扫描光谱法鉴定。取睾酮、OVA标准品以及制备好的T-OVA,用50%甲醇-水溶液作稀释液,稀释至一定浓度后进行紫外扫描光谱鉴定,用石英比色皿,稀释液作参比溶液,在200~400 nm波长范围内检测其特征吸收峰[22]。
2)红外光谱法鉴定。取睾酮、OVA标准品以及制备好的T-OVA按1∶ 150(质量比)加入干燥的KBr粉末,置于玛瑙研钵中,在红外灯照射下研磨、混匀,装压片模具在 8 000 N压力下加压,制得厚度1 mm的透明KBr样品晶片,上机检测[23]。
3)SDS-PAGE电泳鉴定。取OVA标准品和制备好的T-OVA稀释至一定浓度,根据蛋白电泳预制胶试剂盒说明书进行制胶、上样、电泳、染色、脱色等步骤,观察脱色后凝胶板的长度和每个蛋白质样品移动距离[24]。
1.3.3 间接竞争ELISA标准曲线的建立
用碳酸盐缓冲液稀释制备好的人工抗原,滴加在孔板中,37 ℃孵育2 h后倒去包被液,洗涤液清洗后拍干,封闭液滴加在孔板中,37 ℃孵育2 h后洗涤拍干。按照间接竞争ELISA法,参照文献[25]绘制标准曲线,检测限LOD=3σ/S,其中σ为空白样品标准差,S为斜率。
1.3.4 样品加标回收实验
将样品分别按照0、1、5、10和20 μg/L 5个水平添加睾酮标准品。取2 g组织(猪肉)均匀物,加入6 mL乙腈溶液,充分振荡2 min,在4 500 r/min、15 ℃条件下离心10 min,取上清液4 mL,在56 ℃条件下N2吹至完全干燥。加入2 mL正己烷充分溶解,再加入1 mL去离子水振荡,在4 500 r/min、15 ℃条件下离心5 min后,去上层液相,取下层液相与50%甲醇-PBS溶液以体积比1∶ 1混合,用于分析,每个浓度取4个平行组。
2 结果与讨论
2.1 人工抗原结构鉴定
2.1.1 紫外吸收光谱验证人工抗原
将睾酮、OVA标准品以及制备好的T-OVA稀释至一定浓度后进行紫外扫描光谱鉴定,在200~400 nm波长范围内检测其特征吸收峰,结果如图1所示。由图1可知,睾酮半抗原在255 nm处有典型吸收,OVA标准品在280 nm处有最大吸收峰,而T-OVA 包被原的最大吸收峰则位于220 nm处,这说明睾酮人工抗原偶联物最大吸收峰发生蓝移,并与其前体物质有不同的紫外吸收特征,初步表明偶联成功。

图1 T、OVA和T-OVA的紫外吸收谱图
2.1.2 红外光谱验证人工抗原
对睾酮、OVA标准品以及制备好的T-OVA进行红外光谱分析,结果如图2所示。由图2可知,睾酮标准品在3 300 cm-1处有一个强吸收峰,这是羟基的特征峰,而人工抗原T-OVA无此吸收峰,表明半抗原衍生化成功。同时,OVA标准品和T-OVA免疫原在2 500~3 200 cm-1和1 660~1 500 cm-1的区域内具有相似的吸收峰,这是OVA标准品中氨基酸的特征峰,说明合成的包被原中含有OVA,证明T-OVA中含有睾酮。据此确定T-OVA人工抗原偶联成功。
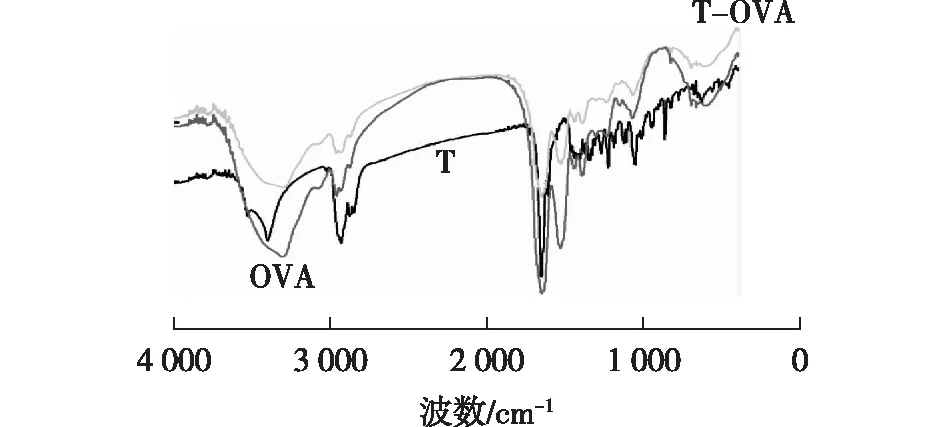
图2 T、OVA和T-OVA的红外谱图
2.1.3 SDS-PAGE电泳验证人工抗原
所得人工抗原SDS-PAGE电泳图如图3所示。由图3可知,OVA标准品的条带相比T-OVA的条带较深且宽,向下移动的距离稍远,表明T-OVA的迁移速率比OVA的迁移速率小,偶联后包被原的分子量比载体OVA的分子量大,证明偶联抗原制备成功。
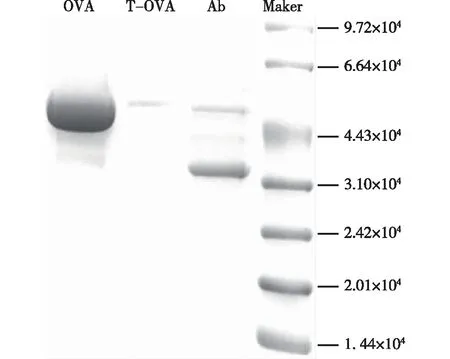
图3 OVA和T-OVA的SDS-PAGE电泳图
2.2 间接竞争ELISA标准曲线
按照间接竞争ELISA法,以睾酮标准品质量浓度为0、1、5、10、20、25 μg/L进行OD值的测定。以睾酮标准溶液的质量浓度对数为横坐标,以抑制率为纵坐标,绘制标准曲线。标准曲线如图4所示,曲线在1~25 μg/L范围内线性关系良好,检测限可达到0.261 7 μg/L,相关系数R=0.995 6。(B为OD值,B0为对照组OD值,下同。)
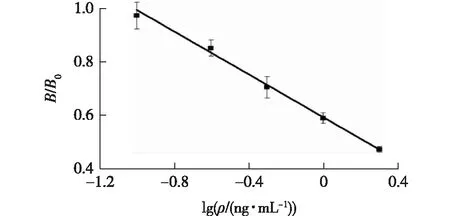
图4 睾酮ELISA检测标准曲线
2.3 睾酮ELISA检测稳定性测试
用碳酸盐缓冲液稀释睾酮包被抗原,滴加在孔板中,37 ℃孵育2 h后倒去包被液,洗涤液清洗后拍干,封闭液滴加在孔板中,37 ℃孵育2 h后洗涤拍干,待孔板晾干后真空包装,于-20 ℃保存。分别于第3天、第7天、第10天、第14天进行ELISA方法检测,结果如图5所示。由图5可知,拟合线性关系几乎重叠,且表1显示5次测定时间所得批间差异(CV)均小于5%。
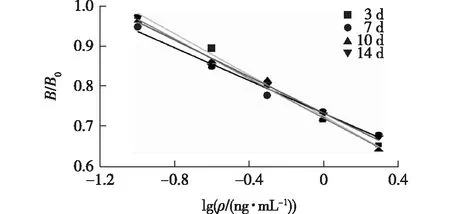
图5 睾酮ELISA检测的稳定性结果
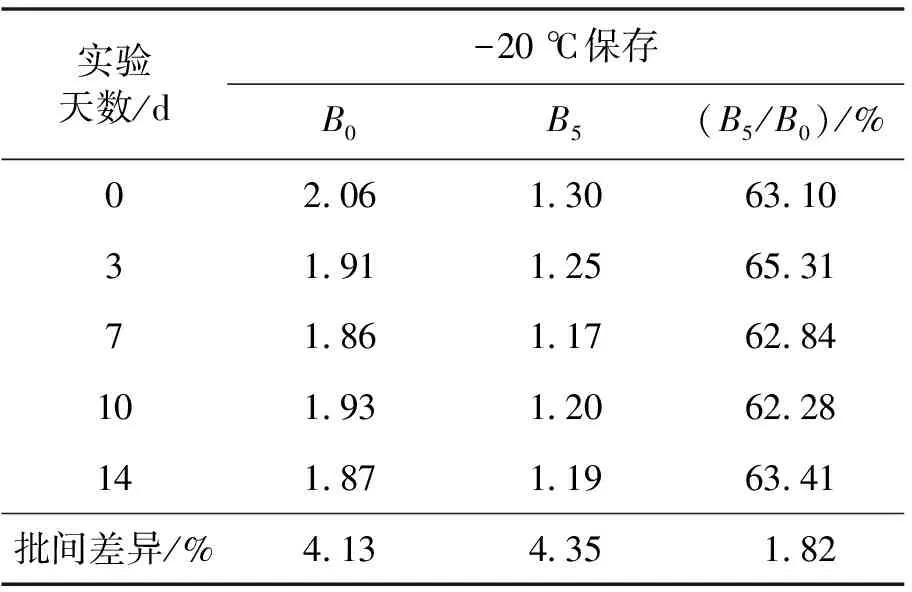
表1 睾酮ELISA检测稳定性结果差异值
2.4 样品加标回收试验
样品分别按照0、1、5、10、20 μg/L 5个水平添加睾酮标准品,结果如表2所示。
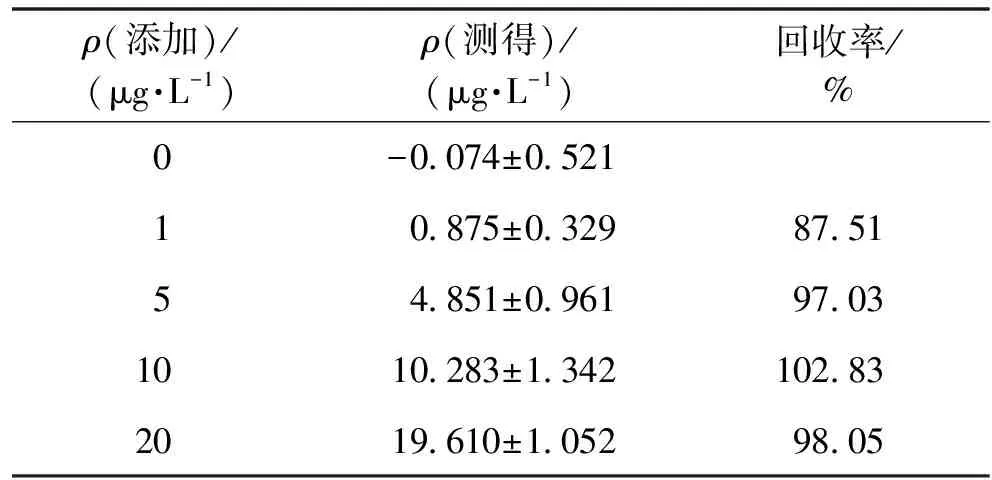
表2 睾酮ELISA检测的样品加标回收结果
由表2可知,基于睾酮激素建立的酶联免疫试剂盒检测法对样本的平均加标回收率为87.51%~102.83%,说明建立的睾酮ELISA检测法具有很高的准确度,可以应用于实际样品中睾酮的检测。
3 结论
采用混合酸酐法合成睾酮人工包被抗原,与睾酮单克隆抗体结合,建立了一种检测灵敏度高、方法简单、高效的酶联免疫检测方法,所得标准曲线在1~25 μg/L范围内线性关系良好,相关系数R=0.995 6,最低检测限可达0.261 7 μg/L。检测方法稳定性测试中,5次测定时间所得批间差异均小于5%,样品加标回收率为87.51%~102.83%,可应用于实际样品中睾酮的检测。本研究为进一步自主开发高效率且应用于市场的睾酮ELISA检测试剂盒奠定基础,同时为保障我国肉制品质量安全提供一种有效的技术手段。

