调衡方对Lewis肺癌荷瘤体巨噬细胞吞噬功能的影响*
张宏方,郑 玉,李文侠,刘 洋,徐洋洋,王媛媛,张怡敏
(陕西中医药大学病原微生物及检验学教研室 咸阳 712046)
理冲汤为近代医学家张锡纯《医学衷中参西录》里的治疗妇人经闭不行,或产后恶露不尽,结为症瘕的经典名方,现代临床多用于对妇科肿瘤、女子不月、盆腔炎等女子常见病症的治疗[1]。我校肿瘤学科组,经多年的实验和临床研究经验积累,以“理冲汤”(来源于《医学衷中参西录》)为基础,化裁出对肿瘤具有抑制其转移、增殖与调节荷瘤体免疫功能的调衡方。调衡方前期研究结果显示[2-9]本方对抑制Lewis 肺癌的转移有一定效果,该方提取的粗多糖可提升体外巨噬细胞的吞噬力及荷瘤体红细胞免疫等功能,但调衡方对荷瘤体内巨噬细胞的作用如何?这方面仍未揭示清楚,本次实验以荷瘤体腹腔巨噬细胞为靶点,从调控巨噬细胞吞噬能力及胞内酸性磷酸酶(acid phosphatase,ACP)活性等途径切入,探讨调衡方抗瘤的巨噬细胞免疫作用及机制。现总结如下文。
1 实验材料
1.1 主要仪器和试剂
本研究的主要仪器包括:宝特Epoch 微孔板酶标仪为美国BioTek公司生产;ImagePro plus 6.0图形分析版软件为MediaCybernetic 公司产品;培养板与细胞培养瓶购自Coming 公司;CKX-41 型倒置显微镜购自Olympus 公司;CO2 培养箱为Napco 公司产品;722E 型分光光度计为上海光谱仪器有限公司产品;电子天平为上海精密仪器公司产品(FA1104N),层流净化工作台为北京市半导体设备厂产品),分析天平(ALC-110型,德国赛多利斯公司);电热恒温水浴锅(DK-98-1型,天津市泰斯特仪器有限公司),离心机(LD4-2A型,北京医用离心机厂)。细胞计数板,上海市求精生化试剂仪器有限公司;PH 值测定仪,上海精宏实验设备有限公司。
本研究的主要试剂包括:贞芪扶正胶囊为甘肃新兰药药业有限公司产品,批号J201510501。IL-1、IL-6、TNF-α试剂盒均购自武汉博士德生物技术有限公司。Lewis 肺癌株,南京凯基生物科技发展有限公司。细 胞 培 养 液RPMI1640(Gibco),β-甘 油 磷 酸 钠(Sigma),胰蛋白酶(华美生物工程公司产品);金黄色葡萄球菌(Staphylococcus aureus)标准菌株ATCC26112(购自北京中国药品生物制品检定所);FBS(fetal bovine serum)胎牛血清(杭州四季青生物工程材料有限公司产品);青霉素与链霉素均为华北制药股份有限公司产品;墨汁为仓南县构思纸塑制品厂生产。
1.2 实验药物
调衡方组方中有生山药30 g,生黄芪30 g,白花舌蛇草30 g,天花粉12 g,西洋参15 g,天门冬、生鸡内金、莪术各10 g,水蛭3 g等,处方中的中药经陕西中医大学附属医院药剂科主任中药师王凡的鉴定,全部符合二零一五版药典质量标准的规定。对上述组方中的药物,依据其性质,按一定的制备工艺,加工为lmL含生药3 g流浸膏,分装灭菌后备用。
1.3 实验动物
C57BL/6 雄性小鼠(购自西安交通大学医学院实验动物中心),二级,体重(20±2)g,6~8 周龄,置本校生物技术与免疫实验中心二级动物实验室饲养。动物合格证号:SCXK(陕)2012-003。
2 实验方法
2.1 分组、造模与给药方法
按体重法将C57BL/6小鼠随机分6组,每组10只,分别为正常组、荷瘤模型组、贞芪胶囊组(阳性组)、调衡方小、中、大剂组。将培养计数为6.5×106个/mL 的Lewis 肺癌接种于小鼠右侧腋窝皮下,每只0.2 mL,复制成模型荷瘤小鼠(正常组除外)。于接种24 h 后灌胃给药,用生理盐水将调衡方每l mL 含生药3 g 浓缩液稀释为大、中、小剂组,且调配为等容积每只鼠0.2 mL 灌胃。依据动物与人体表面积折算公式,经换算贞芪胶囊组(阳性组)用药量为41.5 g/kg,调衡方大、中、小剂量组为50 g/kg、25 g/kg、12.5 g/kg,即每日每只小鼠灌胃生药量阳性组0.83 g,调衡方大、中、小剂组用生药量为1.0 g、0.5 g、0.25 g;荷瘤模型组给予生理盐水等容量灌胃,给药8天。
2.2 小鼠腹腔巨噬细胞的分离培养、菌悬液的制取
依据文献[10]与经验,于用药8 天后,用75%酒精将脱颈处死的C57BL/6小鼠浸泡6 min左右,取出仰卧平放于无菌操作台固定,从小鼠尾部至上腹部剥开小鼠毛皮,腹腔肌肉层露出,将无血清RPMI-1640 培养液5 mL注入小鼠腹腔,静待5 min左右(小鼠腹部轻揉2~3 min)后,用5 mL 无菌针管从腹腔两侧抽取约4.5 mL腹腔液,离心(1200 r·min-1,10 min)洗涤后显微镜下计数,调整细胞至所需浓度(培养液为含双抗及10% 胎牛血清的RPMI-1640),置巨噬细胞于有无菌盖玻片的6 孔板及24 孔板内,放入37℃5% CO2培养箱中,12 h后换液除去未贴壁的少数杂细胞,培养待用。
取菌种金黄色葡萄球菌接种在细菌固体平板培养基上,置37℃温箱18~24 h 后,用接种环获取5个左右菌落,放入无菌生理盐水中混匀,用0.5 麦氏比浊管校正其浊度为1.5 × 108CFU(colony-forming units,CFU)/mL 的菌落形成单位,将此制备活化后的金葡菌的菌悬液贮存于4℃冰箱中备用。
2.3 指标及检测方法
2.3.1 调衡方各干预组、荷瘤模型组与正常组活细胞的形态观察
取调衡方各干预组、荷瘤模型组与正常组腹腔巨噬细胞培养24 h 后,置于倒置显微镜下观察各组巨噬细胞的形态变化特征。
2.3.2 墨汁吞噬试验
各干预组培养48 h 后的巨噬细胞,每孔中加入墨汁(稀释2 倍)20 μL,6 孔板继续放入5%CO2培养箱中培养约4 h 左右,观察(倒置显微镜下)各干预组巨噬细胞吞噬墨汁的状况。当发现各干预组及正常对照组细胞有墨汁颗粒被吞入时,洗涤细胞(用RPMI-1640不含血清的培养液),然后用10%甲醛固定细胞,甘油明胶封片,再用有照相功能的倒置显微镜观察拍照。用ImagePro plus 6.0 图形分析软件计算其阳性表达百分率。
2.3.3 吞噬金葡菌试验
各干预组培养48 h 后的巨噬细胞,每孔中加入金黄色葡萄球菌悬液50 μL,24 孔板继续放入5%CO2培养箱中培养约隔24 h,轻吸各组10 孔中的菌悬液,加入722E 型分光光度计比色皿内,于560 nm 处测定每组的吸光度A值。
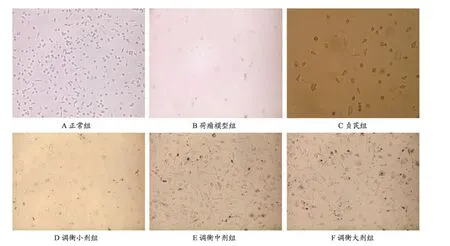
图1 不同各组对巨噬细胞形态的影响(200×)
2.3.4 胞内经ACP染色的Mφ活性观察
各干预组培养48 h 后的巨噬细胞,弃去每孔中的培养液,于4℃冰箱内用10%中性甲醛固定细胞30 min,然后用水洗5 min,再用酸性磷酸酶孵育液(含蒸馏水90 mL,5%醋酸铅4 mL,2%β-甘油磷酸钠4 mL,0.2 mol/L 磷酸缓冲液10 mL)于37℃温育30 min,自来水漂洗,再用1%硫化铵处理4 min 左右,继续用自来水冲洗后,用镊子取出爬有Mφ的盖玻片,明胶甘油封片,再用有照相功能的倒置显微镜观察胞内经ACP 染色的Mφ活性并拍照。用ImagePro plus 6.0 图形分析软件计算其阳性表达百分率。
2.3.5 酶联免疫吸附测定检测巨噬细胞上清中IL-1、IL-6、TNF-α的表达水平
将获取的小鼠腹腔巨噬细胞去杂纯化后,均匀接种到培养孔中,培养48 h,用酶联免疫吸附法(ELISA)检测各培养组Mφ上清中IL-1、IL-6、TNF-α三项指标,在450 nm处使用酶标仪测定其A值。
2.4 统计学方法
数据均以均数±标准差(±s)表示,实验数据是以各实验组与荷瘤模型组进行两组间t检验,各数据均采用SAS 8.2统计软件分析处理。
3 结果
3.1 调衡方干预及荷瘤模型组对巨噬细胞形态的影响
荷瘤对照Mφ组与正常组Mφ形态比较,其在形态上大小、数量有较大的差异,荷瘤对照组巨噬细胞形态瘦小,数量稀少,多为小圆形,表明固有Mφ免疫功能极度低下。正常组的Mφ形态多呈椭圆形、圆形及带尾的三角形,有的巨噬细胞形态带有长的尾巴呈蝌蚪行,一些Mφ有伪足或突起且数量多而饱满;而调衡方干预各组、贞芪胶囊组巨噬细胞的体积较荷瘤模型组的明显增大。见图1A,B,C,D,E,F。
3.2 调衡方干预及荷瘤模型组对巨噬细胞吞噬墨汁的影响
调衡方各组干预后,体外培养巨噬细胞48 h,再加墨汁4 h 左右,荷瘤对照组与正常组巨噬细胞吞噬墨汁相比,荷瘤模型组吞噬墨汁颗粒数量显著降低,差异非常显著(P<0.01),本次实验发现,调衡方大、中剂量组及贞芪组Mφ吞噬的墨汁颗粒数目比之荷瘤组及小剂量组明显增多。而在墨汁吞噬阳性面积的计算中,调衡方大、中剂量组及贞芪组与荷瘤组比较差异有统计学意义(P<0.01)。而小剂量浓度组细胞内的墨汁颗粒与对照组比较增多不明显(P>0.05)。见图2中A,B,C,D,E,F和图3。
表1 调衡方对荷瘤小鼠巨噬细胞中吞噬墨汁、酸性磷酸酶染色及对金葡菌吸光度值的测定结果(±s)

表1 调衡方对荷瘤小鼠巨噬细胞中吞噬墨汁、酸性磷酸酶染色及对金葡菌吸光度值的测定结果(±s)
注:与正常对照组比较,△△P<0.01;与荷瘤对照组比较,※P<0.05;※※P<0.01;NS:0.9%氯化钠;☆:各组动物均为10只。
组别☆正常对照组荷瘤对照组贞芪胶囊组调衡方小剂量组调衡方中剂量组调衡方大剂量组剂量/(g·kg-1)NS NS 41.512.52550吞噬墨汁阳性率/%4.43±0.60※※1.14±0.33△△3.70±0.82※※2.38±1.915.42±1.50※※6.72±1.28※※ACP染色阳性率/%2.19±0.86※※1.02±0.59△△3.67±1.91※※1.54±0.594.66±1.50※※5.18±1.53※※A值/吸光度值0.313±0.038※0.355±0.045△0.286±0.037※※0.341±0.0590.273±0.051※※0.245±0.037※※
3.3 调衡方干预及荷瘤模型组对巨噬细胞吞噬金葡菌的影响
用药各组体外培养巨噬细胞48 h,在金葡菌悬液干预后,荷瘤模型组与正常组比较,吸光度值明显降低(P<0.05),而调衡方干预各组与荷瘤模型组比较,大、中浓度组及贞芪胶囊组巨噬细胞吞噬作用明显,吸光度值明显降低(P<0.01),而调衡方小剂组无明显差异(P>0.05),说明调衡方能增强Mφ对金葡菌的清除力。见表1和图4。

图3 不同各组培养巨噬细胞48 h后的吞噬墨汁状态
3.4 调衡方干预及荷瘤模型组对巨噬细胞酸性磷酸酶的影响
各干预组培养48 h 后的Mφ组与荷瘤模型组比较,发现调衡方各组Mφ内ACP染色的颜色较深,且呈剂量依赖性,剂量越大,染色越深,这说明调衡方对Mφ内ACP 含量有显著提高作用,且在ACP 染色阳性面积的计算中,大、中剂量组与荷瘤组比较差异有统计学意义(P<0.01)。贞芪组不论是镜下观察还是在面积百分比计算中,同样表现出对Mφ强大的激活作用(P<0.01),而调衡方小剂组无明显差异(P>0.05)。见图5中A,B,C,D,E,F和图6。
3.5 调衡方对巨噬细胞分泌IL-1、IL-6、TNF-α的影响
小鼠接种荷瘤后IL-1、IL-6及TNF-α均有不同程度升高(P<0.01),与荷瘤组比较,调衡方大、中剂量以及贞芪组中Mφ上清因子IL-1、IL-6 以及TNF-α含量显著下降(P<0.05;P<0.01),但小剂量组无明显变化。调衡方剂量的大小与IL-1、IL-6以及TNF-α的含量呈负相关,说明调衡方能够通过降低Mφ分泌上清因子如IL-1、IL-6、TNF-α等炎症细胞因子来减少肿瘤的浸润,从而减缓肿瘤的发展。见表2、图7。

图4 各组巨噬细胞吞噬金黄色葡萄球菌的吸光度A值状况
4 讨论

图7 各组上清液中IL-1、IL-6、TNF-α浓度(与荷瘤对照组比)
肺癌位于恶性肿瘤中发病率和死亡率的前列,其生存率不足20%,且没有明显的提升迹象,男性恶性肿瘤中肺癌居首位,而女性仅排其后[11-12]。现代医学多以手术与化疗来治疗该病,其短期疗效明确而肯定,但长期疗效因免疫受损低下而致癌细胞转移与化疗毒副作用的制约而不容乐观。肺癌属于“肺积”“癌病”“积聚”等范畴,其病机是气、血、痰、瘀、毒凝滞而成。调衡方具有益气生血养阴、清热解毒、活血祛瘀之功效。前期研究结果显示[2-9]本方可抑制Lewis 肺癌的转移,可提升机体免疫等功能,本研究以荷瘤体腹腔Mφ为作用点,从调控Mφ吞噬能力及胞内ACP 的活性等的途径切入,探讨了调衡方对荷瘤鼠的巨噬细胞免疫作用的影响。
表2 各组上清液中IL-1、IL-6、TNF-α的含量(单位pg/mL,±s)

表2 各组上清液中IL-1、IL-6、TNF-α的含量(单位pg/mL,±s)
注:与正常对照组比较,△△P<0.01;与荷瘤对照组比较,※P<0.05;※※P<0.01;NS:0.9%氯化钠;☆:各组动物均为10只。
组别☆正常对照组荷瘤对照组贞芪胶囊组调衡方小剂量组调衡方中剂量组调衡方大剂量组剂量/(g·kg-1)NS NS 41.512.52550 IL-113.9±4.2534.75±1.65△△20.16±3.55※※32.79±2.5026.19±3.09※19.53±4.67※※IL-664.4±7.98117.9±17.36△△71.86±7.87※※107.07±14.7691.44±10.26※67.16±8.28※※TNF-α 72.36±8.89101.62±3.83△△81.57±6.89※※98.15±5.8286.13±6.69※79.19±9.42※※
现代研究表明,长期机体免疫抑制或低下,发生肿瘤的概率将高,同时,肿瘤增殖期间患者的免疫功能被抑制,二者也互为因果[13]。针对肿瘤免疫力低下病变的预防治疗,中医药已有数千年的理论及临床应用经验,中医的“益气”可直接扶助正气;“解毒”能减少邪气对正气的耗伤;“活血化瘀”能够祛除局部瘀血阻滞,消除积聚或癥瘕,恢复病灶的血液循环,使瘀血去,新血生,化生正气。则“益气解毒化瘀”能增加机体的“正气”,而“正气”盛,则机体的“免疫力”强。因此,采用益气生血养阴、清热解毒、活血祛瘀之功效的调衡经验方,可用于治疗转移性肺癌。况大量研究表明,“益气生血、化瘀解毒”复方中药可通过多方面调节机体免疫功能,从而达到抑制肿瘤的作用[14-18]。本研究发现,调衡方大、中各组对Mφ吞噬墨汁力明显增强,对金黄色葡萄球菌菌悬液的廓清吞噬力明显提升,与荷瘤对照组比较有显著统计学差异;与荷瘤对照组比较,调衡方各组干预后的ACP 活性含量均表现出不同程度的提升,随着剂量增大,Mφ胞内ACP 活性增加明显。
巨噬细胞主要参与体内固有免疫应答,也作为重要的抗原提呈细胞而参与适应性免疫应答,其表面有多种受体,如Toll 样受体(Toll like receptor,TLR)与脂多糖(lipoplysaccharide,LPS)受体等,其胞内有多种酶,巨噬细胞两个最大的特征就是强大的吞噬外来异物(如吞噬墨汁、鸡红细胞)与ACP 酶活性高。当外来异物与巨噬细胞表面的受体结合后,其便被激活,这时其体积增大,吞噬活力巨增,胞内多种酶活性显著增强,尤其是ACP 升高是巨噬细胞被激活的标志之一[19-20],同时,Mφ廓清异物的功能增强,Mφ清除胞内物主要靠其吞噬溶酶体消化处理,强大的吞噬溶酶体除了清除异物外,还可以将异物的特异性抗原肽提呈给T 淋巴细胞,即Mφ不仅参与固有免疫应答,还参与适应性免疫应答。本次实验结果显示,调衡方能够增强Mφ吞噬及廓清能力,激活ACP 酶活性,刺激Mφ成熟活化,而发挥抗肿瘤的作用。
炎性因子TNF-α,IL-1 及IL-6 为Mφ所分泌,Mφ对肿瘤的发生发展有着不可忽略的正/负调节,已有研究证实IL-1、IL-6、TNF-α在癌症的发生发展中扮演着“双刃剑”的角色[21-25]。肿瘤生长的早期阶段,Mφ的免疫吞噬作用及抗原呈递作用表现为高水平的Mφ浸润可以抑制肿瘤生长,而在低浓度下支持肿瘤生长[26-27]。在炎性过程中Mφ所分泌的TNF-α,IL-1 及IL-6 炎性因子起到关键作用。本实验结果表明,调衡方能够抑制Mφ分泌炎性因子IL-1、IL-6、TNF-α,从而降低肿瘤浸润,延缓肿瘤转移及发展。
综上所述,可推测调衡方对Lewis 肺癌荷瘤体的治疗,可能与其降低炎症细胞因子,提升巨噬细胞吞噬廓清力及胞内ACP 酶活性增高有关。而IL-1、IL-6、TNF-α又是调控巨噬细胞分型的重要细胞因子。这为本课题组后续探讨调衡方是否重塑Mφ以M1 增多为主,指明了研究方向。

