沉默钙敏感受体对大鼠尿钙排泄影响及对紧密连接蛋白14的作用
崔庆鹏 刘孝东 范世成 朱元全 罗云 罗钰辉
1云南省第三人民医院泌尿外科(昆明650000);2昆明医科大学第一附属医院泌尿外科(昆明650032)
泌尿系结石又称为尿石症,是一种古老的疾病。在不同的国家,不同的地区发病率不一,在欧美国家,其发病率为2%~19%[1];在我则为为1%~5%,而我国云南及其他西南地区发病率更高达5%~10%[2]。泌尿系结石的病因复杂,多种因素与泌尿系结石的形成相关,代谢异常被认为是最重要的因素之一[2]。目前普遍认为代谢异常是泌尿系原发结石最主要的病因。而在含钙泌尿系结石患者中,特发性高钙尿症是最常见的[3]。钙敏感受体(calcium-sensing receptor,CaR/CaSR)被认为在特发性高钙尿症的形成中扮演了重要角色。表达于肾脏的紧密连接蛋白14(the tight junction protein claudin-14,CLDN14),在尿Ca2+的排泄中具有重要意义,而CLDN14 受到CaSR 的调节,激活的CaSR 上调CLDN14 的表达,导致尿钙增加,形成含钙泌尿系结石[4]。但目前关于CaSR 在特发性高钙尿症中的作用机制并不完全清楚。我们通过建立遗传高钙尿结石形成大鼠(genetic hypercalciuric stones forming rats,GHS)模型,对大鼠进行CaSRmiRNA 慢病毒干扰,通过检测CLDN14 的mRNA 和蛋白表达水平以及24 h 尿钙的排泄量,来研究CaSR 与特发性高钙尿症的关系,为泌尿系结石的药物预防及治疗提供新靶点。
1 材料与方法
1.1 材料雄性并且性成熟的健康SD大鼠;shRNA载体;Lipofectamine2000、脂质体转染试剂盒、T4DNA 连接酶、PCR 产物纯化试剂盒、胶回收试剂盒购、限制性内切酶XholⅠ、BglⅡ、HindⅢ、NRK-52E 细胞、兔抗大鼠CaSR 多克隆抗体、慢病毒、质粒DNA 小量试剂盒、RNA 提取试剂、RNase-free DNaseⅠ试剂盒、RIPA 细胞总蛋白提取液、大肠杆菌菌株DH5α、Trizol PCR 试剂盒、ECL 试剂盒、第1链cDNA 合成试剂盒。
1.2 方法
1.2.1 GHS 大鼠模型的建立通过选择尿钙最高的近亲雌雄大鼠反复传代[5],培育出了GHS 大鼠模型。一般认为大鼠尿钙值>1.5 mg/24 h,高于对照组大鼠尿钙排泄平均值两个标准差为大鼠高尿钙的标准。
1.2.2 CaSR-miRNA 慢病毒载体的制备本实验组前期已完成,参见参考文献[6]。
1.2.3 动物分组及体及病毒体内干扰实验雄性GHS大鼠和雄性正常尿钙对照组大鼠(Normal control rats,NC)各20只,体质量250~300 g,鼠龄2~3 个月,随机分为5 组,每组4 只,第1~4 组采用干扰病毒进行体内干扰作为实验组,第5 组采用等量0.9%氯化钠溶液干预作为对照组。慢病毒载体通过外科手术从大鼠肾静脉注入肾脏内。在注射病毒后3、7、14、21 d 分别处死实验组大鼠,取双肾;留作PCR 及WB 标本。于病毒干扰后21 d 时处死对照组大鼠并留取标本。应用全自动生化分析仪在处死大鼠前测定各组大鼠的2 个24 h 尿钙排泄浓度,并计算24 h 的尿钙排泄量。
1.2.4 全自动生化分析仪检测尿钙浓度
1.2.5 实时荧光定量聚合酶链反应各组肾脏组织样本按照Trizol 试剂盒说明书提取总RNA,反应液的配制:2×Premix SYBR Green Ⅰ10 μL,cDNA 2 μL,ddH2O 7.2 μL,10 μmol/μL 的上、下游引物各0.4 μL,共40 个循环(以上操作在冰上进行)。结果以GAPDH 的Ct 值作内参,使用2-ΔΔCt法进行样本分析。PCR 引物如下所示(表1)。

表1 PCR 引物表格Tab.1 PCR primer table
1.2.6 Western 印迹提取细胞总蛋白,进行SDSPAGE 电泳,后行PVDF 转膜,转膜后用5%脱脂牛奶室温封闭1 h。在室温下用TBST 溶液洗脱适量一抗三次,每次10 min。室温孵育按1∶3 000 稀释的二抗30 min,并用TBST 洗脱三次,每次10 min。最后进行化学发光检测,目标带的光密度值采用imageJ 软件进行。
1.3 统计学方法统计分析采用GraphPad Prism6.0进行。多组计量资料采用完全随机设计的方差分析进行,两组间计量资料采用t检验进行。P<0.05为差异有统计学意义。
2 结果
2.1 GHS大鼠模型的成功建立通过选择尿钙最高的近亲雌雄大鼠反复传代的方法在第六代时成功建立了CHS大鼠模型。第6代GHS大鼠组中88.2%(15/17)的雄性大鼠和94.1%(16/17)的雌性大鼠尿钙高于1.5 mg/24 h。其24 h尿钙排泄量见表2。
表2 各组大鼠的尿钙排泄量Tab.2 Urinary calcium excretion of rats in each group ±s
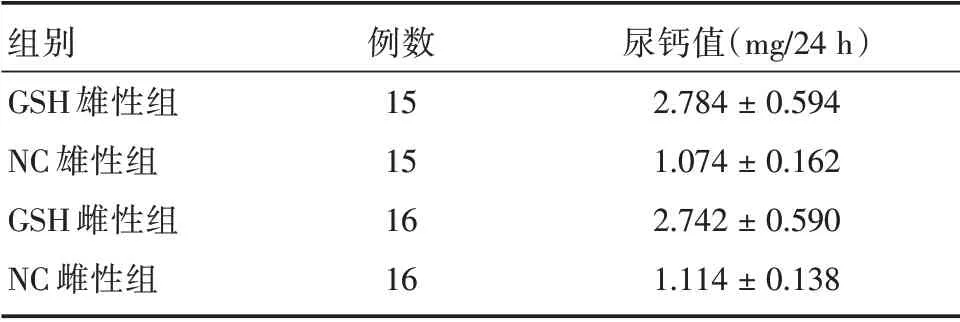
表2 各组大鼠的尿钙排泄量Tab.2 Urinary calcium excretion of rats in each group ±s
注:F 组间=77.245,P 组间<0.001;PGHS1 与NC1<0.001;PGHS1 与NC2<0.001;PGHS1与GHS2=0.789;PNC1与GHS2<0.001;PNC1与NC2=0.799;PGHS2与NC2<0.001
组别GSH 雄性组NC 雄性组GSH 雌性组NC 雌性组例数15 15 16 16尿钙值(mg/24 h)2.784±0.594 1.074±0.162 2.742±0.590 1.114±0.138
2.2 肾脏组织CaSR-miRNA 慢病毒干扰后对大鼠尿钙排泄的影响慢病毒干扰后,与对照组相比:GHS 实验组大鼠尿钙排泄量下降(图1);NC 实验组大鼠尿钙排泄量稍有减少,但对比NC 对照组大鼠无明显变化(图2)。
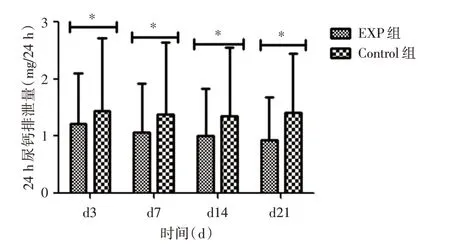
图1 GHS 实验组大鼠尿钙比较图Fig.1 Comparison of urinary calcium in rats in GHS group
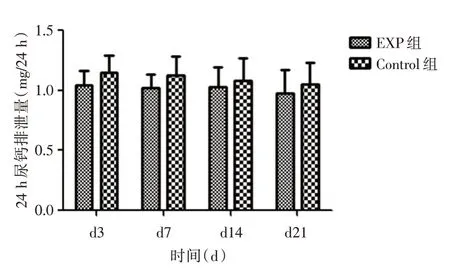
图2 NC 实验组大鼠尿钙比较图Fig.2 Comparison of urinary calcium in the NC experimental group
2.3 Real-timePCR 检测GHS 组和NC 组大鼠CLDN14 不同时段mRNA 表达水平慢病毒干扰后,CHS 组CLDN14 mRNA 表达水平下降,较对照组差异有统计学意义(P<0.05);与对照组相比,NC 组CLDN14 mRNA 表达水平较变化不明显,差异无统计学意义(P>0.05)(图3)。
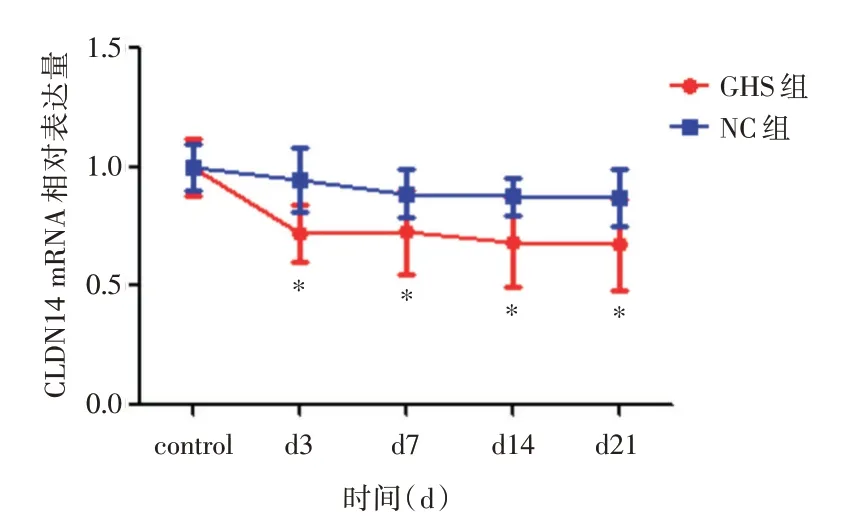
图3 干扰后GHS 组与NC 组大鼠CLDN14 基因的mRNA表达水平图Fig.3 mRNA expression levels of CLDN14 gene in GHS group and NC group after interference
2.4 Western blot检测CLDN14的蛋白表达GHS组与NC组上CLDN14 蛋白质表达图(以β-actin 为内参,以各条带control 组为校准)见图4、5。其灰度值统计图见图6。
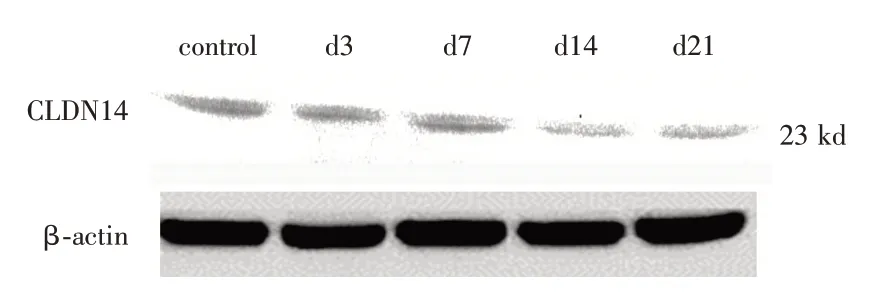
图4 GHS 组大鼠钙CLDN14 的蛋白表达检测结果Fig.4 Detection results of calcium CLDN14 protein expression in rats in GHS group
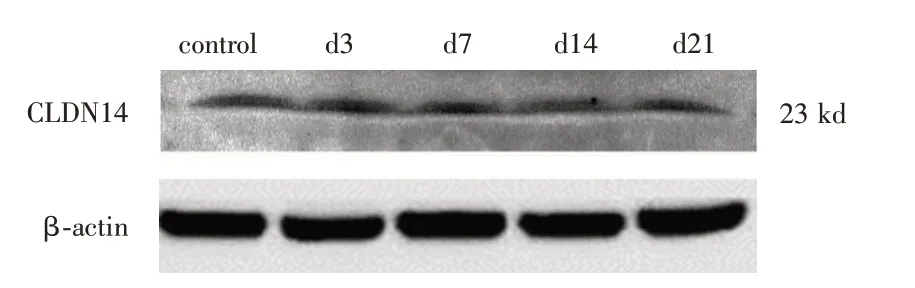
图5 NC 组大鼠钙CLDN14 的蛋白表达检测结果Fig.5 Detection results of calcium CLDN14 protein expression in NC group
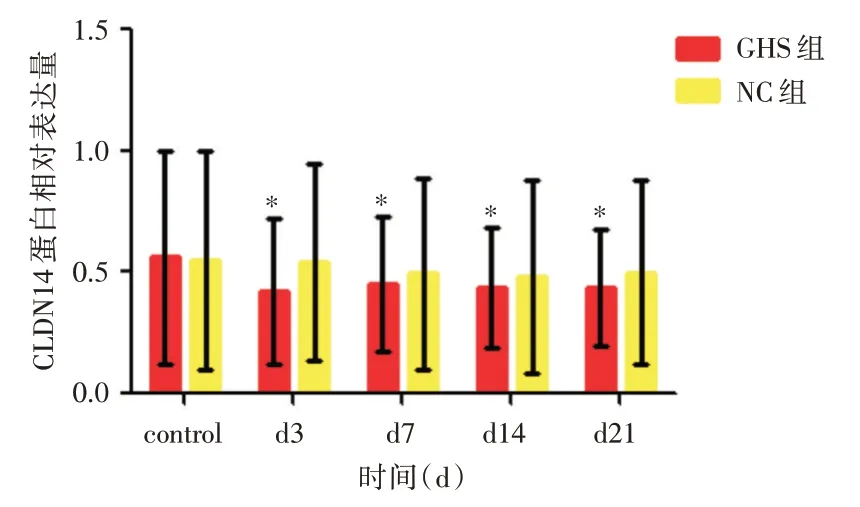
图6 干扰后GHS 组与NC 组大鼠CLDN14 蛋白的表达水平变化图Fig.6 Changes in the expression levels of CLDN14 protein in GHS group and NC group after interference
3 讨论
GHS 大鼠动物模型是由BUSHINSKY 等学者于20世纪首先培育出的,该动物模型自被培育出以后就引起了人们足够的重视。笔者按照前人的方法,成功建立了GHS大鼠模型。通常认为大鼠尿钙值>1.5 mg/24 h,高于对照组大鼠尿钙排泄平均值两个标准差为大鼠高尿钙的标准。在第六代模型鼠中,17只雄性大鼠中15只达到高尿钙标准,其24 h 尿钙分别为(2.78±0.59)mg/24 h;17 只雌性大鼠中16 只达到高尿钙标准,(2.74±0.59)mg/24 h。而正常尿钙对照组大鼠雄性及雌性大鼠的24 h尿钙排泄量分别为(1.07±0.16)mg/24 h 和(1.11±0.14)mg/24 h,因此本研究成功的建立了GHS 大鼠动物模型。
1933年BROWN等[7]第一次在牛甲状旁腺细胞中发现了CaSR,人们就对这对其产生了足够的兴趣,进行了一系列的研究。LIU 等[8]研究表明CaSR基因位于人类3号染色体上,由7个外显子,两个启动子组成,共1 078 个氨基酸残基,是G 蛋白偶联受体家族的一员。维生素D3 可通过调控其两个启动子来促进其表达。CaSR 的拓扑结构由TENNAKOON 等[9]阐明,一是胞膜外亲水性的胞外区氨基结构域(extracellular N terminal domain,ECD),作用是与相关配体结合;二是胞膜上跨膜区域(transmembrane domain,TMD)是G蛋白偶联受体家族的特征性结构,是细胞间的信号转导的关键位置;最后是胞内羧基结构域(intercellular domain,ICD),是蛋白激酶磷酸化的区域。3 个区域构成典型的G 蛋白偶联受体通道,在细胞间的信号转导方面起到了重要作用。母目前的研究发现CaSR 不仅表达于甲状旁腺,还广泛表达于肾脏、骨、胃肠道等组织,可感染细胞外的Ca2+变化,在体内钙稳态的调节方面起到了十分重要的作用[10-11]。
笔者通过对GHS组大鼠及NC组大鼠进行CaSRmiRNA 慢病毒体内干扰实验后发现:与对照组相比,GHS 组大鼠的尿钙排泄量在干扰后的第3~21天下降明显,而在NC 组大鼠中却未发现尿钙排泄量有下降。这一现象说明了GHS 大鼠可能高表达CaSR,而过高表达的CaSR 可能引起大鼠发生高钙尿症。王少刚[12]、李朋[13]等的研究团队也成功培育GHS 大鼠模型,他们的研究均表明CaSR 在GHS鼠肾脏高表达,在NC 组大鼠肾脏低表达。因此NC 组大鼠慢病毒干扰后尿钙排泄值变化不大,这是由于NC 组大鼠低表达CaSR,CaSR-miRNA 慢病毒体内干扰后没有产生足够的CaSR 基因沉默,不足以引起NC 组大鼠24 h 尿钙排泄值产生变化。
目前,研究[12-13]还表明GHS大鼠肾脏组织CaSR的表达过高可能与大鼠的高钙尿症相关。本实验进一步表明,CaSR 可能通过调节肾小管CLDN14的表达来调节肾脏对尿钙的重吸收。
CLDN14 广泛表达于髓袢升支粗段(thick ascending limb,TAL)中,对尿钙在TAL 中的重吸收起到了十分重要的作用[14]。CLDN14 是一种膜蛋白,在上皮细胞紧密连接处细胞旁离子和小的溶质的通透性方面有重要作用[15]。DIMKE 等[16]研究发现:在通常情况下,肾脏组织中CLDN14 基因是低表达的。此时细胞旁离子和小溶质有较强的通过性。而当CaSR 被激活后,肾脏CLDN14 基因表达增强,降低了此种通过性。他的实验还说明高Ca2+饮食会增加肾脏CLDN14 表达,低Ca2+或正常饮食时,肾脏CLDN14 表达不变,这表明Ca2+可能是CLDN14 表达的激活物。使用西那卡塞(一种拟钙剂),可以增加CaSR对Ca2+的敏感性,促使CLDN14表达量提高了40 倍。过度表达的CLDN14 会增加细胞间抵抗性,使细胞间的连接更加密集,降低了细胞旁Ca2+的通过量。以上研究结果说明了过多的游离Ca2+通过激活CaSR 正向调节CLDN14 的表达,进而导致尿液中Ca2+的重吸收减少,导致了原发性泌尿系结石的产生。CaSR 对CLDN14 的调控过程可能是通过CLDN14表达miRNAs而受到CaSR的调控[17-18]。在小鼠中,激活的CaSR通过活化T细胞 的 核 因 子(nuclear factor of activated T cells,NFAT)介导的抑制微小RNA(miR9 和miR374)的组蛋白脱乙酰化表达机制来调控CLDN14 的转录[17-20]。本研究表明与对照组相比,病毒体内干扰后,GHS 组大鼠CLDN14mRNA 和蛋白表达量减少,NC 组大鼠CLDN14mRNA 和蛋白表达量则无明显变化。说明在GHS 大鼠组中高表达的CaSR 正向调控了CLDN14 基因的表达,这一调控机制在NC组中则不明显。
综上所述,CaSR 对尿钙重吸收的影响可能是通过对钙转运相关蛋白CLDN14 的调控来实现的。CaSR 的过度激活可能导致高钙尿症的发生,尿中过多的Ca2+沉积导致了原发性含钙尿结石的产生。CaSR 可能成为泌尿系结石预防与治疗的一个药物靶点。但本实验未敲除CLDN14 基因,尚不能完全证明上述结论,在接下来的研究中,笔者将敲除CLDN14 基因,控制特异性。同时,我们将增强CaSR 的表达,探究在CaSR 激活后,大鼠肾脏CLDN14 mRNA 及蛋白表达情况及尿钙排泄情况,来进一步研究CaSR 在高钙尿症及泌尿系结石中的作用机制。

