结合计算机仿真与实验的响应面法优化抗耐药结核菌药物利奈唑胺脂质体的处方组成及释药特性研究
杨红月 黄伟


摘 要: 利用乙醇注入法制备抗结核药利奈唑胺的脂质体,并通过响应面法分析得到最佳制备工艺和最优处方。乙醇注入法制备所得的利奈唑胺脂质体,包封率较高,其最佳工艺为胆固醇与卵磷脂的质量比1∶3类脂注入缓冲液的速度1.2 ml/min、超声时间3 min;包封率82.36%,RSD=1.32%。乙醇注入法制备利奈唑胺脂质体具有较高的包封率以及缓控效果,Box-Behnken 响应面法可以快速全面的选取最佳制备工艺,方便准确。
关键词: 抗结核;利奈唑胺脂质体;乙醇注入法;响应面法;包封率
中图分类号: TP311.52 文献标识码: A DOI:10.3969/j.issn.1003-6970.2020.06.040
本文著录格式:杨红月,黄伟. 结合计算机仿真与实验的响应面法优化抗耐药结核菌药物利奈唑胺脂质体的处方组成及释药特性研究[J]. 软件,2020,41(06):196203
【Abstract】: The liposomes of the antituberculous drug linezolid were prepared by ethanol injection, and the best preparation technology and prescription were obtained by response surface analysis. The results showed that the entrapment efficiency of linazolamide liposomes prepared by ethanol injection method was high. The best technology was: the mass ratio of cholesterol to lecithin: the speed of 1:3 lipid injection buffer was 1.2 ml/min, the ultrasound time was 3min; the entrapment efficiency was 82.36%, RSD = 1.32%. The preparation of linezolid liposomes by ethanol injection has high encapsulation efficiency and slow control effect. Box Behnken response surface method can quickly and comprehensively select the best preparation process, convenient and accurate.
【Key words】: Linezolid liposomes; Membrane dispersion method; The encapsulation rate; In vitro release; Response surface methodology
0 引言
結核病是一种慢性的由结核分枝杆菌感染引起的传染病,结核分枝杆菌可导致全身器官感染患病,但主要为肺内、外结核,由于结核杆菌寄生于肺泡深处,导致很多情况下用药效果不好,不能彻底杀灭结核杆菌。近年来,利奈唑胺(linezolid)因其较好的抗菌活性和特有的作用机制而备受关注,利奈唑胺具有良好的抗结核分枝杆菌(MTB)的效果,并且对耐药菌株也显示出了很强的抗菌活性。目前利奈唑胺剂型多为口服片剂,虽然其具有许多优势,但其毒副作用也不容小觑,利奈唑胺有较多的轻度不良反应包括胃肠道反应(腹痛、呕吐等)、头痛和皮疹等,高发病率的的严重不良反应为血小板减少症等骨髓抑制反应、神经系统的不良反应、心律失常和乳酸中毒症。脂质体是抗结核药物的理想载体,可降低包封药物的毒性,实现病灶部位直接给药,而且脂质体的结构与细胞相似,二者之间具有相似相溶性可有效实现药物传递,利奈唑胺为时间依赖性药物与脂质体的缓释作用相辅相成。因此将利奈唑胺制备成脂质体直接肺部给药可使药物直接作用于病变部位,减少原料药在体内其他组织的循环吸收,从而达到增加靶区血药浓度,减少给药剂量的目的。二者的融合将为结核患者带来福音。本实验采用溶剂注入法将利奈唑胺制备成载药脂质体,并考察其最佳制备工艺和处方组成,为其进行肺部雾化吸入直接给药研究奠定基础[1-6]。
1 仪器和材料
紫外分光光度计(UV-6000PC)郑州宝京科技有限公司;台式离心机(TG16-GWZ)成都乔越仪器有限公司;复合转子离心机(Mnty-7KS)北京佑宁仪器有限公司; 旋转蒸发仪(QA-205B)济宁瑞德仪器设备有限公司;医用无菌注射器(7号)苏州治宇医疗器材有限公司 ;循环水式多功能真空泵LY-E(II)郑州紫拓工贸有限公司 ;数显恒温水浴锅(JHH-4A)无锡马瑞科技有限公司; 数控探头超声(SCQ-5211B)常州市超声仪器有限公司;电子分析天平AUX200SHIMADZU CORPORATION JAPAN;磁力搅拌加热板(MSH-R-B)上海越众仪器有限公司;LS13320型激光粒度分析仪(江苏 荣华仪器制造有限公司);倒置荧光显微镜(U-LH100HG)OLYMPUS CORPORATION;恒温水浴磁力搅拌器(SHJ-D60)无锡沃鑫仪器制造有限公司。
利奈唑胺(P09572)上海泰坦科技有限公司;磷酸二氢钠(20170319)南通煜天化学品有限公司;甲醇(20181006)哈尔滨鑫达化工厂;卵磷脂(20180122)陕西澄明科技有限公司胆固醇(20180228)江苏百得科技有限公司;二氯甲烷(20180315)济南奥康化工股份有限公司;吐温80(20180605)昆明远联化工有限公司;磷脂膜荧光剂(20190310)SIGMAALDRICH;95%乙醇(20180121)哈尔滨鑫达化工厂。
2 方法
2.1 处方前研究
2.1.1 利奈唑胺原料药理化性质的考察
理化性质:别名Renazzoli,白色或灰白色粉末,化學式为C16H20FN3O4,分子质量为337.3461,熔点176-178℃,取过量利奈唑胺于10 ml试管中各加入6 ml乙醇、PH为6.7的PBS缓冲液、生理盐水测定利奈唑胺在不同溶剂中溶解度,DMSO:>20 mg/ml[7-8]。
2.1.2 最大吸收波长的确定
称取定量磷酸二氢钠用蒸馏水稀释,用PH试纸测pH值。配制pH=6.7的磷酸盐缓冲液(PBS)。
称取25 mlpH为6.7的磷酸盐缓冲液备用,精密称取利奈唑胺0.5 mg溶解于缓冲液中,得到浓度为20 ?g/ml的利奈唑胺溶液,在处于200-400 nm的波长范围内用紫外分光光度计每相隔10 nm测定吸光度,进行曲线绘制,探索最大吸收波长。
精密称取卵磷脂和胆固醇适量制备空白脂质体,于25 ml容量瓶中,用pH为6.7的PBS定容至25 ml,在处于200-400 nm的波长范围内用紫外分光光度计每相隔10 nm测定吸光度,绘制曲线,探索最大吸收波长。
2.2 方法学考察
2.2.1 标准曲线的绘制及线性回归分析
称取1mg利奈唑胺,用pH为6.7的PBS溶液充分溶解移至容量瓶中定容至25 ml,得到浓度为40 ?g/ml的备用液。精密移取标准品溶液0.12、0.24、0.48、0.96、1.46、1.96、2.46、2.96 ml于25 ml容量瓶中,对应浓度为1、2、4、8、12、16、20、24 ?g/ml用pH为6.7的缓冲溶液定容至25 mL充分振荡得到标准液。以pH为6.7的PBS溶液为空白对照,在最大吸收波长处测定吸光度。以利奈唑胺浓度C(?g/ml)为横坐标,吸光度A为纵坐标建立标准曲线并进行线性分析。
2.2.2 精密度试验
分别取低、中、高(2、12、24 ?g/ml)三种浓度的线性范围内利奈唑胺PBS标准溶液,室温放置,采用紫外分光光度计测定,一天内测定5次,求算日内精密度,每天测定1次,连续采集5天数据,求算每天之间的精密度。
2.2.3 回收率试验
按处方的比例精密称取脂质体适量于三支容量瓶中,分别加入浓度为2、12、24的利奈唑胺原料药,加入甲醇溶解定容后,摇匀,在最大吸收波长处测定吸收度。计算平均回收率和RSD。
2.2.4 稳定性试验
取适量利奈唑胺原料药溶液(浓度12 ?g/ml),室温下放置0、1、2、4、6、12 h于最大吸收波长处用紫外分光光度计测定吸光度和RSD。
2.2.5 利奈唑胺脂质体包封率测定方法的确立
脂质体包封率为被包封在脂质体囊中的药量占脂质体混悬液中总体药量的比例,是本文中评价脂质体的重要指标。本实验采用的分离游离药物和载药脂质体的方法为离心法。
包封率测定方法:取两支相同型号离心管,精密量取等质量的利奈唑胺脂质体,室温下于2600 r/min离心机下离心30 min,取上清液0.2 ml至25 ml容量瓶中,用pH为6.7的缓冲溶液定容,在最大吸收波长处测定吸光度,代入回归方程即得C上清;再取两支同型号试管量取等质量上述同一批的利奈唑胺脂质体,分别加3ml甲醇实现破乳的目的,充分振荡后转到离心管中,之后操作与游离药物量的测定相同,得到C总[9-11]。
计算包封率的公式:包封率=(C总C游离)/C总×100%
其中:C上清是上清液中游离药物浓度;C总是破乳后利奈唑胺脂质体的药物浓度。
2.3 溶剂(乙醇)注入法制备利奈唑胺脂质体
精密称取处方考察量卵磷脂和胆固醇和10 mg利奈唑胺原料药于烧杯中,加入95%乙醇5 ml,吐温80 0.2 ml,在60℃恒温水浴下搅拌至充分溶解形成类脂,同时量取pH=6.7的缓冲液(PBS)40 ml置于恒温50℃水浴磁力搅拌器上预热,用10 ml注射器抽取上述类脂溶液在考察量范围内注入50℃PBS溶液中,搅拌水化1 h,之后室温下旋转蒸发除去乙醇(也可不旋转蒸发),取出样品在考察范围内进行探头超声,超声后置于40℃恒温水浴锅中放置0.5 h即得成品[12-15]。
2.4 利奈唑胺脂质体制备工艺及处方因素考察
2.4.1 乙醇注入法制备利奈唑胺脂质体单因素工艺考察
2.4.1.1 脂质溶液注入PBS缓冲液速度
其他条件不变情况下,以注射速度分别为0.3、0.6、1.2、2.4、4.8 ml/min来考察利奈唑胺脂质体包封率。
2.4.1.2 探头超声时间
其他条件不变情况下,以超声时间为变量,分别以1、3、5、7 min来考察利奈唑胺脂质体包封率。
2.4.1.3 水浴温度
其他条件不变情况下,以水浴温度为变量,在水浴温度为20、30、40、50、60℃下进行利奈唑胺脂质体的制备并考察其包封率。
2.4.2 利奈唑胺脂质体处方单因素考察—胆固醇与卵磷脂质量比
其他条件不变情况下,以胆固醇与卵磷脂质量比分别为1:2、1:3、1:4、1:5对利奈唑胺脂质体包封率进行考察。该法采用胆固醇质量不变,增加卵磷脂质量来改变二者比值。
2.5 Box-Behnken响应面法优化工艺
根据单因素考察结果,采用Box-Behnken 响应面优化工艺,选取上述四种单因素中对包封率影响较明显且制备所得脂质体包封率最高的三个因素,进行3因素3水平试验方案如表6所示,以包封率为其响应值,共17次试验[16]。
2.6 验证试验
根据响应面法优化分析,得到利奈唑胺脂质体最佳制备工艺,按此工艺制备三批脂质体,测定包封率和RSD,进行处方和工艺的验证。
2.7 利奈唑胺脂质体体外释放度考察
精密称取定量利奈唑胺脂质体(含原料药约为10 mg),装入煮沸处理的透析袋中,将其两端扎紧,固定在玻璃棒上,放于盛有200 mlpH为6.7的PSD缓冲液烧杯中。将烧杯放置于37℃,10 r/min恒温水浴磁力搅拌器上,搅拌处理;同时做相同浓度的利奈唑胺原料药的体外释放度试验。分别于搅拌 0.5 h、1 h、2 h、4 h、6 h、8 h、12 h、16 h、20 h、24 h取定量(3 ml)透析液测定其吸光度并及时补充等量等温PBS缓冲液。用所测吸光度转换为浓度,计算累积释药率L。
Q=CnV0 + L=Q/W×100%
其中:Q为各时间点累积释药量;Cn为各时间点测得药物浓度;V0为释药介质总体积;Vi为i时间每次取样体积;Ci为i时间各取样点实际药物浓度;W为脂质体中总药物量。
2.8 脂质体外观形态观察
按照最佳制备工艺和处方分别制备两组利奈唑胺脂质,第一组在药脂溶解过程中加入5 ?l浓度为0.01 mg/?l NDB-PE进行荧光染色便于观察载药脂质体,第二组不做其他操作,取适量上述两组利奈唑胺脂质体溶液,用缓冲液适当稀释后在倒置荧光显微镜下进行形态及脂质体分布情况观察。
3 结果
3.1 测定波长的确定结果
由图1与图2可知利奈唑胺的最大吸收波长在289 nm处,而空白脂质体的最大吸收波长则处于232 nm,对于利奈唑胺的吸光度测定基本无干扰,证明利用紫外分光光度计测定数据是合理的。
3.2 方法学考察结果
3.2.1 标准曲线的绘制和线性分析
如图3所示得到标准曲线A=0.01C+0.0516,R2=0.9998。线性范围为1~24 ?g/ml。
3.2.2 精密度试验结果
试验结果如表1所示,低、中、高三种浓度的日内精密度RSD%小于0.39%,日间精密度RSD%小于0.95%,证明精密度良好。
3.2.3 回收率试验结果
由表2可见,三种浓度的回收率在99.78%左右,RSD小于0.66%,表明脂质体对药物含量测定无影响。
3.2.4 稳定性试验结果
稳定性试验结果如表 3所示6个时间点内吸光度无明显改变,RSD小于0.20%,表明利奈唑胺脂质体的稳定性在24小时内良好。
3.3 乙醇注入法制备利奈唑胺脂质体的制备工艺确定及处方因素考察
3.3.1 利奈唑胺脂质体单因素工艺考察
3.3.1.1 脂质溶液注入PBS缓冲液速度
按照2.4.1.1中条件操作,得到药物包封率如图4所示,可知在注射速度为1.2 ml/ml时,脂质体包封率最大。
3.3.1.2 探头超声时间
按照2.4.1.2中条件进行操作,得到药物包封率如图5所示,可知超声时间在3 min时,脂质体包封率最大。
3.3.1.3 水浴温度
在2.4.1.3条件下,在温度变量范围内制备利奈唑胺脂质体,测定包封率如图6所示,可知水浴温度在三个工艺因素考察中对利奈唑胺脂质体的包封率影响不显著,故此因素不作为主要考察因素。
3.3.1.4 利奈唑胺脂质体处方单因素考察—胆固醇與卵磷脂质量比
按照2.4.2(1)中条件进行试验,得到药物包封率如图7所示,可知在胆固醇与卵磷脂质量比在1:3时,脂质体包封率最大。
3.4 响应面试验与结果
3.4.1 响应面优化
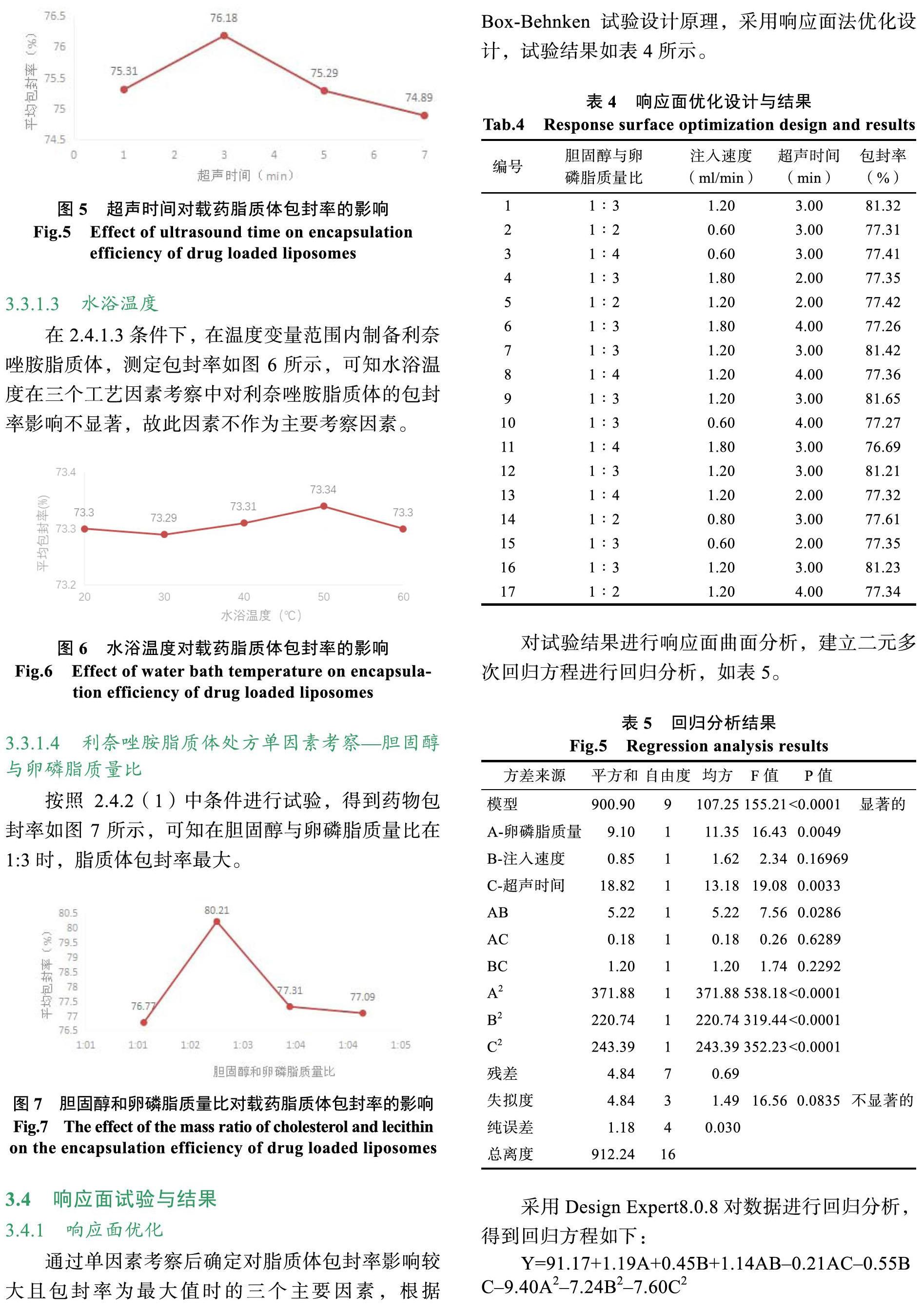
通过单因素考察后确定对脂质体包封率影响较大且包封率为最大值时的三个主要因素,根据Box-Behnken试验设计原理,采用响应面法优化设计,试验结果如表4所示。
对试验结果进行响应面曲面分析,建立二元多次回归方程进行回归分析,如表5。
采用Design Expert8.0.8对数据进行回归分析,得到回归方程如下:
Y=91.17+1.19A+0.45B+1.14AB–0.21AC–0.55BC–9.40A2–7.24B2–7.60C2
由表5可知,本实验模型具有高度显著性(P< 0.0001),失拟度P=0.0835>0.05为不显著的,表明该模型无失拟因素而且模型中主要考察因素P值均小于0.05,模型决定系数R2=0.9950,R2Adj=0.9886,代表本次试验的预测值与真实值相差极小,综上所述,表明该模型拟合度良好。
3.4.2 响应曲面分析
响应面曲线图可直观反应包封率与试验因素的相互关系,图8图9为胆固醇与卵磷脂的质量比与超声时间、脂质溶液注入PBS缓冲液的速度与超声时间、超声时间与胆固醇与卵磷脂的质量比三组因素对脂质体包封率的响应面图,图8中响应面曲面陡峭,跨度大;图9中三组等高线为类椭圆形,反映出被考察因素之间相互作用显著并且等高线与轴线的相交点较多表明考察因素对脂质体包封率的影响均较大,通过Design Expert8.0.8软件优化得出最佳处方工艺为胆固醇与卵磷脂的质量比:1∶3类脂注入缓冲液的速度1.2 ml/min、超声时间3 min。
3.5 验证试验结果
按照最佳工艺方法制备脂质体并进行进行包封率测定得到结果如表6所示,三批脂质体的平均包封率为82.36%,RSD为1.32%,表明该方法制备的脂质体质量较好。
3.6 利奈唑胺脂质体体外释药性考察结果
由图10可知,利奈唑胺原料药溶液释放较快,4 h累计释放量就达到了99.95%;利奈唑胺脂质体在24 h时,药物累计释放度达到93.37%,利奈唑胺仍未释放完全,体现了脂质体的良好缓释效果。
3.7 最佳工艺下所制脂质体外观形态观察及平均粒径检测
3.7.1 常规脂质体的观察
本实验以最佳工艺制得的载药脂质体混悬液如图11所示,混悬液呈乳白色,普通光源下通过倒置荧光显微镜观察,可以看出所制备的载药脂质体数目较多且形貌较为圆整,如图12所示。
3.7.2 NBD-PE荧光染色后脂质体的观察
为进一步观测脂质体形貌使用NBD-PE荧光染色剂染色后的利奈唑胺脂质体呈现出黄绿色,如图13所示。在倒置荧光显微镜可以观察到利奈唑胺脂质体的双分子层结构,外观为椭球形,粒径较均匀,平均粒径分布在500 nm左右如图13图14。
4 讨论
本实验采用乙醇注入法配合超声制备利奈唑胺脂质体,利奈唑胺物化性质良好,包封效果显著,传统脂质体制备使用三氯甲烷等有毒有机溶剂,该法乙醇无毒,但乙醇过量会导致脂质体聚集影响包封率;卵磷脂与胆固醇的比例在有效范围内可保证包封率的良好,但过量后会导致膜不对称,药物泄露降低包封率;在制得脂质体后,应严格把控其贮存条件冷藏4℃下放置,如在室温25℃下储存则会出现不可逆性沉淀,颗粒变大如图,影响其包封率。在制备过程中发现,药品加入的顺序、超声时间、是否用微孔滤膜过滤对脂质体的形态影响很大,而且在胆固醇与卵磷脂被乙醇溶解后有少量胆固醇不溶,需加入吐温80增溶。利奈唑胺原料药最后加入,其溶解完全且脂质体均与;超声时间过长,经微孔滤膜过滤,脂质体变成单室且不宜用倒置显微镜观察到。本实验分离利奈唑胺与脂质体的方法为离心法,该法的选择不如葡萄糖凝胶柱层析法,但条件有限,便采用方便易行的离心法代替。.影响脂质体制备工艺的因素有很多,如进行单因素实验,不能进行因素与因素之间的相互影响考察,采用正交试验,试验次数将明显增多,因此采用响应面法进行工艺优化,响应面法既反映了单一自变量与包封率之间的关系,又体现出每个自变量相互间的作用对包封率的影响,使最佳的考察因素不仅仅局限于设计试验所选择的几个点,而是存在于一个由连续的点构成的曲面的极值处,并且仅为一个点。此法比常规的考察方法更精确。并且,响应面法进行的试验次数相对较少,并且省时易行。在进行体外释药度考察时,发现利奈唑胺脂质体前期的释药速度较后期快很多,因为前期释放为未完全包封的药物即脂质体膜外附着的药物,后期释放的则为脂质体中包封的药物,由此体现出脂质体的缓释功能[17-20]。
参考文献
[1] 唐神结, 肖和平. 利奈唑胺抗结核作用的研究及其最新进展[J]. 中华临床医师杂志, 2010, 4(1): 63-64.
[2] 刘君. 基于结核流行病学的控制与预防策略的研究[J]. 中国卫生产业, 2015, 1(c): 33-34.
[3] 韩瑞敏. 浅谈结核病防治工作的重要性[J]. 临床医药文献杂志, 2016, 3(15): 24-31.
[4] Tang S, Yao L, Hao X, et al. Efficacy, safety and tolerability of linezolid for the treatment of XDR-TB: a study in China[J]. Eur Respir J, 2015, 45(1): 161-170.
[5] 侯丽芬, 谷克仁, 吴永辉. 不同制剂脂质体制备方法的研究進展[J]. 河南工业大学学报(自然科学版), 2016, 37(5): 119-124.
[6] 仵文英, 李莎, 徐晓娜, 等. 苦参碱脂质体的稳定性及体外释放度研究[J]. 中国药房, 2013, 24(37): 3542-3544.
[7] 辛小娟, 黄文祥, 李佳俊, 等. 利奈唑胺及其耐药机制研究[J]. 中国抗生素杂志, 2013, 38(6): 411-418.
[8] Koh WJ, Kang YR, Jeon K, et al. Daily 300 mg dose of linezolid for multidrug-resistant and extensively drug-resistant tuberculosis: upda-ted analysis of 51 patients[J]. J Antimicrob Chemother, 2012, 67(6): 1503-1507.
[9] Guo J X, Ping Q N, Sun G Q, et al. Lecithin vesicularcarriers
for transdermal delivery of cyclosporin A[J]. Int JPharm, 2010, 194(4): 201
[10] Shim J, Kim MJ, Kim HK, et al. Morphological effect of lipidcarriers on permeation of lidocaine hydrochloride through lipidmembranes[J]. International Journal of Pharmaceutics, 2010, 388(1-2): 251-256.
[11] MITTAL S, S PRADHAN, T SRIVASAVA, et al. Recent advances in targeted therapy for glioblastoma[J]. Expert RevNeurother, 2015. 15(8) : 935-946.
[12] 王婷玉, 厉瑶, 张鑫, 等. 正交设计优化尼莫地平脂质体的制备工艺[J]. 广州化工, 2016, 44(1): 68-70.
[13] Zhu L, Li M, Dong J, et al. Dimethyl silicone dry nanoemul-sion inhalations: formulation study and anti-acute lung injury effect[J]. J Int Pharm, 2015, 491: 292-298.
[14] Yoshizawa Y, Kono Y, Ogawara K, et al. PEG liposomalization of paclitaxel improved its in vivo disposition and antitumor effcacy[J]. Int J Pharm, 2011, 412(1-2): 132-141.
[15] Wehbe M, Malhotra A, Anantha M, Roosendaal J, Leung A W, Plackett D, Edwards K, Gilabert-Oriol R, Bally M B. J. Control. Release. 2017, 252: 50-52.
[16] 胡玉贞, 李淼, 张桐桐, 等. 青蒿琥酯脂质体粉雾剂的制备及其治疗大鼠急性肺损伤的作用[J]. 药学学报, 2016, 51(12): 1906-1907.
[17] 袁雍, 黄平, 杨秀丽, 等. 脂质体经皮局部给药研究进展[J]. 中国药师, 2014, 17(7): 1227-1229.
[18] LIU G J, WANG W, WANG H D, et al. Preparation of 10-hydroxycamptothecin proliposomes by the supercritical CO2 anti-solvent process[J]. Chemical Engineering Journal, 2014, 243 (4): 289-296.
[19] SUDILOVSKY A, CLEWE T H. Comparative efficacy of halcino-nide and fluocinonide creams in psoriasis and eszematousdermatoses[J]. J Clin Pharmacol, 2013, 15(11/12): 779-784.
[20] 張勇, 赵莹, 叶小玲, 李棋生, 等. 脑靶向紫杉醇脂质体制备工艺的优化[J]. 嘉应学院学报(自然科学), 2016, 34(5): 58-60.

