破囊壶菌发酵生产DHA的研究进展
叶会科,王秋珍,何耀东,汪光义
(1 天津大学环境科学与工程学院,天津300072;2 天津大学青岛海洋技术研究院,山东青岛266200;3 河北农业大学海洋学院,河北秦皇岛066000)
二十二碳六烯酸(DHA)是目前发现的碳链最长的ω-3 多不饱和脂肪酸,具有抗心脑血管疾病、抗血脂、降血压、预防各种癌症等功效,参与炎症反应、血液凝结等重要的生理过程,同时在婴幼儿视网膜形成、神经发育、智力发育等方面起着关键作用[1-2]。深海鱼油是DHA 的传统来源,但其存在成本高、重金属污染等缺点[3]。同时,随着研究的不断深入,人们发现深海鱼类等高等生物并不能直接合成DHA,而是通过外界摄取来获取DHA[4]。因此,越来越多的研究人员将研究方向聚焦于海洋食物链的初级生产者——海洋藻类和海洋微生物上。海洋微生物由于具有生长周期短、不受季节限制等优势,成为DHA 等多不饱和脂肪酸的重要来源[5]。能够生产DHA的海洋微生物主要是一些低等的海洋真菌、微藻和原生生物等,其中破囊壶菌由于具有生长速度快、油脂含量高、易于培养等诸多优势,成为目前工业化生产DHA 的理想物种之一[6]。
1 破囊壶菌概述
破囊壶菌(thraustochytrids)是一类分布于海水、半咸水、腐烂红树叶及藻类等特定环境中的类真菌类原生生物[7]。大多数破囊壶菌在腐烂的植物和藻类的残渣上进行腐生,少数寄生于海洋无脊椎动物[8]。早在1934年就已经有科学家分离出了破囊壶菌,因其可产生双鞭毛的浮游孢子,破囊壶菌在发现的初期 被 分 类 为 真 菌 界(Eumycetes)、 卵 菌 纲(Oomycetes)、水霉目(Saprolegniales)[9-10]。随着分子生物学技术的发展,相关学者发现破囊壶菌并不属于真菌,在进化距离上与盘根足虫更为相近。因此,破囊壶菌最终被列为生物界(stramenopila)、不等毛门(heterokonta)、网黏菌纲(labyrinthulomycetes)、破囊壶菌目(thraustochytriales)、破囊壶菌科(thraustochytriaceae)[11-12]。根据最新的分子分类学研究, 破囊壶菌共包括9 个属, 分别为Aurantiochytrium、Thraustochytrium、Botryochytrium、Parietichytrium、Sicyoidochytrium、Japonochytrium、Ulkenia 和Schizochytrium、Monorhizochytrium[13]。本实验室在我国的诸多海域均使用松花粉垂钓法分离出了多株破囊壶菌,并对相关海域的可培养破囊壶菌多样性进行了分析,揭示了破囊壶菌的高产油特性,是发酵生产脂肪酸的潜力菌[14]。
破囊壶菌细胞所含油脂中的脂肪酸成分简单,主要是棕榈酸(C16∶0)和DHA[14],已被证实为理想的DHA 工业化生产菌,表1 对现阶段研究较多的可用于生产DHA 的破囊壶菌菌株进行了总结。早 在2003 年Bailey 等[16]在14000 加仑(1 加 仑=3.7854118L) 的发酵罐中使用Schizochytriumsp.ATCC20888,获得了171.5g/L的生物量,且其DHA产量可达35.33g/L,2004年美国的Martek公司就已经将破囊壶菌中的Schizochytruimsp.进行商业化利用来发酵生产DHA[23];国内相关学者于2013 年,在7000L 的发酵罐中使用Schizochytriumsp.CCTCC M209059 可获得生物量128.3g/L,DHA 产量达39.2g/L[15]。破囊壶菌油脂中的饱和脂肪酸棕榈酸可作为生物柴油的主要原料,因而使其成为极具研究价值的能源微生物[24]。此外,破囊壶菌细胞内含有的其他活性成分,如类胡萝卜素、角鲨烯等萜类物质[7,25]对人体健康有着至关重要的作用。破囊壶菌具有较高的营养价值,目前已被证明可用于海参等诸多海产生物幼体的培育。使用添加破囊壶菌菌体的饲料,不仅可以降低幼体的发病率,提高免疫力和成活率,还能使其体重和肉质中的DHA 比例增加,从而提升产品品质和市场价值[26-27]。因此,开发破囊壶菌高附加值代谢产物的工业化生产技术具有极高的经济价值。
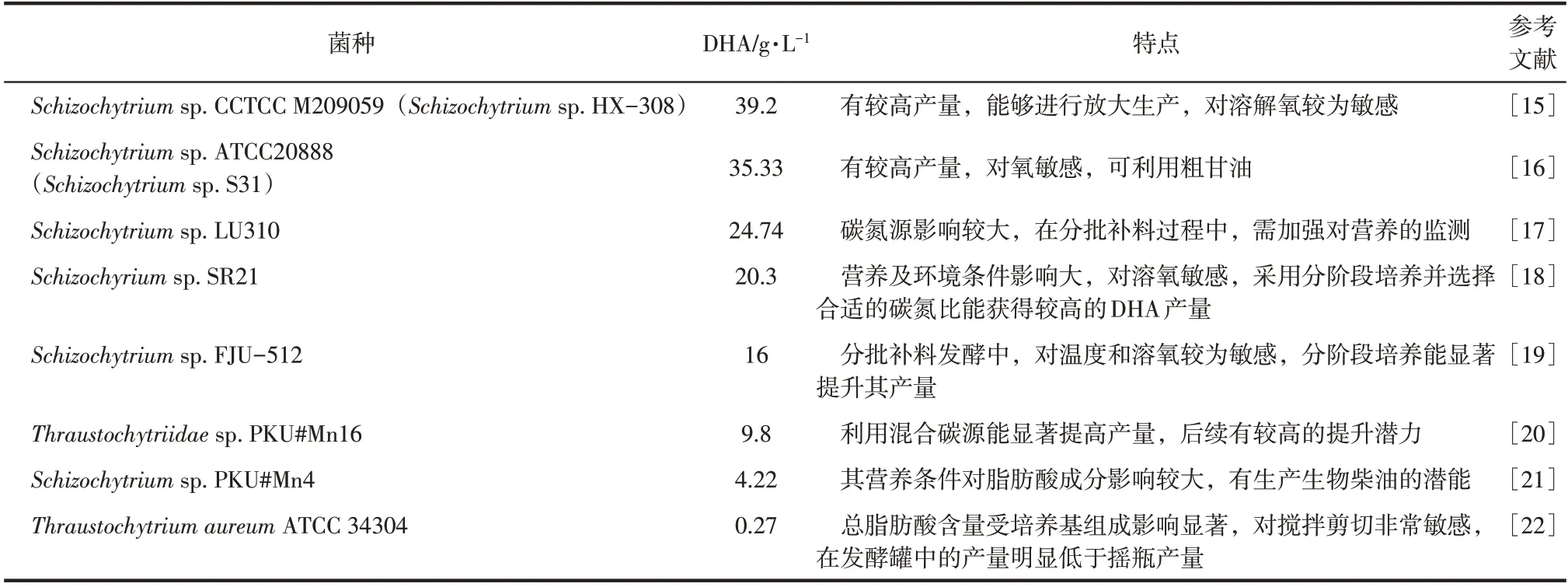
表1 现阶段研究较多生产DHA的破囊壶菌菌株汇总
2 破囊壶菌DHA合成路径
目前破囊壶菌生物合成DHA 的代谢途径并不明确,一般认为破囊壶菌可以通过两种途径合成DHA,即传统的脂肪酸合成酶(fatty acid synthesis pathway,FAS)和聚酮合酶(polyketide synthesis pathway,PKS)[28-29]。本文作者课题组在最近的研究中通过转录组分析了Thraustochytriidaesp.PKU#Mn16利用葡萄糖或甘油两种单一碳源以及两种混合碳源的DHA 合成通路,结果发现与利用葡萄糖为碳源时相比,当利用混合碳源时其FAS通路相应基因有所上调;而与甘油为碳源相比,当利用混合碳源时,其PKS 路径上的相应基因有所上调,这表明两个DHA合成路径同时存在于破囊壶菌中,且与外界营养条件有密切关系[20]。在合成脂肪酸的过程中,两条途径均以乙酰CoA和丙二酸单酰CoA为基本合成单位,同时碳链延伸的共价结合位点也一致,但两者所涉及的关键酶不同。此外,与FAS途径相比,PKS途径具有以下两个特点:①不饱和脂肪酸直接由乙酰辅酶A合成,并不是首先合成饱和脂肪酸再由去饱和酶形成双键;②在整个合成路径中并不需要氧气的参与,但在有氧条件下PKS途径依然可以运行,只是氧分子不参与反应[30]。
2.1 脂肪酸合成酶(FAS)途径
传统的脂肪酸合成酶(fatty acid synthesis pathway,FAS)途径主要通过碳链的延伸和去饱和作用而合成DHA。其中FAS 是一个多酶复合体,包括酰基转移酶、烯酰ACP 还原酶、脱水酶、酮酰ACP 还原酶、酮酰ACP 合成酶、磷酸泛巯基乙胺转移酶和酰基载体蛋白ACP,以及其他的一些辅酶[23]。破囊壶菌通过FAS 途径合成DHA 的过程如图1所示。
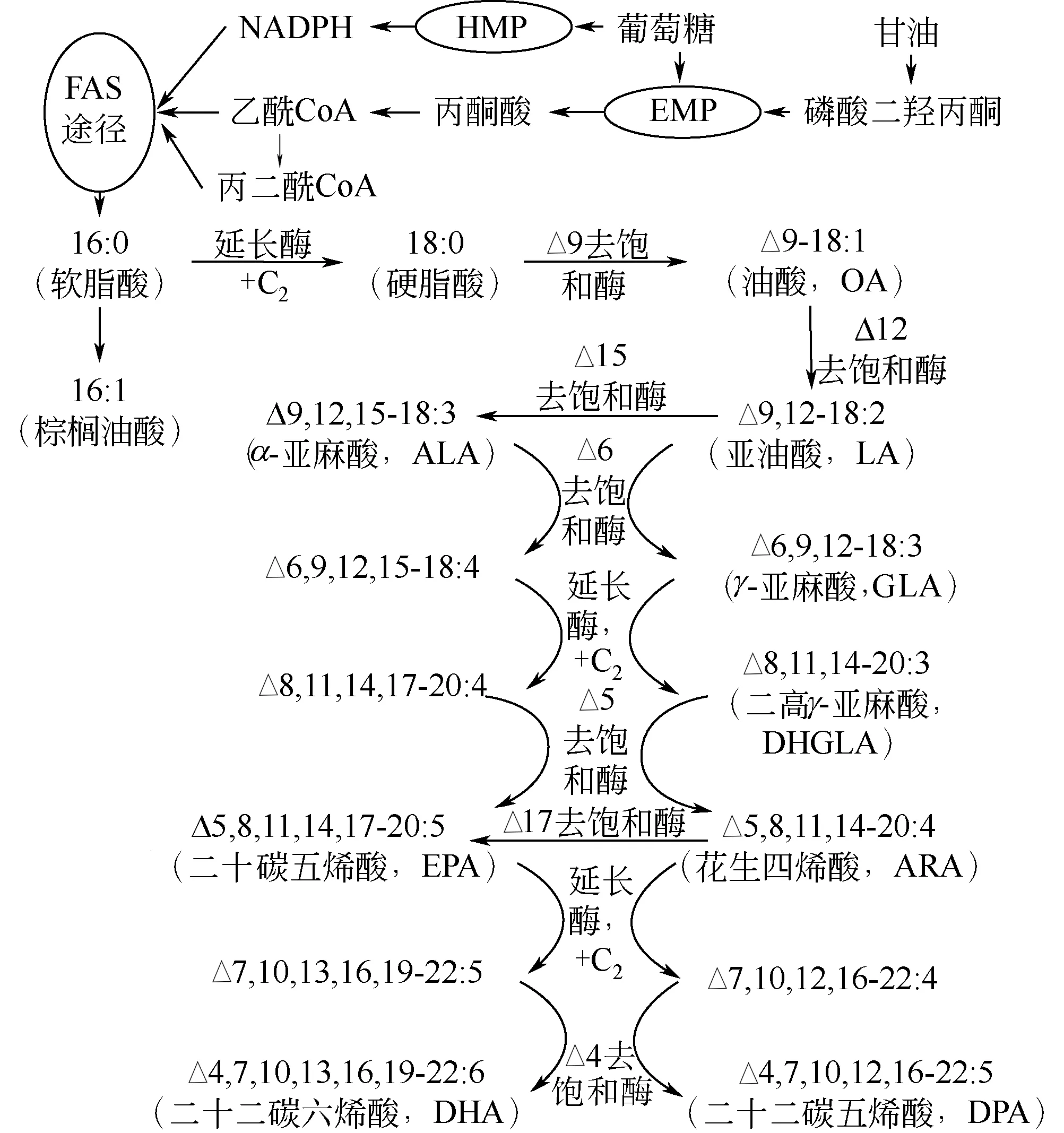
图1 破囊壶菌合成多不饱和脂肪酸的FAS通路
破囊壶菌发酵生产DHA 较常用的碳源是葡萄糖和甘油,而这两种碳源必须经过糖酵解途径代谢为丙酮酸,再由丙酮酸氧化为乙酰辅酶A才能够进入脂肪酸合成途径。在微生物体内,葡萄糖首先经过糖酵解途径(EMP)或磷酸戊糖途径(HMP)被代谢为丙酮酸。甘油进入微生物体内后首先在甘油激酶(GK)的催化下磷酸化为3-磷酸甘油,再通过线粒体内膜上的FAD+依赖型的3-磷酸甘油脱氢酶(FAD+-G-3-PDH)转化为磷酸二羟丙酮,随后进入EMP 途径[31]。其中,HMP 途径不直接为生物体提供能量,但是能够为脂肪酸代谢提供一系列的前体物质(NADPH、核酸等)。在有氧条件下,丙酮酸在线粒体中被完全氧化为乙酰辅酶A。脂肪酸合成的前体物质是乙酰辅酶A,微生物可利用体内的乙酰辅酶A在FAS的作用下通过一系列的生物化学反应合成软脂酸(16∶0)[32]。这一系列的反应包括乙酰基转移反应、丙二酰转移反应、脱水反应、缩合反应以及还原反应。而软脂酸可以在碳链延长酶的作用下生成硬脂酸(C18∶0),随后在△9 去饱和酶的作用下生成油酸(OA,18∶1)、△9和△12 去饱和酶的作用下生成亚油酸(LA,18∶2)、△9、△12和△15去饱和酶作用下生成亚麻酸(ALA,18∶3)[33]。亚油酸(LA,18∶2)和亚麻酸(ALA,18∶3)分别进入n-6和n-3脂肪酸合成途径,随后在△6、△5和△4去饱和酶以及延长酶的交替作用下分别生成DHA(二十二碳六烯酸)和DPA(二十二碳五烯酸)[34]。目前,在整个合成路径中,△4-去饱和酶[35]、△5-延长酶[36]、△12-去饱和酶[37]和△5-去饱和酶[38]已经被克隆并鉴定,其他去饱和酶和延长酶尚未被鉴定。
Hauvermale 等[39]从S.sp.ATCC20888 的 基 因 组DNA中分离出3个编码多不饱和脂肪酸合成酶亚基的基因,并在大肠杆菌中进行了表达,在得到的转化子中积累了DHA和DPA,且DHA/DPA的比值与裂殖壶菌中的比值大致相同;Metz 等[40]对S. sp.ATCC20888 的FAS 合成酶基因定点突变后,发现裂殖壶菌只能合成饱和脂肪酸,而无法合成DHA。这些研究表明在破囊壶菌体内存在FAS路径的相关基因,一旦相关基因被干扰,其DHA 合成就会受到影响。对该途径中的关键酶进行进一步的研究,更有利于对破囊壶菌生产DHA进行代谢调控。
2.2 聚酮合酶(PKS)途径
有研究发现破囊壶菌科中的裂殖壶菌不能将外源14C 标记的C22∶5 转化成DHA,因此,推测破囊壶菌的合成途径可能不只有FAS途径[41]。将裂殖壶菌与可产生多不饱和脂肪酸的海洋希瓦氏细菌的基因进行比较,发现其基因中存在编码PKS 的结构域,进而提出裂殖壶菌合成DHA 的途径类似于海洋细菌中的PKS途径,称为聚酮合酶途径[42]。破囊壶菌通过PKS途径合成DHA的过程如图2所示。
PKS途径中并没有去饱和酶和延长酶,是由乙酰辅酶A和丙二酸单酰辅酶A提供碳原子,先转化为含有酰基载体蛋白质(ACP)的酯类,并在缩合酶的作用下生成3-酮丁酰中间物。随后在酮乙基还原酶、脱水酶和烯酰还原酶的作用下转化为丁酰-ACP。最后,丙二酰辅酶A 再次按上述方式连接到脂肪酰链上,每次增加2个碳原子,逐渐延长碳链。PKS途径是由一个类似聚酮合成酶的基因簇控制,它包括β-酮酰合成酶、β-酮酰-ACP 还原酶、烯酰还原酶、脱水酶/异构酶、酰基转移酶和酰基载体蛋白。在上述一系列酶的催化下,乙酰辅酶A 和丙二酸单酰辅酶A 作为基本单位,经过缩合、还原、脱水、还原/异构的循环合成DHA[34]。在破囊壶菌Thraustochytrid aureumATCC 34304 突变株中,FAS 途径被阻断,但其DHA 产量仍高于野生株[37],由此表明PKS路径的存在。
Li 等[43]从Schizochytriumsp.ATCC MYA1381 的PKS 基因簇中克隆了链长因子(CLF)和脱氢酶(DH),并通过同源重组将其打乱导致PUFAs 生物合成显著下降,其中CLF 的破坏降低了C22 PUFA的比例,而DH 的破坏则降低了各PUFA 的产量。李清[44]对Schizochytrium limacinumOUC168 的pks1(3908bp)和pks2(4272bp)基因成功克隆,其结果显示pks1 可能属于脱水/异构酶(DH),pks2 可能包含两个Ketoacyl-synthase 超家族,分别为Acyl transferase 超家族和TIM_phosphatebinding 超家族;周兵兵[45]通过对该菌株中的pks1基因过表达,将菌体的生物量和DHA 产量分别提高了14.6% 和37.9%。娄菲等[46]发现,在发酵过程中,当温度降低时,Schizochytriumsp.S31 中PKS 相关基因(PFA1、PFA2 和PFA3)的表达量均有所上调,增加了PUFA 的含量。Ren 等[47]通过实验证明PKS 系统中的酰基转移酶(AT) 基因的缺失导致了Schizochytriumsp. HX-308 的DHA 在总 脂 肪酸中的比例下降,而重组AT基因的导入使得DHA比例有所提高;此外,Ren 等[48]利用RNA-seq 技术对S.sp. HX-308 不同发酵阶段的差异基因进行了比较,发现PKS 途径中的基因pfaC 对环境变化表现出较高的敏感性,可能是未来促进多不饱和脂肪酸生物合成的关键调控因子。综上所述,在破囊壶菌合成DHA 中,PKS 系统占有很重要的地位,提高PKS相关基因的表达量能够提高其DHA产量。
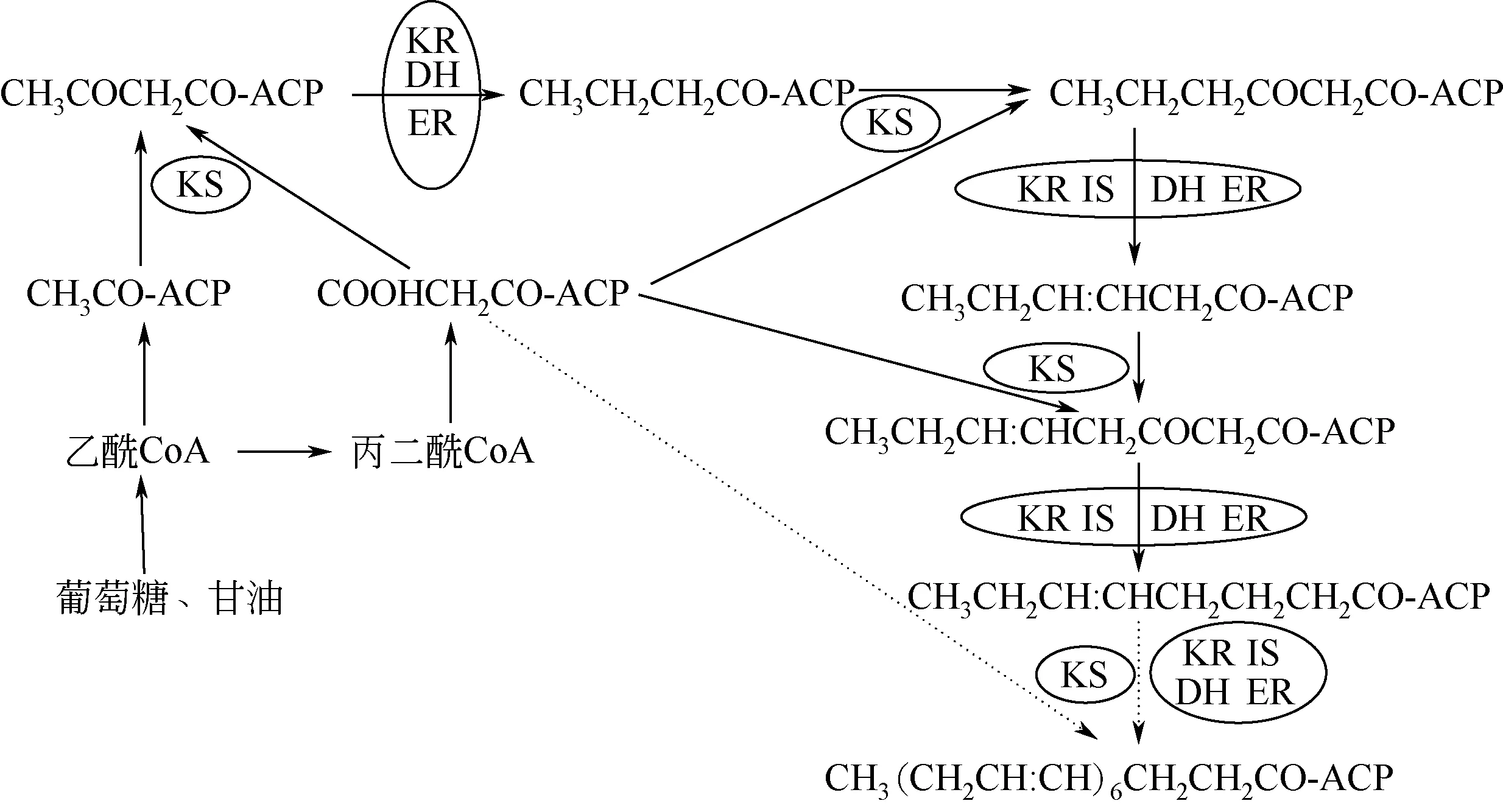
图2 破囊壶菌合成DHA的PKS通路
目前对于不同属的破囊壶菌合成DHA 的具体机制尚未明确,对部分酶功能的认识尚处于推测阶段,并没有进行功能验证和实验结果的支持。此外,对两条途径之间的关系也并未研究清楚,两条途径之间是分工明确还是协调统一的关系尚待探究。以上一系列关于DHA 合成途径的问题迫切需要进行深入研究,以丰富对脂肪酸合成路径的认识,为破囊壶菌发酵生产DHA 的代谢调控提供理论基础。
3 影响破囊壶菌合成DHA的因素
微生物生产高附加值代谢产物不仅受到自身遗传因素的影响,而且与外部营养和环境条件息息相关[49]。同样,破囊壶菌DHA 的发酵生产也受许多环境因子的影响,包括碳氮源、温度、溶解氧、pH、盐度等。只有选择最为合适的培养条件,才更有利于DHA 的工业化发酵生产,因此发酵条件的优化成为发酵生产中必不可少的一个环节[50]。表2总结了不同破囊壶菌菌株在摇瓶培养条件下生产DHA 的最佳碳氮源条件。下文对影响破囊壶菌DHA 累积的3 个关键因素(碳氮源、温度和溶解氧)进行综述。
3.1 碳、氮源
微生物细胞结构的基本单位是碳架。碳、氮源是微生物生长、增殖和代谢的基本原料。破囊壶菌属于异养型原生生物,在其发酵过程中必须添加适量的碳源和氮源,才能有足够的物质和能量维持自身的繁殖和代谢。碳、氮源的种类和浓度,对破囊壶菌的生长繁殖速度、脂质累积速度和DHA 合成速度均有很重要的影响。
破囊壶菌常用的碳源包括葡萄糖、果糖、乳糖、麦芽糖、蔗糖、甘油和可溶性淀粉等[59]。不同菌株的最适宜的碳源种类不同,本文作者课题组之前对两株破囊壶菌T.sp.PKU#Mn16和Schizochytrium.sp.PKU#Mn4 进行最优碳源的考察,发现使用不同碳源培养,生物量的差异并不明显,但其油脂和DHA产量却具有显著影响,其中甘油是最有利于油脂和DHA积累的碳源。与葡萄糖相比,在甘油为碳源的条件下两株菌的DHA占总油脂的比例分别增加了16.2%和12.77%[21]。同样地,在甘油为碳源的条件下,Schizochytrium limacinumSR21的DHA相对含量(DHA占总脂肪酸的比例)高达72.6%,远远超过了以葡萄糖为碳源的比例(30%~48%),由此表明甘油更有利于破囊壶菌中DHA的积累[18]。裂殖壶菌S.sp.S31和Thraustochytrium roseumMF2以葡萄糖为碳源时,生物量、脂质含量以及DHA 产量均较高;而以乳糖、蔗糖等为碳源时,生物量和DHA产量均远低于前者[53-54]。因此,碳源对破囊壶菌的生长、脂肪酸和DHA 累积均有明显影响。葡萄糖和甘油是破囊壶菌可利用的优质碳源,同时与葡萄糖相比甘油更有利于破囊壶菌油脂的积累,而葡萄糖则对生物量的贡献更大。

表2 破囊壶菌在摇瓶发酵的最佳碳氮源培养条件、生物量和DHA产量
破囊壶菌常用的氮源包括酵母粉、蛋白胨、胰蛋白胨、谷氨酸钠、玉米浆、尿素等有机氮源以及硫酸铵、乙酸铵、硝酸铵等无机氮源。不同氮源对不同破囊壶菌菌株的生长和油脂积累的影响具有很大差异。在无机氮源硝酸钠条件下,裂殖壶菌S.sp.S31 的生物量达到最大值(7.46g/L);当以尿素为氮源时,其油脂占生物量的比例达到最大值(43.39%);以硝酸钠作氮源,其油脂积累量达到最大值(2.4g/L);使用酵母粉作氮源则可获得最高 的 DHA 产 量 (0.31g/L)[54]。 破 囊 壶 菌Thraustochytriumsp. T01 利用酵母粉和蛋白胨作为混合氮源时,可以获得较高的生物量(27g/L),与无机氮源(尿素、硫酸铵、硝酸铵、硝酸钠和硝酸钾)相比其生物量为原来的4~7倍[57]。吴克刚等[53]对T.roseumMF2生产DHA的氮源利用进行了考察,结果发现其最优氮源为谷氨酸钠;氮源种类对其生物量、脂质含量以及DHA 产量均有明显影响,但是对DHA 相对含量并没有显著性影响,基本在60%左右。本文作者课题组[21]在前期对破囊壶菌T.sp.PKU#Mn16和S.sp.PKU#Mn4研究中发现,使用酵母粉、蛋白胨、胰蛋白胨和谷氨酸钠等有机氮源,其细胞生长以及油脂积累均优于无机氮源条件;在酵母粉条件下,DHA 产量最高分别达到1.16g/L 和0.82g/L。因此,不同的氮源种类对破囊壶菌的生长影响不尽相同;与无机氮源相比,有机氮源尤其是酵母粉等,更有利于破囊壶菌的生长和DHA累积。
针对碳氮源的研究,除了选择适当的碳氮源种类外,碳氮源的浓度以及合适的碳氮比(C/N)也是影响破囊壶菌细胞生长和代谢的重要因素[60]。在较低浓度范围内,随着碳源浓度的升高,破囊壶菌的生长速度加快;当碳源浓度增加到一定量时,其生长速度会减缓甚至生长受到抑制。氮源浓度的升高能够促进菌体的生长,但不利于油脂以及DHA的积累,培养基中碳源主要用于细胞生长;当培养基中氮源消耗至一定量时,细胞开始使用培养基中的碳源进行油脂积累[49,61]。当分别以葡萄糖和谷氨酸钠为碳源和氮源(碳氮比为70)时,T. roseumMF2 的DHA 积 累 量 达 到 最 高1.242g/L。 对Aurantiochytriumsp. T66 进行限氮培养后,其细胞中DHA 含量提升了一倍左右[62]。高碳氮比有利于破囊壶菌油脂积累量增大,在实际生产中,应适当提高培养基中的碳氮比,使破囊壶菌生产DHA 达到最优的条件。
总之,不同破囊壶菌菌株对碳源和氮源的选择性不同,因此在实际操作中应当针对不同菌株使用不同的培养基成分及配比。葡萄糖和甘油是最常用的碳源,但是两者对生物量和油脂的贡献则各有不同,氮源促进细胞分裂,但是在氮源存在的前提下其油脂积累较少,因此在后续发酵中可考虑使用混合碳源进行发酵,并适当提高碳氮比以提升DHA的产量。同时,在生产中应适当考虑实际效益情况,尽量选择来源广、易获取、价格低的原料进行生产,尽量降低生产成本,以获得最大的经济效益。
3.2 溶解氧
破囊壶菌作为一类异养需氧微生物,主要通过有氧呼吸,将营养物质氧化成二氧化碳和水,并合成大量的能量来维持细胞的生命活动。整个过程是经过氧化呼吸链才能得以实现,同时氧气是呼吸链的终端电子受体,因此发酵液中必须有适当浓度的溶解氧才能维持菌体的正常生理过程[63]。
关于破囊壶菌合成DHA 的途径一般认为有两条:一是需氧的传统脂肪酸合成途径(FAS),另一条是不依赖于氧的聚酮合酶途径(PKS)[23],下文会详细介绍两条DHA合成途径。在FAS路径中,破囊壶菌合成DHA 需氧参与碳链的延长以及去饱和的过程,溶解氧的多少能够直接影响菌体内DHA 的累积。而在PKS 路径中,虽然DHA 由聚酮合酶催化、乙酰辅酶A 作为碳链骨架而最终合成,不需要氧气的参与;但是溶解氧影响着菌体的整个生命过程,如不提供氧气,菌体的生长便会受到抑制,继而影响DHA 的产量[42]。由于破囊壶菌体内FAS与PKS两条通路同时存在,而溶解氧对两条通路均有影响,因此溶解氧作为一个非常重要的发酵参数受到广泛关注。
一般在实际生产过程中,采用两阶段培养法,在高溶氧条件下使菌体大量增殖,然后降低溶氧促进DHA 的积累。对S.sp.HX-308 进行两阶段培养,通过改变发酵罐搅拌转速或通气量以降低溶氧水平,其油脂和DHA 积累量分别提升了43.83%和63.88%[64]。而对于S.limacinumSR21,在高溶氧条件下,细胞大量增殖,但细胞大小和质量变化不明显;在低溶氧条件下,细胞体积变大,油脂积累;对其进行分阶段溶氧控制培养,使得生物量与对照组提高了54%左右,最高可达37.9g/L,而DHA 产量也达到6.56g/L[65]。因此,在今后的破囊壶菌发酵生产中,应根据破囊壶菌的不同生长阶段改变其供氧量,最终达到高产DHA的目的。
3.3 温度
温度对微生物的生长和油脂累积具有重要影响[66]。嗜热微生物菌体所包含不饱和脂肪酸的量极少,而嗜冷微生物菌体内则含有较多的不饱和脂肪酸[67]。一般而言,在一定温度范围内,菌体生物量随温度升高而增加并达到峰值;但其油脂中不饱和脂肪酸的比例则随温度升高而降低,其可能是低温能够激活趋饱和酶基因的表达,菌体通过增加细胞膜中不饱和脂肪酸的含量来提高其流动性,以此抵抗外界低温环境的影响[68]。
不同的破囊壶菌菌株的生长和代谢的最适温度有所差异。通常情况下,破囊壶菌的最适生长温度为15~35℃,在最适温度范围内其生物量能够达到最高值,但其油脂以及DHA的积累量不一定达到最大;低温胁迫可以提高DHA 的产量[69]。在25℃时,S. limacinumSR21 生物量达到最大值(42.45g/L);当温度降低至20℃时,其多不饱和脂肪酸含量有所增加,DHA占总油脂比例由34%提高到了37.05%,而DHA 产量也由8.4g/L 提高到了9.8g/L[70];裂殖壶菌S.sp.HX-308在30℃培养32h后,降低其培养温度对其进行温度胁迫,最终DHA 占总油脂的比例可达51.98%,与之前相比提高了42%[71]。因此,在破囊壶菌工业化生产DHA 中应考虑采取两步发酵法,首先在较适宜的发酵温度下获得充足的生物量,再对其进行低温胁迫以增加DHA 含量,最终达到DHA高产的目的。
综合上述影响因子,将破囊壶菌生产DHA 的整个过程分为两个阶段:第一阶段是菌体生长时期,在这个时期内细胞密度快速增加,而细胞内DHA 积累较少;第二阶段是DHA 合成阶段,在这个阶段菌体细胞数量变化不大,然而细胞内的DHA大量积累[15]。通常情况下,在第一阶段,菌体细胞生长需要大量的营养物质以及初级代谢产物,因此需要较高浓度的碳源和氮源、较适宜的生长温度以及较高的溶氧条件。而在氮源消耗至较低浓度时,菌体开始积累DHA 等次级代谢产物,在这个阶段应考虑补加碳源,促进次级代谢产物的合成[72]。如表3所示为分阶段培养法在破囊壶菌发酵生产DHA 中的应用,可以明显看出与单一条件培养相比,在分阶段培养条件下其DHA 产量有大幅度提升。因此,在实际的工业发酵过程中应在发酵的初始阶段一次性补加足够的氮源,添加最适破囊壶菌菌体生长的碳源,适当提高温度以及供氧量来促进菌体的快速增长;至氮源消耗尽时,进入第二阶段,此时补加碳源,降低温度以及供氧量进行限氮、低氧、低温胁迫,促进菌体中DHA 的合成以达到高产的目的。
4 破囊壶菌发酵生产DHA 的中试研究
微生物发酵中试试验是在实验室小规模实验的基础上,模拟工业化条件所进行的工艺研究,其目的是验证放大后小试工艺的可行性,以及菌株是否具有可放大、可工业化生产的潜力,从而为正式生产提供数据。中试放大是微生物发酵实验到产品生产不可或缺的一个环节,有利于降低产业化的风险,同时也能够在一定程度上使研发、生产成本有所降低[77]。利用破囊壶菌发酵生产DHA 的中试研究目前尚处于起步阶段,由于在放大过程中不可能保持所有物理或化学参数不变,因此必须对影响中试发酵的关键因素进行研究,进而更好地为产业化服务。
对于对剪切力不敏感的微生物而言,在好氧发酵过程中,体积传氧系数(KLa)通常是最重要的影响因素,因此KLa是好氧发酵中最常见的中试放大准则之一[78]。以KLa为放大准则是通过在不同规模的发酵罐中保持KLa、搅拌功率、几何形状、容积功率输入等相关变量的相似性,逐步扩大到较大的发酵罐中,进而扩大其培养规模[77]。Qu等[79]基于KLa成功地将S.sp. CCTCC M209059 发酵规模扩大至7000L,最终,其DCW 产量达到92.7g/L,DHA浓度达17.7g/L。在以KLa为准则进行放大时,同样应考虑到发酵液流体力学、机械剪切力等相关的作用。Zhao等[80]研究了15L发酵罐中不同的叶轮结构对S.sp.HX-308 发酵过程中细胞生长以及DHA 合成的影响,发现不同类型叶轮组合能够显著提高裂殖壶菌生物量及DHA产量,生物量最高可达108g/L,DHA 产量最高可达21.42g/L,占总油脂的48.17%。Guo 等[15]基于叶轮对发酵液流动性的影响设计了6种不同的叶轮,在7000L的发酵罐中成功放大并应用,最终其生物量达到128.3g/L,而DHA产量达39.2g/L。因此,在中试放大过程中,除考虑体积传氧系数(KLa)外,还应考虑计算流体动力学和生物生理特性分析等诸多方面,才能更进一步提高目标产物的产量[81]。

表3 分阶段培养法在破囊壶菌生产DHA中的应用
目前在破囊壶菌中试放大试验中,由于放大前后不能同时保持所有参数一致,从而导致实验室和工业规模的发酵罐中细胞培养条件和生理状态存在显著差异[82]。此外,培养规模的变化会影响发酵罐环境的同质性,从而导致发酵参数(溶解氧、底物浓度、pH 等)在空间上的分布不均,当细胞生长在不均匀的环境中并在不同区域之间穿梭时,这些波动会导致它们的遗传、转录和代谢水平的变化,进而影响目标产品的产量和质量[83-84]。现有的中试放大技术难以实现裂殖壶菌发酵既低能耗又高效、高产且可获得高含量DHA 的目标,因此后续对破囊壶菌进行中试放大研究仍然是工业化生产的一大重点。
5 结语
随着生活水平的不断提高,人们对DHA 的需求量不断增加,采用海洋微生物发酵生产DHA 具有广阔的市场前景。为了提高破囊壶菌的DHA 产量,传统的研究主要集中在菌种选育、培养基及培养条件优化,发酵工艺流程改进等方面。现阶段,更多的研究者从DHA 合成路径入手,通过对多不饱和脂肪酸合成路径中的基因及相关酶的研究,调控其关键酶基因的表达,最终运用基因工程手段提高DHA 的产量[85]。随着当前对破囊壶菌的基因改造及代谢途径研究取得的初步进展,利用破囊壶菌大规模化生产DHA仍有很大的进步空间。
目前,在破囊壶菌发酵生产DHA 方面主要存在以下几方面的问题:优质的种质资源少,细胞生长和油脂积累不稳定以及细胞代谢通路不清晰、难以调控,中试放大关键因素难以确定等。因此,今后关于破囊壶菌的研究工作应围绕高产DHA 的破囊壶菌菌株的筛选,对发酵营养及环境条件的深入研究,对多不饱和脂肪酸合成通路及菌体代谢调控的研究,DHA 发酵工艺的放大等方面。以此为实现破囊壶菌生产DHA的工业化应用奠定理论基础,从而推动DHA 在医药、食品、保健品、饲料等诸多领域的应用。

