慢病毒介导的RNA干扰通过下调白细胞介素6抑制损伤后星形胶质细胞中波形蛋白的表达
向 阳 钟占琼 祝 琦 吴番娜 张 晓△
(1 江油市人民医院检验科,江油 621700;2 成都中医药大学基础医学院,成都 611137;3 成都医学院基础医学实验教学中心,成都 610500)
中枢神经系统(central nervous system,CNS)损伤初期的炎症反应和后期星形胶质细胞活化导致的胶质瘢痕是造成神经功能障碍的重要原因[1]。在CNS损伤中,白细胞介素6(interleukin-6, IL-6)具有神经保护和损伤的双重作用[2]。初期炎症反应可以清除细胞碎片,促进损伤区域修复,但是过度炎症反应,通常导致细胞进行性坏死。通过适当的抗炎干预措施,使机体维持一定的稳态,有助于CNS损伤的恢复[3-5]。波形蛋白(vimentin, Vim)属于细胞中间丝(intermediate filaments, IFs)蛋白家族成员[6]。CNS正常时,Vim在星形胶质细胞中表达量很少,但CNS受损后,星形胶质细胞反应性增生,Vim构成星形胶质细胞的骨架结构,
Vim也明显表达[7]。过度胶质化导致胶质瘢痕的生成,将会抑制神经轴突再生。然而,IL-6和Vim在CNS损伤后的相互关系不清楚,IL-6是否通过调控Vim,影响星形胶质细胞胶质化反应尚未见报道。本实验在体外制备星形胶质细胞损伤模型,用慢病毒载体介导的RNAi抑制星形胶质细胞IL-6的表达,通过免疫荧光(immunofluorescence)、实时荧光定量PCR(real-time quantitative PCR,qRTPCR)、免疫印迹、MTT实验探究Vim的表达变化,探讨其变化对星形胶质细胞反应性胶质化的影响,最终为临床治疗CNS损伤提供新的靶点。
1 材料和方法
1.1 星形胶质细胞培养和鉴定
取3 d SD大鼠于75%乙醇中浸泡消毒,断头入无菌0.01 mol/L PBS培养皿中,夹取大脑皮质入DMEM-高糖培养基,加入0.125%胰蛋白酶充分消化,用10% FBS终止消化,再加DMEM-高糖培养基反复吹打混匀,200目不锈钢细胞滤网过滤,离心机离心10 min,1 000 r/min。吸弃上清液,加入完全培养基重悬,制备单细胞悬液,将单细胞悬液计数稀释至密度为5×105/mL,接种于25 cm2培养瓶中,放入CO2培养箱,每隔3 d全量换液。细胞铺满瓶底时,用0.125%胰蛋白酶消化,经过2次传代,第3次接种于96孔板,接种浓度是5×104/mL;接种于6孔板,接种浓度5×105/mL。通过IF检测GFAP含量,来验证细胞纯度。当星形胶质细胞密度达到40%可进行病毒转染。
1.2 细胞分组
实验分载体组(Vector组)和病毒组(IL-6-RNAi-LV组)。IL-6慢病毒抑制液、阴性对照由华西神经生物研究所提供并予以技术指导。载体组为1 μL阴性对照液加入到100 μL完全培养基中,病毒组为1 μL病毒工作液加入到100 μL完全培养基中,每个孔均加入阳离子聚合物1 μL 1%凝聚胺溶液(polybrene,PB)。24 h后全量换液。转染后2 d,用qRT-PCR检测IL-6 mRNA表达,观察病毒组是否成功抑制IL-6 mRNA。
1.3 星形胶质细胞划伤模型制备
病毒转染后2 d做划痕实验。用10 μL黄色枪头在6孔板培养基中划“井”字,平均间距1 cm,用0.01 mol/L PBS漂洗因划伤掉落的细胞,然后加入完全培养基,放入CO2培养箱培养。在划伤后0、12、24、48 h 4个时间点分别取材进行下一步实验。
1.4 MTT法
在划伤后在0、12、24、48 h进行MTT实验。6孔板中每孔加入100 μL MTT试剂(避光),放入孵箱37 ℃ 4 h。拿出后吸出液体,加入1 mL DMSO,用加样枪混匀,再将液体移到96孔板,每孔100 μL,放入酶标仪测定490 nm OD值。时间为横坐标,OD值为纵坐标作图,比较2组的细胞增殖。
1.5 免疫荧光染色
吸弃培养板中培养基,使用0.01 mol/L PBS漂洗5 min×1次,再加4%多聚甲醛室温固定10 min,然 后 用0.01 mol/L PBS漂 洗3 min×3次。加入含3‰Triton X-100的5%羊血清溶液,放入孵箱37 ℃ 30 min。吸掉液体,每孔加入Vim(1∶400,mouse,博士德),GFAP(1∶300,rabbit,博士德),GFAP(1∶300,mouse,博士德)抗体各50 μL,然后将96孔板放入湿盒,再放入冰箱4 ℃过夜。用0.01 mol/L PBS漂洗5 min×3次。加入荧光二抗:488标记山羊抗小鼠IgG(1∶200)和罗丹明标记山羊抗兔IgG(1∶50)。二抗孵育温度是37 ℃,30 min。0.01 mol/L PBS漂洗5 min×3次。滴加DAPI溶液,尽快使用荧光显微镜于暗室中拍照。
1.6 qRT-PCR
吸弃培养板中培养基,加0.01 mol/L PBS漂洗3 min×3次。每孔加入TRIzol溶液0.5 mL,吹打收集混悬液,提取总RNA。采用试剂盒 (Vazyme Biotech, Nanjing, China)将 总RNA逆 转 录 成cDNA,置于-20 ℃冰箱保存备用。设计大鼠内参β-actin,Vim,IL-6的上下游引物序列和探针序列(表1),通过试剂盒(Vazyme Biotech, Nanjing,China)进行定量PCR的测量。扩增条件如下:95 ℃2 min,95 ℃20 s,52 ℃30 s,60 ℃40 s,循环45次。反应体系在Bio-Rad CFX96TM型实时荧光定量PCR仪上进行。读取Ct值,采用公式R=2-ΔΔCt计算IL-6和Vim相对表达量。
1.7 免疫印迹检测
吸弃培养板中培养基,加0.01 mol/L PBS漂洗3 min×3。加入RIPA裂解液,将细胞从孔板上刮下,离心后弃上清, 加入提前解冻的5×SDS PEGF蛋白上样缓冲液,沸腾变性10 min。本实验采用12%分离胶和5%浓缩胶,先80 V跑至所有样品到达浓缩胶时,换120 V电压,溴酚蓝泳动至距胶下缘1 cm以上时,切断电源,过程约需2 h。PVDF膜用摇床TBST漂洗,10 min×3次,5%脱脂奶粉封闭2 h,加入一抗Vim(1:2 000,mouse,博士德)和β-actin(1:2 000,mouse,博士德)4 ℃过夜18 h, TBST于摇床漂洗10 min×3次,加入二抗(1:10 000,HRP-羊抗小鼠IgG,博士德),摇床室温1 h。摇床TBST 15 min×3次。最后加入显色混合液,于凝胶成像仪器中,采集图像。

表1 引物和探针序列Tab 1 Sequence of primer and TaqMan probe
1.8 统计学处理
使用SPSS17.0软件,本实验所有数据采用x±s表示,2组以上比较时采用单因素方差分析(one-way ANOVA),方差齐行LSD检验,不齐行Dunnett T3检验。2组比较时采用独立样本t检验。
2 结果
2.1 星形胶质细胞培养和鉴定
2.1.1 星形胶质细胞培养 1 d后观察已有细胞贴壁,有些细胞已有突起伸出(图1 A)。3 d时细胞数量增加,细胞体积明显变大,突起长度增加,并且部分细胞交织成网(图1 B),7 d时,细胞已经基本铺满培养瓶,细胞的网络结构更加明显(图1 C)。第2次传代时第7天, 星形胶质细胞的细胞质更加丰富,细胞之间相互交错,形成网络结构(图1 D)。
2.1.2 星形胶质细胞纯度鉴定 传代2代后,当细胞密度达到60 %~80 %时,进行免疫荧光染色,形态清晰(图2,见封三)。随机选取10个显微镜视野,计数蓝色荧光的阳性细胞数和红色荧光的阳性细胞数,然后通过比值来计算星形胶质细胞纯度,结果为97%。
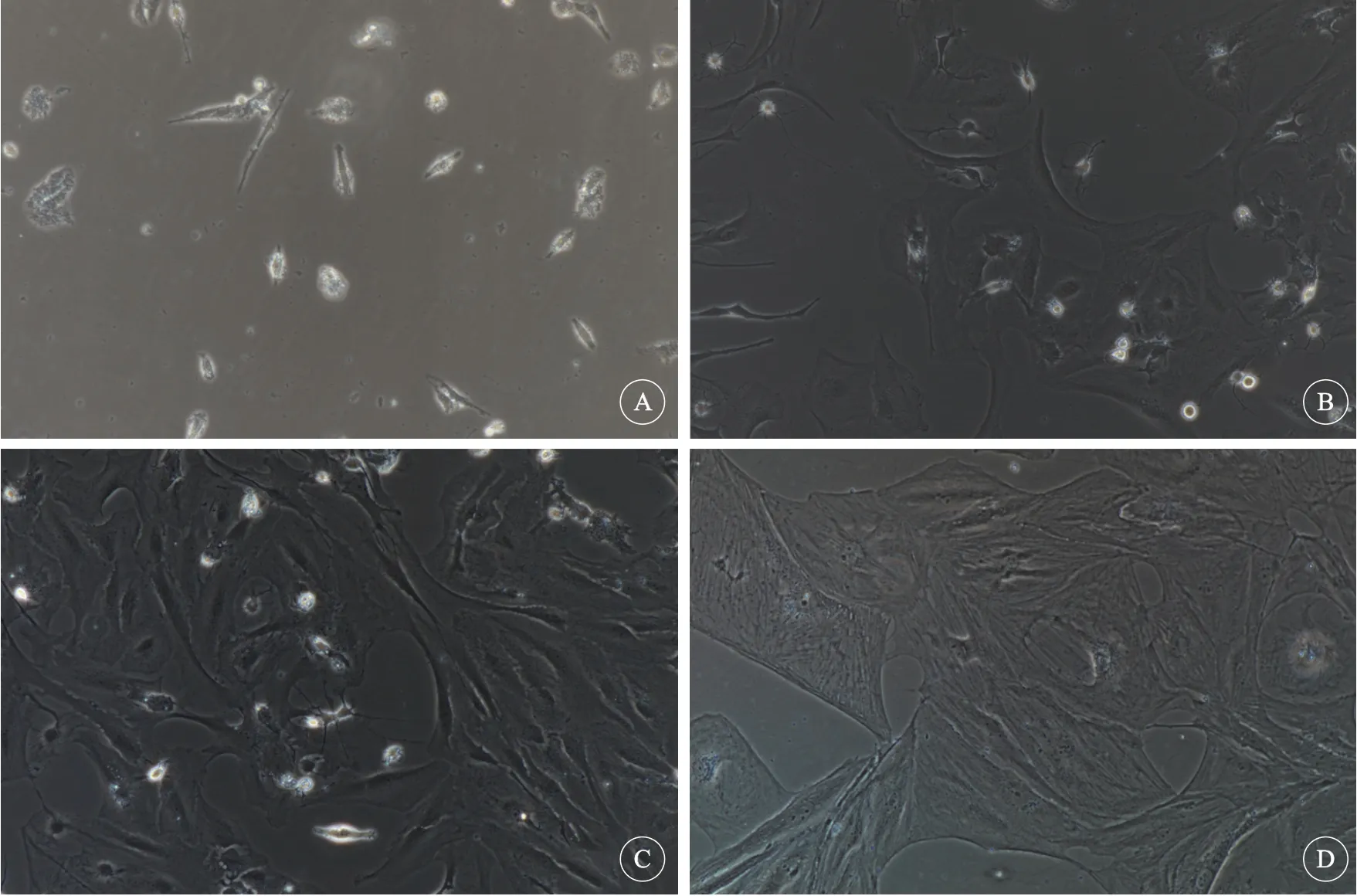
图1 不同培养时间下的星形胶质细胞Fig 1 Astrocytes at different culture time
2.2 qRT-PCR检测IL-6mRNA表达
通过qRT-PCR检测慢病毒转染2 d时病毒组和载体组的IL-6 mRNA相对表达量,结果显示IL-6-RNAi-LV组的IL-6 mRNA含量(0.000 031±0.000 001)较载体组(0.000 055±0.000 003)显著降低,差异具有统计学意义(P<0.05),表明慢病毒转染成功,抑制IL-6 mRNA表达。
2.3 MTT检测星形胶质细胞增殖率
在损伤后24 h、48 h,IL-6-RNAi-LV组的星形胶质细胞增殖率与载体组相比降低,差异有统计学意义(P<0.05)(图3)。
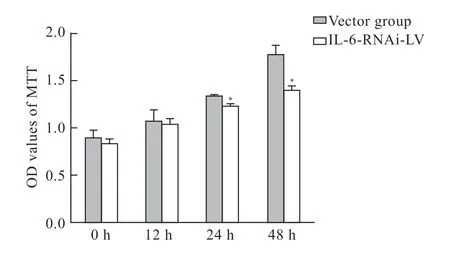
图3 细胞增殖差异比较Fig 3 Comparison of cell proliferation
2.4 免疫荧光检测星形胶质细胞活性
细胞划伤后2 d检测细胞中GFAP,可见其在细胞质和细胞核均高度分布,IL-6-RNAi-LV组绿色荧光强度明显低于载体组(图4,见封三)
2.5 划伤星形胶质细胞后,Vim mRNA和蛋白表达变化及定位
qRT-PCR检测细胞损伤模型制备后2 d时病毒组和载体组的Vim mRNA相对表达量,结果显示IL-6-RNAi-LV组(0.003 45±0.001 2)相较载体组(0.006 7±0.001 2)显著降低,差异具有统计学意义(P<0.05)。
免疫印迹检测细胞损伤模型制备后2 d时慢病毒组和载体组的Vim 蛋白含量。通过Image J 计算和统计学分析,显示IL-6-RNAi-LV组相较Vector组在2 d显著降低,差异具有统计学意义(P<0.05)(图5)。
通过免疫荧光观察载体组和慢病毒组在细胞损伤模型制备2 d时Vim的定位,可见Vim主要在细胞质高度表达。IL-6-RNAi-LV组绿色荧光强度明显低于载体组(图6,见封三)。
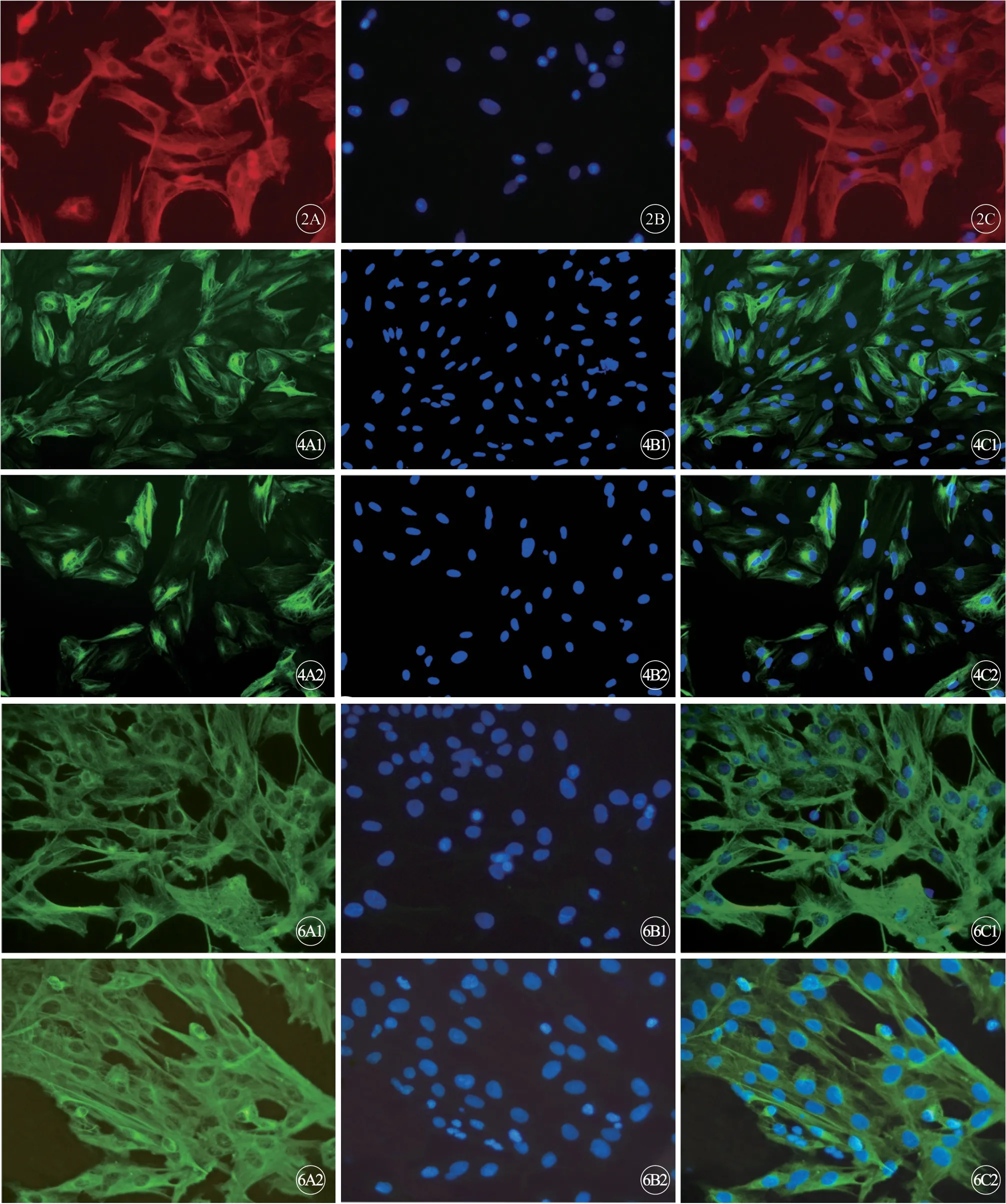
图2 GFAP 免疫荧光染色×400。 A:GFAP+物质(红色); B:DAPI 染细胞核呈蓝色; C:重合图像代表星形胶质细胞.图4 GFAP 免疫荧光染色,×200。A1 ~C1:载体组;A2 ~C2:病毒组。 A:绿色荧光代表星形GFAP 阳性物质; B:细胞核呈蓝色;C:重合图像.图6 Vim 免疫荧光染色结果,×400。A1 ~C1:载体组;A2 ~C2:病毒组。 A:绿色荧光代表Vim 阳性物质; B:细胞核呈蓝色;C:重合图像.Fig 2 Immunofluorescence staining of GFAP, ×400. A: GFAP+ astrocyte(red); B: DAPI( blue) stains the nucleus; C: Merged images.Fig 4 Immunofluorescence staining of GFAP, ×200. A1-C1 :Vector ;A2-C2 :IL-6-RNAi-LV. A :GFAP+ astrocyte(green) ;B: DAPI+ nucleus(blue) ; C: Merged images.Fig 6 Immunofluorescence staining of vimentin, ×400. A1-C1:Vector;A2-C2:IL-6-RNAi-LV. A: vimentin+ astrocyte(green);B: DAPI+ nucleus(blue) ; C: Merged images.
3 讨论
CNS损伤是一种严重损伤,因为其复杂的病理生理机制,至今尚无有效的治疗措施[8]。然而,CNS损伤后早期炎症反应和后期瘢痕形成对损伤后运动功能的恢复有重要影响。本研究在体外建立细胞划伤模型,模拟CNS损伤,通过MTT、免疫荧光、qRT-PCR和免疫印迹检测,研究IL-6对Vim的调控,了解抑制炎症因子IL-6是否下调反应性胶质化相关因子Vim,减轻星形胶质细胞胶质化,有益于CNS损伤恢复。

图5 慢病毒抑制IL-6后vimentin蛋白表达Fig 5 The protein expression of vimentin in astrocytes with IL-6-RNAi-LV
3.1 细胞选择及模型建立
本实验选用星形胶质细胞。在人体中,当机体受到损伤后,细胞的反应性胶质化为损伤后的一个基本病理变化,过度胶质化导致胶质瘢痕形成,而胶质瘢痕中最主要的细胞是活化的星形胶质细胞[9]。因此,本实验选用星形胶质细胞为研究对象。在CNS损伤后星形胶质细胞发生形态学、分子功能学的改变,并随着CNS损伤时间的推移而动态变化,最初胶质细胞活化是一种防御机制,旨在减少炎症、重建血脑屏障,最大限度减少和修复最初的损伤[10],但是当抑制成分超过生长刺激因子,抑制作用占主导时,抑制性成分如硫酸软骨素蛋白多糖、NG2、诺氨酸激酶等的表达而成为机械性屏障[11],在严重损伤情况下,星形胶质细胞活化就会导致不可逆的胶质瘢痕形成。在CNS内,星形胶质细胞数量最多[11],并且在CNS发育成熟后,星形胶质细胞仍然具有分裂能力,在体外进行原代培养比神经元细胞更加容易贴壁,存活率高,并且能够稳定传代[12],对外界刺激有良好反应[13]。
本实验选用划伤模型。在体外建立SD新生鼠大脑皮质的星形胶质细胞划伤模型,模拟体内脊髓损伤后胶质细胞反应性增生[14],划伤性损伤相比于谷氨酸等兴奋性氨基酸造成神经元和胶质细胞损伤更加接近体内组织机械性损伤[15]。
3.2 慢病毒抑制IL-6后Vim表达下调,抑制星形胶质细胞活化
在本实验中,首先将培养的星形胶质细胞分成病毒组和载体组,在转染慢病毒后2 d,采用qRTPCR测量IL-6 mRNA表达量,确定转染是否成功。因为病毒组IL-6的mRNA表达显著低于载体组,表明慢病毒转染成功。然后,建立星形胶质细胞划伤模型。
Vim是细胞骨架的主要成分,对其进行干扰可能有效阻止胶质瘢痕形成。Smith 等[16]通过纳米材料转运siRNA (siRNA-3WJs)抑制神经炎性源因子Lcn2的表达,结果显示Vim、GFAP表达降低,反应性星形胶质细胞减少。Okada 等[17]使用改良纽约大学冲击器造成大鼠脊髓钝挫伤,腹腔注射IL-6R单克隆抗体(MR16-1)抑制IL-6表达,结果显示MR16-1可以抑制IL-6 JAK/STAT信号通路,降低星形胶质细胞分化,也抑制脊髓损伤后星形胶质细胞的活化,还可以减少炎症细胞的浸润,减少瘢痕形成。Lepekhin等[18-19]采用GFAP和Vim基因双敲除小鼠,在其脑或脊髓损伤后形成的胶质瘢痕中,反应性星形胶质细胞表现出明显的形态改变和细胞运动功能缺陷,并且减少胶质瘢痕形成。Larsson 等[20]采用18个月大的GFAP(-/-)Vim(-/-)小鼠为研究对象,双基因敲除的小鼠海马齿状回颗粒层细胞增殖存活率比野生型对照组高34%,神经再生率高36%,提示通过调节星形胶质细胞的活化,可以促进健康老年小鼠海马神经再生。划伤模型建立后,实验结果表明慢病毒抑制IL-6后Vim表达下调。病毒组细胞在24 h和48 h增殖明显低于载体组。免疫荧光检测结果显示病毒组星形胶质细胞活性程度,弱于载体组。实验结果提示慢病毒干扰IL-6后,Vim的表达下调,星形胶质细胞的活化受到抑制,从而减少胶质瘢痕形成,增加轴突可塑性。本实验结果与上述研究保持一致。
在体外实验中,干扰IL-6的表达能够下调Vim的表达,干扰星形胶质细胞骨架结构,影响星形胶质细胞反应性胶质化,从而抑制胶质瘢痕生成。然而,人体内的生理病理机制更为复杂,炎症反应和胶质瘢痕形成之间的相互关系还需要进一步深入探究。

