蓝莓叶总黄酮对LPS/D-GalN诱导小鼠急性肝损伤的保护作用
焦豪妍,许梦怡,师大智,汤庆发,*
(1.广东食品药品职业学院药学院,广东广州510520;2.南方医科大学中医药学院,广东广州510515;3.广东省中药制剂重点实验室,广东广州510515)
急性肝损伤可由多种因素引起,如病毒、毒素和药物滥用等[1],其主要表现为肝脏功能的丧失和代谢障碍、体内环境失衡等。急性肝损伤的持续发展会导致肝功能衰竭,死亡率极高[2]。近年来,由于药物滥用,急性肝损伤在我国的发病率逐年增加,因此研究及开发预防或治疗急性肝损伤的有效药物具有十分重要的临床意义。
蓝莓(Vaccinium corymbosum L.),又名越橘,是越橘属的多年生落叶或常绿灌木,研究发现蓝莓具有抗氧化、清除自由基、抗癌、降血压、降血脂、降血糖等多种生物活性,在世界各地被广泛用作保健品[3-8]。目前对蓝莓的研究开发主要都是针对蓝莓果实,较少对蓝莓叶进行深入研究。前期研究发现,蓝莓叶含有丰富的黄酮类化合物,蓝莓叶总黄酮(flavonoids of blueberry leaf,FBL)具有良好的抗炎活性[9];同时研究发现,灌胃给予小鼠FBL后,小鼠肝脏血浆中FBL浓度较高。据此推测,FBL可能具有保肝作用。因此,本研究采用脂多糖(lipopolysaccharid,LPS)/氨基半乳糖(D-galactosamine,D-GalN)诱导的急性肝损伤小鼠模型,首次考察FBL对肝脏的保护作用,并探讨其可能的机制。
1 材料与方法
1.1 实验动物
SPF级昆明小鼠(南方医科大学实验动物研究中心提供)60只,雄性,体重18 g~22 g,许可证编号为SCKX(粤)2011-0015。实验动物每日自由摄取去离子水和标准词料,实验开始前适应性饲养一周。
1.2 材料与试剂
蓝莓叶:南京金瑞蓝莓专业合作社;脂多糖(lipopolysaccharide,LPS):广州赛国生物科技有限公司;D-GalN:东京化成工业株式会社(Tokyo Chemical Industry);D101 大孔树脂、白细胞介素-1β(IL-1β)试剂盒、白细胞介素-6(IL-6)试剂盒、肿瘤坏死因子-α(TNF-α)试剂盒、天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒、丙氨酸转氨酶(alanine aminotransferase,ALT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒:上海源业生物科技有限公司;石油醚、乙醇、氢氧化钠、盐酸(均为分析纯):天津市大茂化学试剂厂;实验用水均为超纯水。
1.3 主要仪器
Zokia HC-3018R型高速冷冻离心机:安徽中科中佳科学仪器公司;PL602-S型电子天平:上海梅特勒-托利多国际贸易有限公司;GC03型旋转蒸发器:上海申生科技有限公司;CA-1111型冷却水循环装置:上海爱朗仪器有限公司;A-1000S型水循环真空泵:上海埃朗科技国际贸易有限公司;KH-500DB型数控超声波清洗器:昆山禾创超声仪器有限公司:Thermo FC酶标仪:美国Thermo Fisher Scientific公司;JB-P5型石蜡包埋机:武汉俊杰电子有限公司;RM2016型切片机:上海徕卡仪器有限公司;KD-P组织摊片机:浙江省金华市科迪仪器设备有限公司;NIKON ECLIPSE CI正置光学显微镜、NIKONDS-U3成像系统:日本尼康(Nikon)公司。
1.4 试验方法
1.4.1 FBL的提取
将蓝莓叶打粉称重,加入20倍的石油醚回流提取0.5 h,过滤,除去滤液,收集滤渣,加入相等体积的70%乙醇回流提取1.5 h,过滤,取滤液弃滤渣,将滤液旋转蒸发浓缩至流浸膏状。
大孔树脂用95%乙醇浸泡1 d后装柱,再用95%的乙醇淋洗至无白色,分别用5%盐酸和2%氢氧化钠浸泡洗至中性。上述流浸膏湿法上样过大孔树脂柱,分别使用70%乙醇和95%乙醇冲柱子,收集不同乙醇浓度梯度的溶液。70%乙醇收集液为FBL。
1.4.2 动物给药及造模
120只小鼠随机分成6组,即空白组、模型组、阳性组(联苯双酯 5 mg/kg)及 FBL低(5 mg/kg)、中(10 mg/kg)、高(20 mg/kg)剂量组,各组灌胃给药,阳性组给予联苯双酯滴丸5 mg/kg,空白组和模型组给予等体积生理盐水,每天1次,连续7 d。最后一次给药2 h后,除空白组外,其余各组小鼠腹腔注射LPS(8 mg/kg)和D-GalN(800mg/kg)制备急性肝损伤模型。造模10h后每组10只动物取标本检测相关指标,留10只测定存活率。
1.4.3 样本采集及指标测定
1.4.3.1 小鼠生存情况及存活率的计算
观察并记录小鼠24 h内的生存情况,计数6、12、18 h和24 h各组的存活只数,并计算存活率。
1.4.3.2 样本采集
小鼠存活10 h后,摘眼球取血,分离血清,保存于-20℃备用。取肝脏组织,分成两部分,一部分浸泡在10%福尔马林中进行病理检查,另一部分保存于-80℃备用。
1.4.3.3 血清肝功能活性检测
为评价药物对LPS/D-GalN诱导的急性肝损伤小鼠肝功能的影响,测定取样3 h内的血清中AST和ALT的浓度水平,测定过程严格按照试剂盒说明书进行。
1.4.3.4 肝脏组织中炎症因子浓度的测定
取小鼠肝脏组织低温匀浆,离心取上清,采用酶联免疫吸附法(enzymelinkedimmunosorbentassay,ELISA)按照试剂盒说明要求检测IL-1β、IL-6和TNF-α水平,考察药物对LPS/D-GalN诱导的急性肝损伤小鼠炎症的调节作用。
1.4.3.5 肝脏组织氧化损伤
氧化损伤是LPS/D-GalN所致肝损伤的主要问题之一,因此,测量FBL治疗是否能改善LPS/D-GalN引发的氧化损伤。取小鼠肝脏组织匀浆并溶解在提取缓冲液中,测定MDA、GSH、SOD和CAT的水平,所有结果均通过每个样品中的总蛋白浓度进行标准化。
1.4.3.6 肝脏形态学观察
取小鼠肝脏右叶组织,放入10%甲醛中固定浸泡,常规石蜡包埋、切片、HE染色,光学显微镜观察肝脏组织切片病理学变化。
1.5 统计学分析
试验数据用SPSS统计软件进行分析。采用双尾t检验进行两组样本均数比较分析,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 小鼠存活率观察
各组小鼠24 h存活率结果见表1。LPS/D-GalN诱导的小鼠急性肝损伤模型死亡率很高,24 h的存活率为0。各给药组小鼠存活性均提高,其中FBL高剂量组存活率达到了80%,说明FBL能显著降低LPS/DGalN诱导产生的肝脏毒性。
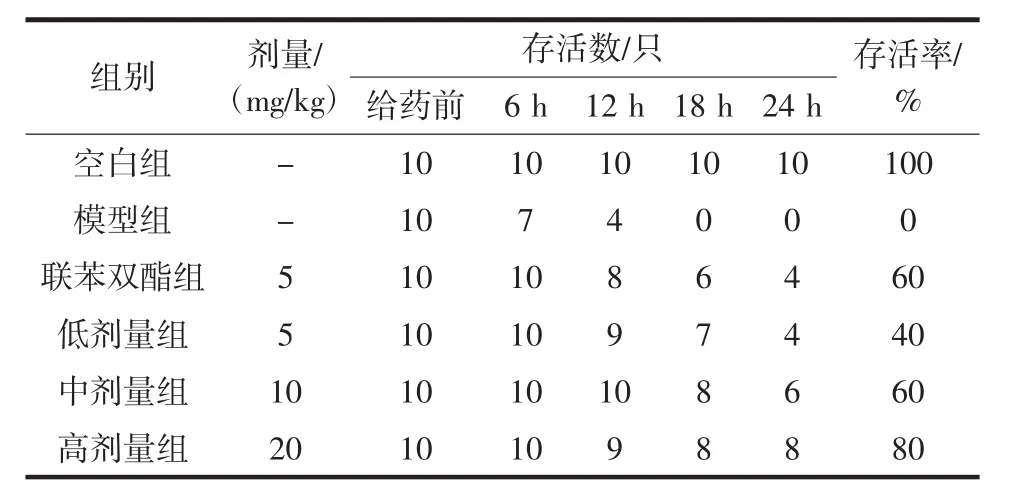
表1 各组小鼠24 h存活率Table 1 24-hour survival rate of mice in each group
2.2 血清肝功能活性检测
各组小鼠血清中AST和ALT测定结果见表2。与空白组比较,模型组小鼠血清AST和ALT水平均显著升高(P<0.01),说明LPS/D-GalN诱导致小鼠肝功能受损;与模型组比较,阳性药组小鼠血清AST和ALT水平均显著降低(P<0.01),同时FBL高剂量组和中剂量组AST和ALT水平均显著降低,而FBL低剂量组对AST和ALT水平无显著影响。上述结果说明FBL对小鼠肝功能有恢复作用。
表2 FBL对急性肝损伤小鼠血清AST和ALT水平的影响(±s,n=10)Table 2 Effects of FBL on the levels of ALT and AST in serum of mice with acute liver injury(±s,n=10)

表2 FBL对急性肝损伤小鼠血清AST和ALT水平的影响(±s,n=10)Table 2 Effects of FBL on the levels of ALT and AST in serum of mice with acute liver injury(±s,n=10)
注:和空白组比较,##表示P<0.01,差异极显著;和模型比较,*表示P<0.05,差异显著;**表示P<0.01,差异极显著;-表示给予生理盐水。
组别剂量/(mg/kg)AST/(IU/L)ALT/(IU/L)空白组 - 61.63±3.28** 46.44±5.85**模型组 - 692.42±66.36## 454.63±46.48##联苯双酯组 5 315.65±15.31##** 88.45±3.21##**低剂量组 5 630.87±34.01## 424.66±8.82##中剂量组 10 487.25±24.478##* 259.62±8.29##**高剂量组 20 378.29±28.77##** 106.21±7.32##**
2.3 肝脏组织中炎症因子浓度的测定
各组小鼠肝脏组织中炎症因子IL-1β、IL-6和TNF-α的浓度如表3所示。与空白组比较,模型组小鼠肝脏组织IL-1β、IL-6和TNF-α含量均显著升高(P<0.01),说明LPS/D-GalN诱导的急性肝损伤小鼠伴随有炎症的发生;与模型组比较,联苯双酯组小鼠肝脏组织中IL-1β、IL-6和TNF-α水平均显著降低(P<0.01);与模型组比较,FBL低、中、高剂量组IL-1β水平均显著降低(P<0.01),且呈剂量依赖关系,同时,FBL低、中、高剂量组IL-6和TNF-α水平均显著降低,说明阳性药物和FBL均对炎症有抑制作用。
表3 FBL对急性肝损伤小鼠肝组织中IL-1β、IL-6和TNF-α含量的影响(±s,n=10)Table 3 Effects of FBL on levels of IL-1β,IL-6 and TNF-α in liver of mice with acute liver injury(±s,n=10)
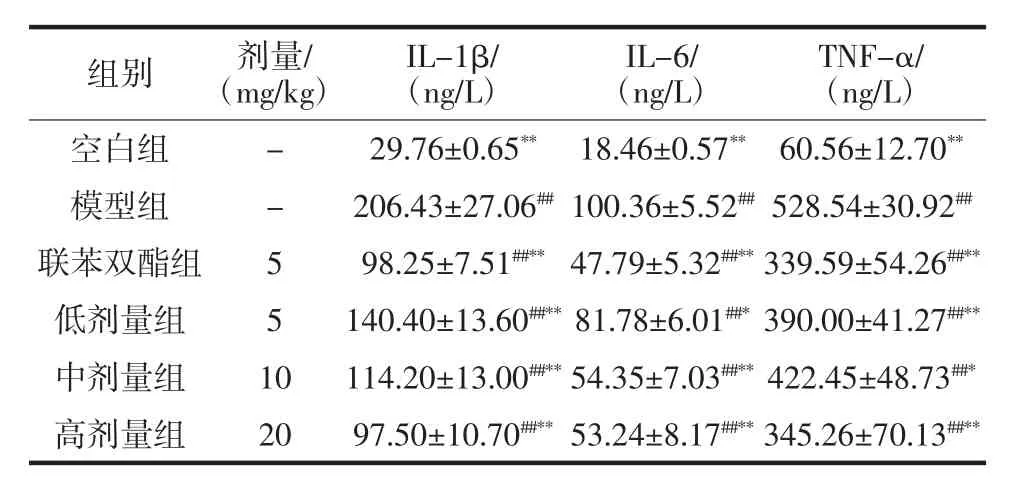
表3 FBL对急性肝损伤小鼠肝组织中IL-1β、IL-6和TNF-α含量的影响(±s,n=10)Table 3 Effects of FBL on levels of IL-1β,IL-6 and TNF-α in liver of mice with acute liver injury(±s,n=10)
注:和空白组比较,##表示P<0.01,差异极显著;和模型比较,*表示P<0.05,差异显著;**表示P<0.01,差异极显著;-表示给予生理盐水。
组别 剂量/(mg/kg)IL-1β/(ng/L)IL-6/(ng/L)TNF-α/(ng/L)空白组 - 29.76±0.65** 18.46±0.57** 60.56±12.70**模型组 - 206.43±27.06##100.36±5.52##528.54±30.92##联苯双酯组 5 98.25±7.51##**47.79±5.32##**339.59±54.26##**低剂量组 5 140.40±13.60##**81.78±6.01##*390.00±41.27##**中剂量组 10 114.20±13.00##**54.35±7.03##**422.45±48.73##*高剂量组 20 97.50±10.70##**53.24±8.17##**345.26±70.13##**
2.4 肝脏组织氧化损伤测定
肝脏组织氧化损伤测定结果如表4所示。与空白组比较,模型组中MDA的浓度显著增加,说明LPS/GalN显著增加了MDA的过度积累(P<0.01),而MDA是自由基损伤的标志。同时,与空白组比较,模型组中GSH、SOD和CAT的浓度显著降低(P<0.01),表明肝脏具有抗氧化能力。与模型组比较,FBL治疗有效地逆转了LPS/D-GalN引起的氧化损伤,其中FBL高中剂量组逆转作用更显著(P<0.01)。上述结果表明FBL可通过抑制氧化应激缓解LPS/D-GalN所致急性肝损伤。
2.5 肝脏形态学观察
各组小鼠肝脏组织典型切片图见图1。空白组小鼠肝脏外观色淡,边缘滑润,质韧;镜下见细胞大小均一,排列整齐,结构完整,细胞核位于肝细胞中央。模型组肝脏外观颜色暗红,有明显肿胀、淤血;镜下见肝脏组织病理损伤严重,肝细胞变性、胞浆内充满小空泡,且有明显的肝脏出血和炎症细胞浸润。经FBL给药后,小鼠肝脏的外观及颜色呈现明显的好转,病理检查显示肝细胞间隙减小,高剂量组充血和炎细胞浸润状况明显改善,接近于恢复正常。
表4 FBL对急性肝损伤小鼠肝组织中MAD、GSH、SOD和CAT含量的影响(±s,n=10)Table 4 Effects of FBL on levels of MAD,GSH,SOD and CAT in liver of mice with acute liver injury(±s,n=10)

表4 FBL对急性肝损伤小鼠肝组织中MAD、GSH、SOD和CAT含量的影响(±s,n=10)Table 4 Effects of FBL on levels of MAD,GSH,SOD and CAT in liver of mice with acute liver injury(±s,n=10)
注:和空白组比较,#表示P<0.05,差异显著;##表示P<0.01,差异极显著;和模型比较,*表示P<0.05,差异显著;**表示P<0.01,差异极显著;-表示给予生理盐水。
组别剂量/(mg/kg)MAD/(nmol/mg ptrotein)GSH/(μmol/g protein)SOD/(U/mg protein)CAT/(U/g protein)空白组 - 6.22±1.56** 16.34±4.01** 57.31±8.34** 956±102.3**模型组 - 18.51±3.06## 7.16+1.86## 24.75±5.40## 446±44.71##联苯双酯组 5 9.71±2.62#** 14.59±3.15** 50.88±7.43#** 901±88.94#**低剂量组 5 14.12±3.58##* 9.98±2.71##* 31.43±5.77##* 645±59.31##**中剂量组 10 12.99±2.81##** 12.72±3.2#** 53.31±7.45** 792±60.41##**高剂量组 20 9.45±2.36#** 14.63±2.94** 60.26±8.41** 923±81.45**
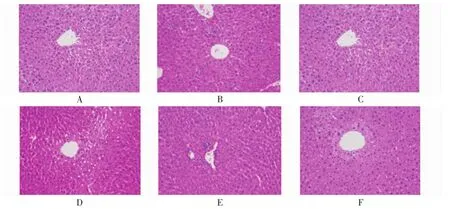
图1 FBL对急性肝损伤小鼠肝脏组织病理学的影响(HE,×200)Fig.1 Effect of blueberry leaf flavonoids on liver histopathology in acute liver injury mice(HE,×200)
3 讨论与结论
在前期的研究中,通过超高效液相色谱/四极飞行时间质谱(UPLC/Q-Tof-MS)鉴定了蓝莓叶中的黄酮类化合物[9]。9种主要成分分别为杨梅素、芦丁、鸢尾苷、槲皮素、有毒异黄酮、山奈酚、杨梅素-3′-鼠李糖苷和3,3′,4′,5,7-五羟基-6-(4-羟基苄基)-黄烷酮、花青素-3-(6′-丙二酰葡萄糖苷)。
LPS/D-GalN诱导的急性肝损伤是一种典型的药物性肝损伤,与炎症反应和氧化应激有关,是评价药物肝保护作用的常用实验模型[10-11]。LPS是革兰氏阴性细菌细胞壁外壁的组成成分,是一种内毒素,在肝脏组织中LPS与其结合蛋白结合成复合物,通过存在于目标细胞的细胞膜中的TLR4释放炎症因子,从而使肝细胞发生凋亡与坏死。D-GalN可通过消耗肝脏中的三磷酸尿苷,抑制生物大分子合成,引起肝脏炎症反应和肝细胞坏死。LPS对肝脏损伤的特异性不高,和D-GalN协同作用可导致动物的肝细胞在短时间内大量死亡,肝脏生理功能严重受损[12-13]。本研究显示,FBL可延长急性肝损伤小鼠的生存率和存活时间,改善肝脏组织的形态,降低血清中AST和ALT水平,说明FBL对肝脏有保护作用。
本研究结果显示模型组肝脏组织中炎症因子IL-1β、IL-6及TNF-α含量较空白组显著升高,而这一现象能被FBL有效抑制,提示FBL对肝脏的保护作用与其抗炎作用相关。炎性细胞因子的产生主要受核因子kappa-B(NF-κB) 的调控,NF-κB 与其抑制性蛋白(IκB)结合,在肝细胞胞浆中以非活性形式存在。促炎性细胞因子、病毒等及其他因子,可触发NF-κB的活化,催化IκB的磷酸化,进而IκB/NF-κB复合物解离,导致NF-κB转运至细胞核从而促进IL-1β、IL-6和TNF-α等炎性细胞因子的表达[14]。前期研究表明,FBL能够显著降低LPS诱导的RAW 264.7细胞中NF-κBp65 和 P-NF-κBp65 的表达[9]。FBL 对 LPS/D-GalN诱导的细胞凋亡的保护作用可能与抑制NF-κB信号通路有关,值得进一步研究。
有研究指出,在急性肝脏损伤的发生及进展过程中,肝脏内氧化还原稳态失衡产生严重的氧化应激,进而导致或者促进损伤的发生,因此氧化损伤参与了急性肝损伤的发生和发展[15-16]。MDA是脂质过氧化的最终产物,其水平被广泛用作自由基介导的脂质过氧化损伤的标志物[17-18]。经LPS/D-GalN诱导后,产生大量过氧化氢,GSH过氧化物酶(GPx)利用两分子的GSH催化过氧化氢的还原[19-20]。因此,在LPS/D-GalN过量的作用下,GSH在肝脏中被过度消耗。同时,由于酶和非酶的抗氧化机制是抗氧化损伤的重要防御途径,还测定了抗氧化酶CAT和SOD的肝活性。本研究表明,模型小鼠肝脏组织中MDA水平显著升高,而GSH、CAT和SOD的水平显著降低,FBL能有效地抑制这些变化,说明FBL的保肝作用与其抗氧化活性有关。
综上所述,本文的研究结果初步证明了蓝莓叶总黄酮对LPS/D-GalN诱导小鼠的急性肝损伤具有明确的预防与保护作用,其作用机制可能是抑制氧化应激反应及炎症反应的发生,从而预防和阻止肝损伤。

