岭南山竹子醇提物对LPS致RAW264.7细胞炎性损伤的保护作用研究
黄雷 刘美琼 张小曼 苏少锋 邹小琴 钟小斌 冯洁
中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)14-1719-07
DOI 10.6039/j.issn.1001-0408.2020.14.11
摘 要 目的:探讨岭南山竹子70%乙醇提取物(GOEE)对脂多糖(LPS)致RAW264.7细胞炎性损伤的保护作用及其潜在分子机制。方法:取岭南山竹子果皮用70%乙醇回流提取,制得GOEE。采用Folin-Ciocalteau法和紫外-可见分光光度法分别测定GOEE中总多酚和总黄酮的含量。采用MTT法检测不同剂量GOEE的细胞毒性;以LPS诱导小鼠单核巨噬细胞RAW264.7建立炎症模型,分别以地塞米松、N-乙酰基-L-半胱氨酸为阳性对照,采用Griess法和2′,7′-二氯荧光素法检测细胞培养液中一氧化氮(NO)和细胞中活性氧(ROS)的含量;采用酶联免疫吸附测定(ELISA)法测定细胞培养液中肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)和IL-1β水平;采用Western blotting法测定细胞中p65蛋白(p65)、磷酸化p65(p-p65)、核因子κB抑制蛋白α(IκBα)、磷酸化IκBα(p-IκBα)、血红素加氧酶-1(HO-1)以及细胞核内核因子E2相关因子2(NRF2)蛋白的表达水平。结果:GOEE中总多酚与总黄酮的含量分别为(20.191±1.264)、(12.571±0.020)mg/g。当剂量≤500 μg/mL时,GOEE对RAW264.7细胞存活率无显著影响(P>0.05)。与对照组比较,LPS模型组NO、ROS含量,TNF-α、IL-6、IL-1β水平,p-p65/p65和p-IκBα/IκBα比值以及NRF2蛋白的表达水平均显著升高(P<0.05或P<0.01)。与LPS模型组比较,阳性对照组和GOEE各处理组细胞NO(除GOEE 50 μg/mL处理组外)、ROS含量,TNF-α、IL-6、IL-1β水平以及p-p65/p65和p-IκBα/IκBα比值均显著降低,HO-1、NRF2蛋白的表达水平均显著升高(P<0.05或P<0.01)。结论:GOEE可通过抑制炎症反应、抑制核因子κB通路磷酸化、促进NRF2蛋白入核等途径来减轻LPS诱导的小鼠巨噬细胞炎性损伤。
关键词 岭南山竹子;果皮;醇提物;抗炎作用;核因子κB;核因子E2相关因子2;小鼠巨噬细胞;RAW264.7
Study on Protective Effects of the Ethanol Extract of Garcinia oblongifolia on LPS-induced RAW264.7 Cell Inflammatory Injury
HUANG Lei1,2,LIU Meiqiong2,ZHANG Xiaoman2,SU Shaofeng2,ZOU Xiaoqin3,ZHONG Xiaobin1,FENG Jie2 (1. Dept. of Pharmacy, Langdong Hospital of Guangxi Medical University, Nanning 530029, China; 2. TCM Teaching and Research Section, School of Pharmaceutical Sciences, Guangxi Medical University, Nanning 530021, China; 3. Dept. of Scientific Research, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China)
ABSTRACT OBJECTIVE: To investigate the anti-inflammatory activity of 70%ethanol extracts from Garcinia oblongifolia (GOEE) on LPS-induced RAW264.7 cells and its potential molecular mechanism. METHODS: GOEE was obtained after the fresh G. oblongifolia epicarp refluxed with 70% ethanol. The contents of total phenol and total flavonoids were determined by Folin-Ciocalteau assay and UV spectrophotometer. MTT assay was used to detect the cytotoxicity of different doses of GOEE. The inflammatory model was induced in RAW264.7 cells by lipopolysa- ccharide (LPS). Using dexamethasone and N-acetyl-L-cysteine as positive control, Griess assay and 2′, 7′-dichloro- fluorescein assay were used to detect the contents of NO in cell culture medium and ROS in cells. The levels of TNF-α, IL-6, and IL-1β in cell culture medium were measured by ELISA. The protein expression of p65, p-p65, IκBα, p-IκBα, HO-1 in cells and NRF2 in nucleus were determined by using Western blotting assay. RESULTS: The contents of total phenol and flavonoids in GOEE were (20.191±1.264)and (12.571±0.020)mg/g, respectively. At the concentration below 500 μg/mL, GOEE had no significantly effect on survival rate of RAW264.7 cells (P>0.05). Compared with control group, the contents of NO and ROS, the levels of TNF-α, IL-6 and IL-1β, ratio of p-p65 to p65, ratio of p-IκBα to IκBα, protein expression of NRF2 were increased significantly in LPS model group (P<0.05 or P<0.01). Compared with LPS model group, the contents of NO (except for GOEE 50 μg/mL group) and ROS, the levels of TNF-α, IL-6 and IL-1β, ratio of p-p65 to p65 and ratio of p-IκBα to IκBα were decreased significantly in GOEE groups and positive control groups, while protein expression of HO-1 and NRF2 were increased significantly (P<0.05 or P<0.01). CONCLUSIONS: GOEE attenuates LPS-induced macrophages inflammation injury by inhibiting the inflammatory response and the phosphorylation of NF-κB pathway, promoting NRF2 protein transportation to the nucleus.
KEYWORDS Garcinia oblongifolia; Epicarp; Ethanol extract; Anti-inflammatory effect; NF-κB; NRF2; Mice macrophage; RAW264.7
炎症是机体抵御感染和组织损伤的一种防御机制,许多慢性炎症性疾病(如糖尿病、动脉粥样硬化等)可能是由于过度的炎症反应所引起的[1]。当各种内在或外在的刺激导致巨噬细胞过度活化时,炎症细胞被激活并维持免疫反应。因此,调节巨噬细胞活化可能将有利于许多炎症性疾病的治疗。脂多糖(LPS)是革兰氏阴性菌细胞壁的内毒素,通常用于诱导小鼠单核巨噬细胞以建立炎症模型[2]。LPS还可使核因子κB(NF-κB)活化,活化的NF-κB可进一步诱导促炎细胞因子的产生,包括肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和IL-1β。而促炎细胞因子能够刺激机体产生过量的活性氧(ROS),从而打破机体内氧化与抗氧化之间的平衡,造成氧化应激[3]。若机体长时间处于氧化应激状态,可进一步诱导细胞凋亡、组织坏死[4]。核因子E2相关因子2(NRF2)是调节氧化应激的关键蛋白,有文献报道,激活NRF2可保护机体免受急性肺损伤、急性肝衰竭等各种炎症性疾病的侵害[5-6]。因此,NRF2与NF-κB一同作为炎症性疾病的潜在治疗靶标引起了学者的广泛关注[7]。
岭南山竹子(Garcinia oblongifolia Champ. ex Benth.)属于藤黄科藤黄属植物,主要分布于我国广西、广东地区。据文献报道,从岭南山竹子的树皮中分离出来的Garcinone C、Griffipavixanthone、Oblongifolin M、Norcowanin等化合物具有抗肿瘤、抗糖尿病和抗病毒等活性[8-11]。然而,国内外现有研究主要集中于岭南山竹子的树皮与树叶,且多为简单的活性成分研究。由于民间主要是以岭南山竹子的果皮入药以消炎镇痛,有关该药果皮化学成分的研究仅有1篇报道[12],而有关其药理作用尤其是抗炎抗氧化活性的研究等尚未见相关报道。为此,本研究以LPS诱导小鼠单核巨噬细胞RAW264.7建立炎症细胞模型,通过检测一氧化氮(NO)、ROS的含量以及促炎细胞因子、炎症介质等炎性靶标表达水平的变化,初步探讨岭南山竹子70%乙醇提取物(GOEE)的抗炎活性及其潜在的分子机制,旨在为治疗炎症性疾病提供更多的候选药物。
1 材料
1.1 仪器
EL204型电子分析天平(瑞士Mettler Toledo公司);TV-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司);WIX-miniPRO4型迷你垂直电泳槽(北京韦克斯科技有限公司);Odyssey型双色红外激光成像系统(美国LI-COR公司);SpectraMax Plus384型连续光谱扫描式酶标仪(美国Molecular Devices公司);SynergyTM H1全功能酶标仪(美国BioTek公司);R-1001N型旋转蒸发仪(郑州长城科工贸易有限公司);ACB-4A1型超净工作台(新加坡ESCO公司);3111型CO2培养箱(美国Thermo Fisher Scientific公司)。
1.2 药品与试剂
新鲜岭南山竹子于2017年7月采集于广西壮族自治区北海市,经广西医科大学冯洁教授鉴定为藤黄科藤黄属岭南山竹子(G. oblongifolia Champ. ex Benth.)的新鲜果实。药材标本(编号:GB20170728)保存于广西医科大学药学院。
LPS(美国Sigma公司,批号:L2880);NO试剂盒(南京建成生物工程研究所,批号:20181007);TNF-α、IL-6、IL-1β酶联免疫吸附测定(ELISA)试剂盒(上海源叶生物科技有限公司,批号:CK-E20220M、CK-E20012M、CK-E20533M);兔源磷酸化p65(p-p65)、磷酸化核因子κB抑制蛋白α(p-IκBα)多克隆抗体(美国ABclonal Technology公司,批号:AP0124、AP0614);兔源IκBα、p65、NRF2、血红素加氧酶1(HO-1)、核纤层蛋白B(Lamin B)多克隆抗体和小鼠源甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(美国Proteintech Group公司;批号:10268-1- AP、10745-1-AP、16396-1-AP、10701-1-AP、12987-1-AP、6004-1-1g);胎牛血清(美国Gemini公司,批号:A87F82H);高糖DMEM培养基(美国Gibco公司,批号:8118048);兔源免疫球蛋白G(IgG)(H+L)荧光二抗、小鼠源IgG (H+L)荧光二抗(美国CST公司,批号:5366P、5257P);N-乙酰基-L-半胱氨酸(NAC)对照品(抗氧化剂,纯度:≥99%)、ROS试剂盒[含2′,7′-二氯二氫荧光素二乙酸酯(DCFH-DA)等试剂]、胞核胞浆蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、Loading Buffer上样缓冲液(碧云天生物技术研究所,批号:S0077、S0033、P0027、P0012、P0015);地塞米松磷酸钠注射液(DEX,阳性对照,国药集团容生制药有限公司,批号:1801207,规格:1 mL ∶ 2 mg);MTT、二甲基亚砜(DMSO)、芦丁对照品(纯度:≥99%)、青链霉素双抗(北京索莱宝科技有限公司,批号:M8180、D8370、YZ-10080、20180418);没食子酸对照品(中国食品药品检定研究院,批号:110831- 201906,纯度:≥99%);其余试剂均为分析纯,水为超纯水。
1.3 细胞株
小鼠单核巨噬细胞RAW264.7购自中国科学院上海细胞库。
2 方法
2.1 GOEE的制备
取新鲜岭南山竹子果皮(80 g)切成片,用70%乙醇(0.8 L)回流提取3次,每次2.5 h。将提取液过滤并减压浓缩后,冷冻干燥,即得到GOEE冻干品5.26 g,得率为6.58%。
2.2 GOEE中总多酚与总黄酮的含量测定
采用Folin-Ciocalteau法[13]测定GOEE中的总多酚含量,以没食子酸为指标,结果以没食子酸含量表示;采用NaNO2-Al(NO3)3-NaOH法[14]测定GOEE中总黄酮的含量,以芦丁为指标,使用紫外-可见分光光度计在500 nm波长处检测样品含量,方法学考察内容及其结果见相关文献[13-14]。每样品均重复测定3次。
2.3 细胞培养
将对数生长期的细胞接种于含10%胎牛血清、1%青链霉素双抗的高糖DMEM培养基中,并置于5%CO2、37 ℃的培养箱中培养(培养条件下同)。
2.4 GOEE对LPS诱导RAW264.7细胞的毒性研究
采用MTT法检测。取对数生长期的RAW264.7细胞以5×104个/mL接种于96孔板中,每孔100 μL。将细胞随机分为对照组(0.5%DMSO)、LPS模型组(1 μg/mL,剂量设置参考前期预试验结果,下同)和GOEE处理组(15.625、31.25、62.5、125、250、500、1 000 ?g/mL GOEE+1 μg/mL LPS,GOEE以生药量计,剂量设置参考前期预试验结果),每组设4个复孔。除对照组外,其余各组均与LPS共孵育30 min后,再与药物混合培养。培养24 h后,每孔加入MTT溶液(5 mg/mL)20 ?L,培养4 h,吸弃上清液,每孔加入DMSO 150 ?L,避光振摇10 min,采用连续光谱扫描式酶标仪在490 nm波长处测量各孔的吸光度值,并计算各组细胞的存活率:细胞存活率(%)=试验组吸光度值/对照组吸光度值×100%。上述试验重复3次。
2.5 NO含量检测
采用Griess法检测。取对数生长期的RAW264.7细胞以4×105个/mL接种于96孔板中,每孔100 μL。将细胞随机分为对照组(0.5%DMSO)、LPS模型组(1 μg/mL)、DEX处理组(阳性对照,0.2 μg/mL DEX+1 μg/mL LPS,DEX剂量设置参考前期预试验结果,下同)和GOEE处理组(50、100、150、200、300 μg/mL GOEE+1 μg/mL LPS,GOEE剂量参考“2.4”项下结果),每组设4个复孔。按“2.4”项下方法培养24 h后,收集各孔细胞培养液,以1 000 r/min离心5 min,取上清液,采用连续光谱扫描式酶标仪于550 nm波长处检测细胞培养液中NO的含量。严格按照试剂盒说明书操作,上述试验重复3次。
2.6 ROS含量检测
采用2′,7′-二氯荧光素(DCF)法检测。取对数生长期的RAW264.7细胞以4×105个/mL接种于96孔板中,每孔100 μL。将细胞随机分为对照组(0.5%DMSO)、LPS模型组(1 μg/mL)、NAC处理组(抗氧化剂,10 mmol/L NAC+1 μg/mL LPS,NAC剂量设置参考前期预试验结果)和GOEE处理组(50、100、150、200、300 μg/mL GOEE+1 μg/mL LPS),每组设4个复孔。按“2.4”项下方法培养24 h后,吸弃培养液,将细胞与DCFH-DA(10 mmol/L)100 μL孵育30 min,采用全功能酶标仪于激发波长488 nm、发射波长525 nm处检测ROS与DCFH-DA反应产物(DCF)的荧光强度,并以此表示ROS的含量。严格按照试剂盒说明书操作,上述试验重复3次。
2.7 TNF-α、IL-6、IL-1β水平检测
采用ELISA法检测。取对数生长期的RAW264.7细胞以2×105个/mL接种于6孔板中,每孔1 mL。将细胞随机分为对照组(0.5%DMSO)、LPS模型组(1 μg/mL)、DEX处理组(0.2 μg/mL DEX+1 μg/mL LPS)和GOEE处理组(100、200、300 μg/mL GOEE+1 μg/mL LPS,GOEE剂量参考前文结果,下同),每组设4个复孔。按“2.4”项下方法培养24 h后,收集各孔细胞培养液,以1 000 r/min离心5 min,取上清液,采用ELISA法以连续光谱扫描式酶标仪于450 nm波长处检测细胞培养液中TNF-α、IL-6、IL-1β水平。严格按照试剂盒说明书操作,上述试验重复3次。
2.8 相关蛋白表达水平检测
采用Western blotting法检测。取对数生长期的RAW264.7细胞以4×105个/mL接种于96孔板中,每孔100 μL。将细胞随机分为对照组(0.5%DMSO)、LPS模型组(1 μg/mL)、DEX处理组(0.2 μg/mL DEX+1 μg/mL LPS;检测NRF2信号通路相关蛋白HO-1、NRF2表达时不设该组)和GOEE处理组(100、200、300 μg/mL GOEE+1 μg/mL LPS),每组设4个复孔。培养1 h后,吸弃培养液。分别按试剂盒说明书提取细胞总蛋白(用以检测p-p65、p65、p-IκBα、IκBα、HO-1蛋白的表达)和细胞核蛋白(用以检测NRF2蛋白的表达),用BCA蛋白浓度测定试剂盒进行蛋白浓度测定,以磷酸盐缓冲液(PBS,pH 7.4)稀释至相应浓度。取上述蛋白,加入5×Loading Buffer上样缓冲液适量,煮沸变性;取变性蛋白样品50 μg,于80 V条件下行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳后于100 mA下濕法转膜,用5%脱脂奶粉室温封闭1 h,然后分别加入p-p65抗体(1 ∶ 500)、p-IκBα抗体(1 ∶ 500)、p65抗体(1 ∶ 1 000)、IκBα抗体(1 ∶ 1 000)、NRF2抗体(1 ∶ 500)、HO-1抗体(1 ∶ 1 000)、Lamin B抗体(1 ∶ 1 000)、GAPDH抗体(1 ∶ 3 000),4 ℃孵育过夜;用TBST溶液清洗10 min×3次,加入相应二抗(除GAPDH为小鼠源二抗外,其余均为兔源二抗,稀释度均为1 ∶ 10 000),室温下避光孵育1 h,以TBST溶液清洗10 min×3次。于双色红外激光成像系统上成像,并通过Image J2 v5.2.5软件分析,以p-p65和p65、p-IκBα和IκBα灰度值的比值(p-p65/p65、p-IκBα/IκBα比值)来表示p65、IκBα的磷酸化水平,以目标蛋白与内参(HO-1以GAPDH为内参,NRF2以Lamin B为内参)的灰度值比值来表示其表达水平。上述试验重复3次。
2.9 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以x±s表示,采用单因素方差分析进行多组间比较,采用LSD-t检验进行组间两两比较。P<0.05为差异有统计学意义。
3 结果
3.1 总多酚和总黄酮的含量测定结果
以没食子酸当量计算GOEE中总多酚的含量,根据标准曲线方程Y=0.111 6X+0.018 0(R 2=0.999 0)计算出总多酚含量为(20.191±1.264)mg/g(n=3)。以芦丁当量计算GOEE中总黄酮的含量,根据标准曲线方程Y=0.012 7X-0.017 6(R 2=0.999 4)计算出总黄酮含量为(12.571±0.020)mg/g(n=3)。
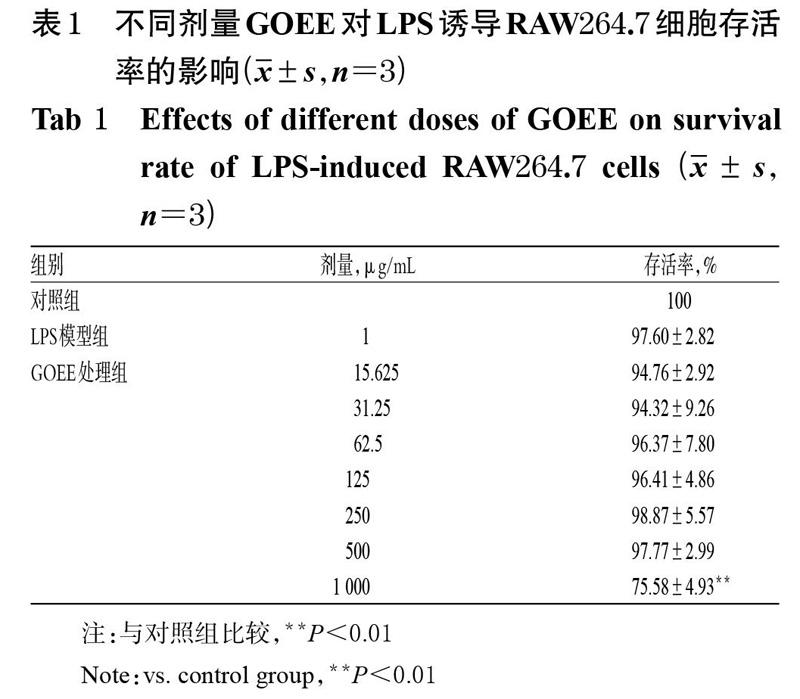
3.2 GOEE对LPS诱导RAW264.7细胞存活率的影响
LPS模型组细胞存活率与对照组比较,差异无统计学意义(P>0.05)。与对照组比较,GOEE 1 000 ?g/mL组细胞存活率显著降低(P<0.01),而当GOEE剂量≤500 ?g/mL时,各剂量组细胞存活率与对照组比较差异均无统计学意义(P>0.05),详见表1。根据上述结果,本研究选择GOEE剂量范围为0~500 ?g/mL进行后续试验。
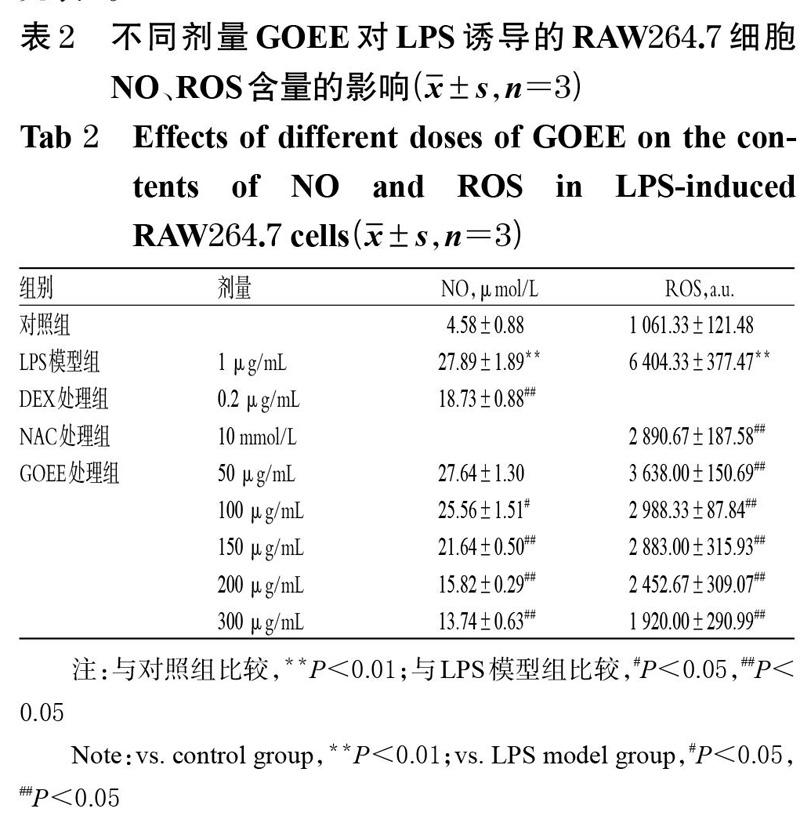
3.3 GOEE对LPS诱导RAW264.7细胞NO、ROS含量的影响
LPS模型组细胞培养液中NO的含量约为对照组的6.09倍,组间比较差异有统计学意义(P<0.01);与LPS模型组比较,DEX处理组和GOEE 100、150、200、300 μg/mL处理组细胞培养液中NO的含量均显著降低(P<0.05),且随着剂量的增加,NO含量有减少的趋势。与对照组比较,LPS模型组细胞中ROS的含量显著升高(P<0.01);与LPS模型组比较,NAC处理组与GOEE各处理组ROS的含量均显著降低(P<0.05或P<0.01),详见表2。
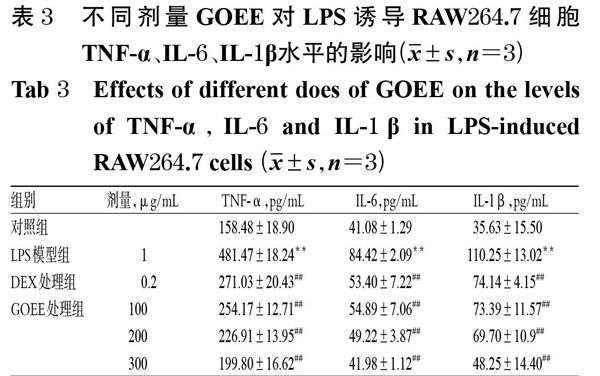
3.4 GOEE对LPS诱导RAW264.7细胞TNF-α、IL-1β、IL-6水平的影响
与对照组比较,LPS模型组细胞培养液中TNF-α、IL-6、IL-1β水平均显著升高(P<0.05)。与LPS模型组比较,DEX处理组和GOEE各处理组细胞培养液中TNF-α、IL-6、IL-1β水平均显著降低(P<0.05),详见表3。
3.5 GOEE对LPS诱导RAW264.7细胞NF-κB活化的影响
与对照组比较,LPS模型组细胞中p-p65/p65和p-IκBα/IκBα比值均显著升高(P<0.01);与LPS模型组比较,DEX处理组和GOEE各处理组细胞中p-p65/p65和p-IκBα/IκBα比值均显著降低(P<0.05或P<0.01),详见图1A、表4。
3.6 GOEE对LPS诱导RAW264.7细胞NRF2、HO-1 蛋白表达的影响
与对照组比较,LPS模型组细胞核中NRF2蛋白的表达水平显著升高(P<0.05);与LPS模型组比较,GOEE各处理组细胞中HO-1蛋白和细胞核中NRE2蛋白的表达水平均显著升高(P<0.05或P<0.01),详见图1B、表4。
4 讨论
岭南山竹子是一种民间传统用药,主要用于炎症性不适。其相关文献报道多集中于其树皮及树叶,但民间多用果皮入药。为此,本文主要研究了GOEE在LPS诱导RAW264.7细胞中的抗炎药理活性及其潜在分子机制。
炎症反应通常由NO、ROS和炎症细胞因子(包括TNF-α、IL-1β和IL-6)等介导,而炎症细胞因子受NF-κB信号通路的调节。在正常情况下,NF-κB以异二聚体形式与IκBα结合于细胞质中;LPS能够激活NF-κB信号通路,导致IκBα降解,之后NF-κB易位至细胞核诱导炎症[15]。因此,通过抑制IκBα降解来下调NF-κB的表达可能是抗炎药物的研究路线之一。据报道,NRF2信号通路与NF-κB通路具有交叉效应,炎症产生的过量ROS会导致氧化应激,而NRF2信号通路是抗氧化应激反应中最重要的途径,该通路被激活后可诱导抗氧化蛋白HO-1等产生,以对抗机体的氧化应激,从而保护正常细胞免受氧化应激的损害[16]。
NO是炎症反应中传递信号的信息分子,是与炎症疾病有关的炎症介质之一[17]。本研究结果表明,GOEE显著抑制了NO的产生,表明了GOEE能够通过阻断炎症信号的传递来发挥抗炎作用。在LPS诱导的RAW264.7细胞炎症模型中,包括TNF-α、IL-1β和IL-6在内的促炎细胞因子的水平均显著升高,提示其促进了炎症的发展。因此抑制促炎细胞因子的产生是治疗炎症性疾病的主要策略之一,这些炎症因子的表达主要受NF-κB转录因子调控。本研究首先通过MTT法筛选出安全剂量范围,从此范围中根据预试验结果设置给药剂量,并以DEX作为抗炎研究的阳性对照,以NAC作为ROS测定的阳性對照。由于DEX对NRF2信号通路无影响,因此在进行抗氧化研究时未设DEX组。本研究结果表明,GOEE可抑制NF-κB中的关键蛋白IκBα和p65的磷酸化,从而抑制NF-κB信号通路的表达及其在下游转录的促炎细胞因子表达。有研究表明,在LPS诱导的肺部炎症中,NRF2基因敲除小鼠的TNF-α、IL-1β和IL-6的表达高于未敲除小鼠;进一步研究表明,NRF2基因敲除小鼠的NF-κB p65与DNA有更强的结合活性[18]。说明NRF2编码基因的缺失能够加重炎症反应。HO-1的上调会促进其衍生代谢产物(如CO、胆红素等)的产生,这些代谢产物不仅具有抗氧化活性,还具有抗炎作用[19-21]。本研究结果表明,GOEE抑制了ROS和NO的产生。本研究检测了细胞核内NRF2的表达情况,发现LPS能够诱导NRF2入核,GOEE能进一步促进NRF2入核,并且上调NRF2调控的抗氧化酶HO-1的表达。这表明GOEE还能通过上调NRF2与HO-1抑制了LPS诱导的巨噬细胞炎症反应。同时,本研究通过测量GOEE中总黄酮与总多酚的含量发现,GOEE中总多酚的含量远高于总黄酮的含量。酚羟基中的邻位酚羟基易被氧化,是良好的抗氧化剂;同时,酚羟基还可以提供活泼氢,使活性氧等自由基灭活,本身被氧化形成含有邻二酚结构的自由基而稳定存在[22]。因而推测可能是GOEE中多酚类物质发挥了抗氧化与抗炎作用,但有待后续研究予以确证。
[13] LI Y,FENG J,MO YQ,et al. Concordance between cardioprotective effect on isoproterenol-induced acute myocardial ischemia and phenolic content of different extracts of Curcuma aromatica[J]. Pharmaceutical Biology,2016,54 (12):1-6.
[14] 陆应彩,卯明霞,彭霞,等.肾茶总黄酮的含量测定[J].中国民族民间医药,2018,27 (11):41-45.
[15] KIM J,KIM H,CHOI H,et al. Anti-Inflammatory Effects of a Stauntonia hexaphylla fruit extract in lipopolysaccharide-activated RAW-264.7 macrophages and rats by carrageenan-induced hind paw swelling[J]. Nutrients,2018,10 (1):110-121.
[16] LI W,KHOR TO,XU CJ,et al. Activation of Nrf2-antioxidant signaling attenuates NFkappaB-inflammatory response and elicits apoptosis[J]. Biochem Pharmacol,2008,76 (11):1485-1489.
[17] COLEMAN JW. Nitric oxide:a regulator of mast cell activation and mast cell-mediated inflammation[J]. Clin Exp Immunol,2002,129 (1):4-10.
[18] THIMMULAPPA RK,LEE H,RANGASAMY T,et al. Nrf2 is a critical regulator of the innate immune response and survival during experimental sepsis[J]. J Clin Investi,2006,116 (4):984-995.
[19] SUN BW,ZOU XQ,CHEN YL,et al. Preconditioning of carbon monoxide releasing molecule-derived CO attenuates LPS-induced activation of HUVEC[J]. Int J Biol Sci,2008,4 (5):270-278.
[20] LILLJEBJORN LV,CSIZMADIA E,HEDBLOM A,et al. A role of the heme degradation pathway in shaping prostate inflammatory responses and lipid metabolism[J]. Am J Pathol,2020. DOI:10.1016/j.ajpath.2019.12.008.
[21] YAO Q,HUANG ZW,ZHAI YY,et al. Localized controlled release of bilirubin from β-cyclodextrin-conjugated ε-polylysine to attenuate oxidative stress and inflammation in transplanted islets[J]. ACS Appl Mater Interface,2020,12 (5):5462-5475.
[22] 李佩儒,周春陽,张译,等.洋葱醇提物总多酚含量及其抗氧化活性研究[J].中国药业,2019,28(9):21-24.
(收稿日期:2019-12-13 修回日期:2020-05-13)
(编辑:罗 瑞)

