基于UHPLC-Q-TOF-MS/MS技术鉴定藤梨根的化学成分
陈方超 高守红 王志鹏 杨宏 顺庆生 宋新华 徐一新
中圖分类号 R282;R284.1 文献标志码 A 文章编号 1001-0408(2020)14-1725-07
DOI 10.6039/j.issn.1001-0408.2020.14.12
摘 要 目的:快速鉴定藤梨根的化学成分,为该药材后续的物质基础和质量控制等研究提供参考。方法:运用超高效液相色谱-四极杆-飞行时间串联质谱技术(UHPLC-Q-TOF-MS/MS)进行藤梨根的化学成分检测。色谱柱为Waters XSelect HSS T3,流动相为0.1%甲酸乙腈溶液-0.1%甲酸水溶液(梯度洗脱),柱温为40 ℃,流速为0.3 mL/min,进样量为3 μL;采用电喷雾离子源,以负离子模式采集数据,扫描范围为m/z 50~1 500,干燥气温度为350 ℃,雾化气压力为45 psi,毛细管电压为3 500 V,鞘气温度为350 ℃。根据准分子离子和二级碎片离子信息,结合相关文献以及对照品的保留时间和质谱裂解规律对检出的化学成分进行结构鉴定。结果与结论:共鉴定出58个化学成分,包括16个五环三萜类化合物(如羟基积雪草酸、积雪草酸、山楂酸、科罗索酸、齐墩果酸、熊果酸等)、12个黄酮类化合物(如芦丁、槲皮苷、木犀草苷、紫云英苷等)、17个有机酸类化合物(如隐绿原酸、绿原酸、异绿原酸A、异绿原酸C等)等,有9个化合物(如原花青素B1、B2,木犀草素等)为首次从藤梨根中鉴定出来。UHPLC-Q-TOF-MS/MS技术可快速鉴定藤梨根中的化学成分。
关键词 藤梨根;超高效液相色谱-四极杆-飞行时间串联质谱技术;化学成分;鉴定
Identification of Chemical Components in Actinidia chinensis Root by UHPLC-Q-TOF-MS/MS
CHEN Fangchao1,2,GAO Shouhong3,WANG Zhipeng3,YANG Hong3,SHUN Qingsheng2, SONG Xinhua4,XU Yixin2(1. Graduate School, Shanghai University of TCM, Shanghai 201213, China; 2. School of Pharmacy, Shanghai University of Medicine & Health Sciences, Shanghai 201318, China; 3. Dept. of Pharmacy, Changzheng Hospital Affiliated to Naval Medical University, Shanghai 200003, China; 4. College of Chemistry and Bio-engineering, Yichun University, Jiangxi Yichun 336000, China)
ABSTRACT OBJECTIVE: To identify chemical components of Actinidia chinensis root rapidly, and to provide reference for further material basis and quality control study of the crude medicine. METHODS: UHPLC-Q-TOF-MS/MS technique was used to detect chemical components of A. chinensis root. The separation was performed on Waters XSelect HSS T3 column with mobile phase consisted of 0.1% formic acid acetonitrile solution-0.1% formic acid water solution (gradient elution) at the flow rate of 0.3 mL/min. The column temperature was set at 40 ℃,and sample size was 3 μL. Electrospray ion source was adopted, the data was collected under negative ion mode; the scanning range was m/z 50-1 500; the drying gas temperature was 350 ℃, the atomizing air pressure was 45 psi, the capillary voltage was 3 500 V,and sheath gas temperature was 350 ℃. According to the information of excimer ion and secondary fragment ion, the chemical components were identified by combining with the relevant literature, the retention time of the reference substance and the law of mass spectrometry cracking. RESULTS & CONCLUSIONS: Totally 58 chemical components was identified,which included 16 pentacyclic triterpenes (such as hydroxyasiatic acid,asiatic acid,maslinic acid,corosolic acid,oleanic acid,ursolic acid,etc.),12 flavonoids (such as rutin,quercitrin,cynaroside,astragalin,etc.),17 organic acids (such as cryptochlorogenic acid,chlorogenic acid,isochlorogenic acid A,isochlorogenicacid C, etc.). There were 9 components (such as procydanidin B1, B2 and luteolin, etc.) identified for the first time in A. chinensis root. UHPLC-Q-TOF-MS/MS technique can be used for the rapid identification of chemical components in A. chinensis root.
KEYWORDS Actinidia chinensis root; UHPLC-Q-TOF-MS/MS; Chemical component; Identification
藤梨根为猕猴桃科猕猴桃属植物中华猕猴桃(Actinidia chinensis Planch.)的干燥根,又名阳桃根,其味苦、涩,性凉,具有清热解毒、活血散结、祛风利湿等功效[1-2]。藤梨根是浙江等地区常用的抗肿瘤中药,临床上多用于治疗胃癌、肝癌、食管癌、结肠癌等消化道系统肿瘤,还用于治疗风湿痹痛、黄疸、痢疾、淋浊带下、瘰疬、水肿等症[3]。现代化学成分研究表明,其化学成分主要为五环三萜类、黄酮类、蒽醌类、苯丙素类、甾体类、生物碱类、有机酸类等,其主要活性成分为五环三萜类成分[4-7]。现代药理学研究表明,藤梨根具有明显的抗肿瘤、抗菌、抗氧化、保肝、降血脂、抗病毒、免疫调节等作用[8-11]。
目前对藤梨根的研究主要集中在化学成分的分离以及药理作用的研究等方面,但藤梨根的化学成分复杂、分析方法单一,尤其是在质量控制方面的研究鲜有报道,缺乏有效的质量控制标准。近年来,液质联用技术发展迅速,以其分析时间短、分离度高、灵敏度高和准确度高等特点在中药成分分析鉴定中具有独特优势[12]。基于此,本研究采用超高效液相色谱-四极杆-飞行时间串联质谱技术(UHPLC-Q-TOF-MS/MS)对藤梨根的化学成分进行快速鉴别,为进一步研究其物质基础以及质量控制提供参考依据。
1 材料
1.1 仪器
1290型UHPLC仪(配备在线脱气机、二元泵、自动进样器、柱温箱、二极管阵列检测器)、6530型高分辨飞行时间质谱仪[配备Dual AJS 电喷雾离子源(ESI)、 MassHunter Data Acquisition 7.1工作站、Qualitative Analysis B 10.0定性分析软件和PCDL Manager 8.0数据库软件]均购自美国Agilent公司;CPA 225D型十万分之一电子分析天平(德国Sartorius公司);VortexKB3型涡旋混匀器(海门市其林贝尔仪器制造有限公司);Mini Spin个人型高速离心机、移液器(德国Eppendorf公司);SK7200H 型超声波清洗器(上海科导超声仪器有限公司)。
1.2 藥品与试剂
熊果酸等45种对照品信息详见表1;甲醇、乙腈(质谱纯,德国Merck公司);甲酸(色谱纯,上海麦克林生物化学有限公司);无水乙醇(分析纯,国药集团化学试剂有限公司);纯净水(广州屈臣氏有限公司)。
12批藤梨根药材均于2018年10月采自于大别山地区(编号:1801-1812),经海军军医大学药学院黄宝康教授鉴定为猕猴桃科猕猴桃属植物中华猕猴桃(A. chinensis Planch.)的干燥根。标本存放于上海中医药大学科创中心中药资源与生物技术中心实验室。
2 方法
2.1 混合对照品溶液的制备
精密称取45种对照品各10.0 mg,分别置于10 mL量瓶中,加甲醇溶解并定容,制成质量浓度均为1.0 mg/mL的单一对照品贮备液,于-20 ℃条件下保存,备用。临用前,取各对照品贮备液100 μL,置于同一10 mL量瓶中,用甲醇稀释至刻度,制成各成分质量浓度均为10 μg/mL的混合对照品溶液。
2.2 供试品溶液的制备
取藤梨根药材适量,粉碎,过40目筛后,精密称取粉末1.0 g,置于100 mL具塞锥形瓶中,加入80%甲醇30 mL,超声(功率:400 W,频率:40 kHz)提取60 min,摇匀,滤纸滤过后再经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3 色谱条件
色谱柱:Waters XSelect HSS T3(100 mm×2.1 mm,2.5 μm);流动相:0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱(0 min,5%A;3 min,15%A;13 min,41%A;23 min,70%A;25~30 min,95%A);流速:0.3 mL/min;柱温:40 ℃;进样量:3 μL。
2.4 质谱条件
采用ESI离子源,在负离子模式(MSI-)条件下采集数据,扫描范围为m/z 50~1 500。具体质谱参数:干燥气温度为350 ℃;干燥气流速为10 L/min;雾化气压力为45 psi;毛细管电压为3 500 V;鞘气温度为350 ℃;鞘气流速为11 L/min;碎裂电压为140 V;锥孔电压为65 V;八极杆电压为750 V;参比离子分别为m/z 112.985 1、1 033.988 1;二级能量(CE)分别10、20、40 V。
2.5 藤梨根化学成分数据库和二级质谱数据库的建立
2.5.1 化学成分数据库 根据国内外专业数据库PubMed、SciFinder、ChemSpider、中科院化学专业数据库、Sci-Hub、中国知网等平台中的国内外相关文献研究,收集了藤梨根中目前已经报道的166个化合物。同时,根据Qualitative Analysis B 10.0定性分析软件中的“Formular-database-generator”工具(含各元素精确质量数),结合所测得的各成分所含碳、氢、氧等元素的数量,计算出相应的精确分子量,并建立了包括化合物名称(含英文名称)、分子式、CAS号在内的化学成分数据库。
2.5.2 二级质谱数据库 通过MassHunter Data Acquisition 7.1工作站采集45种对照品的二级质谱数据[包含分子离子、碎片离子m/z信息和保留时间(tR)等],导入PCDL Manager 8.0数据库软件中,建立二级质谱数据库。
2.6 藤梨根化学成分分析
采用Qualitative Analysis B 10.0定性分析软件进行数据处理。首先,将所采集的藤梨根化学成分一级质谱数据与“2.5.1”项下建立的化学成分数据库进行比对,根据其匹配得分(>90)、精确分子量的误差(±5 ppm以内)以及同位素分布,初步对藤梨根药材中的成分进行定性筛查。然后,根据各成分的保留时间和精确分子量,与已有对照品进行对比后推测出待测成分结构;若无相应对照品,则通过二级质谱数据对待测成分的碎片离子进行解析,再结合相关文献推测出该成分结构。最后,在MassHunter Data Acquisition 7.1工作站的“Target MS/MS”采集模式下采集样品和对照品的二级质谱数据,对其主要碎片离子进行比对分析,推测其裂解方式,进一步确定化学成分结构。
3 结果
3.1 化学成分的鉴定分析
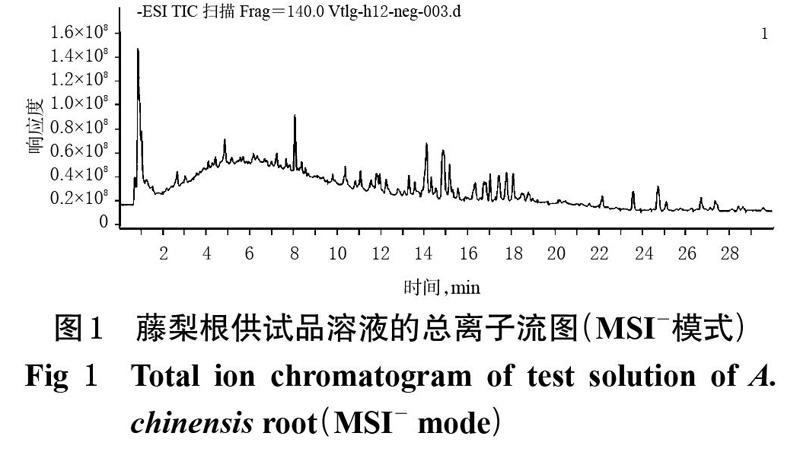
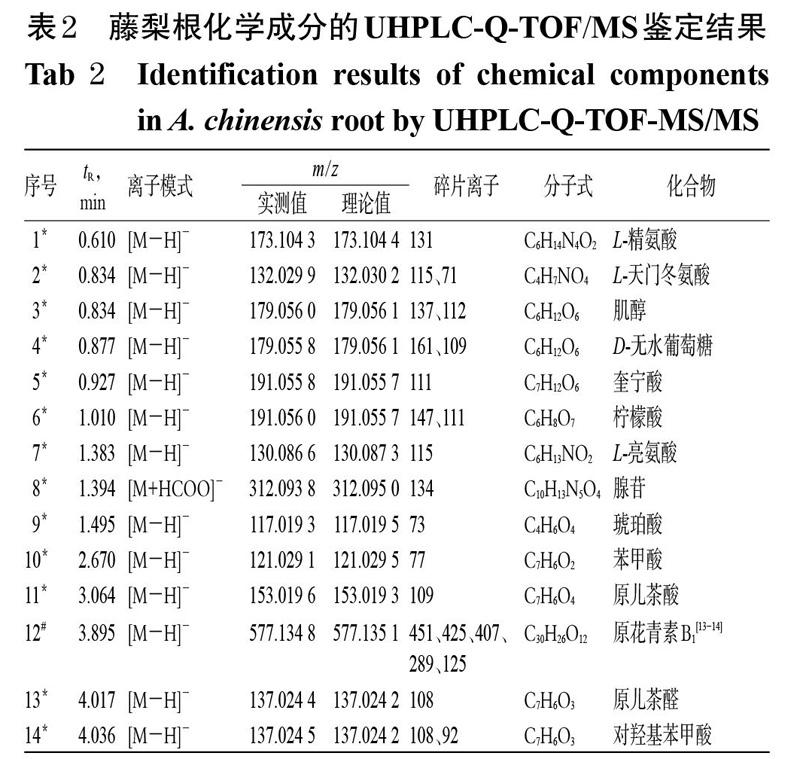
藤梨根供试品溶液的总离子流图见图1。通过与“2.5.1”“2.5.2”项下建立的数据库进行对比,结合相关文献信息以及质谱裂解规律进行分析,鉴定出58个化学成分,其中包括16个五环三萜类化合物、12个黄酮类化合物、17个有机酸类化合物等;有9个化合物为首次从藤梨根中鉴定出来,详见表2。
3.2 化合物裂解规律解析
3.2.1 黄酮类化合物 本研究在藤梨根中共鉴定出12个黄酮类成分,主要是黄酮类和黄酮苷类化合物。以部分化合物为例进行分析,结果发现黄酮单糖苷类化合物在裂解电压下,多失去1分子糖,二级质谱中碎片离子峰多为[M-H-Rha(146)]-、 [M-H-Glu(162)]-,其m/z分别为301、285。解析示例如下。
化合物12、18:准分子离子峰均为m/z 577[M-H]-,根据Qualitative Analysis B 10.0定性分析软件(下同)推测其分子式为 C30H26O12;二级质谱中出现明显的碎片离子峰m/z 289[M-H-C15H12O6]-,再通过与文献报道[13-14]比对,最终鉴定化合物12、18分别为原花青素B1、B2。
化合物16、21:准分子离子峰均为 m/z 289[M-H]-,二级质谱中出现明显的碎片离子峰m/z 245[M-H-CO2]-、205[M-H-C4H4O2]-,且化合物21图谱上还有碎片离子179[M-H-C6H6O2]-,推测其分子式为 C15H14O6;再通过与儿茶素和表儿茶素对照品进行比对,并结合其保留时间,最终鉴定化合物16、21分别为儿茶素和表儿茶素。
化合物25:准分子离子峰为m/z 609[M-H]-,二级质谱中出现明显的碎片离子峰m/z 301[M-H-Rha(146)-Glu(162)]-、300[M-2H-Rha(146)-Glu(162)]-,推测其分子式为C27H30O16;再通过与芦丁对照品进行比对,最终鉴定化合物25为芦丁。
化合物30、31、32:准分子离子峰均为m/z 447 [M-H]-,其中化合物30、32的二级质谱中出现明显的碎片离子峰m/z 301[M-H-Rha(146)]-,推测其分子式为C21H20O11;再通过与槲皮苷和木犀草苷对照品进行对比,最终鉴定化合物30、32分别为槲皮苷和木犀草苷。化合物31的二级质谱中出现明显的碎片离子峰m/z 285[M-H-Glu(162)]-、284[M-2H-Glu(162)]-,推测其分子式为 C21H20O11,再通过与紫云英苷对照品进行比对,最终鉴定化合物31为紫云英苷。
黄酮类成分二级质谱图和裂解途径解析见图2、图3(以槲皮苷、紫云英苷为例)。
3.2.2 五环三萜类化合物 本研究在藤梨根中共鉴定出16个五环三萜类成分,该类成分主要分为两大类,即熊果酸类和齐墩果酸类;根据其羟基数目的不同,可分为一羟基、二羟基、三羟基、四羟基、五羟基等五环三萜酸类;在不同裂解电压下,其结构均较稳定,产生的碎片离子峰多为m/z 455、471、487、503、519等。以部分化合物为例,解析如下。
化合物35:准分子离子峰为m/z 665[M-H]-、711[M+HCOO]-,二级质谱中出现明显的碎片离子峰m/z 503[M-H-Glu(162)]-,即失去了1分子葡萄糖,故鉴定化合物35是一个四羟基三萜酸苷类成分,分子式为 C36H58O11。
化合物40:准分子离子峰为 m/z 519[M-H]-,二級质谱中出现碎片离子峰m/z 501[M-H-H2O]-,即失去了1分子水,故鉴定化合物40是一个五羟基三萜酸成分,其分子式为C30H48O7。
化合物41:准分子离子峰为m/z 503[M-H]-,二级质谱中出现碎片离子峰m/z 485[M-H-H2O]-,即失去了1分子水,故鉴定化合物41是一个四羟基三萜酸成分,其分子式为C30H48O6。
化合物42:准分子离子峰为 m/z 503[M-H]-,二级质谱中出现碎片离子峰m/z 485[M-H-H2O]-、457[M-H-H2O-CO]-,故鉴定化合物42是一个四羟基三萜酸成分,其分子式为C30H48O6。
化合物45、47:准分子离子峰分别为 m/z 503[M-H]-、487[M-H]-,二级质谱中出现碎片离子峰m/z 503[M-H]-、487[M-H]-,故鉴定化合物45、47分别为一个四羟基三萜酸成分和一个三羟基三萜酸成分,其分子式分别为C30H48O6、C30H48O5。
化合物43:准分子离子峰为m/z 503[M-H]-,二级质谱中出现明显的碎片离子峰m/z 487[M-H]-、485[M-H-H2O]-、457[M-H-H2O-CO]-,推测其分子式为 C30H48O6;再通过与羟基积雪草酸对照品进行比对,最终鉴定化合物43为羟基积雪草酸。
化合物46:准分子离子峰为m/z 487[M-H]-,二级质谱中出现碎片离子峰m/z 487[M-H]-,推测其分子式为C30H48O5;再通过与积雪草酸对照品进行比对,最终鉴定化合物46为积雪草酸。
化合物51、52:准分子离子峰均为m/z 471[M-H]-,二级质谱中均出现碎片离子峰m/z 471[M-H]-,推测其分子式为 C30H48O4;再通过与山楂酸和科罗索酸对照品进行比对,最终鉴定化合物51、52分别为山楂酸和科罗索酸。
化合物55、56:准分子离子峰均为 m/z 455[M-H]-,二级质谱中均出现碎片离子峰m/z 455[M-H]-,推测其分子式为 C30H48O3;再通过与齐墩果酸和熊果酸对照品进行比对,最终鉴定化合物55、56分别为齐墩果酸和熊果酸。
三萜类成分二级质谱图和裂解途径解析见图4、图5(以积雪草酸、羟基积雪草酸为例)。
3.2.3 有机酸类化合物 本研究在藤梨根中共鉴定出17个有机酸类成分,以部分化合物为例,解析如下。
化合物15、17:准分子离子峰均为 m/z 353[M-H]-,二级质谱中均出现明显的碎片离子峰m/z 191[M-H-C9H6O3]-,推测其分子式为 C16H18O9;再通过与隐绿原酸、绿原酸对照品进行比对,最终鉴定化合物15、17分别为隐绿原酸和绿原酸。
化合物29、33:准分子离子峰均为 m/z 515[M-H]-,二级质谱中出现明显的碎片离子峰m/z 353[M-H-C9H6O3]-、191[M-H-2(C9H6O3)]-、179[M-H-C16H16O8]-等,推测其分子式为 C25H24O12;再通过与异绿原酸A、异绿原酸C对照品进行比对,最终鉴定化合物29、33分别为异绿原酸A和异绿原酸C。
有机酸类成分二级质谱图和裂解途径见图6、图7(以异绿原酸A、异绿原酸C为例)。
4 讨论
现有研究表明,藤梨根中的主要成分为五环三萜类化合物,且多互为同分异构体,采用常规的定性分析手段难以进行分离。本研究采用UHPLC-Q-TOF-MS/MS技术,该技术具有高分辨率、高灵敏度的分离特点[12],可实现对藤梨根药材化学成分的快速鉴定;此外,对其中的同分异构体化合物,该技术可通过比对对照品信息及保留时间差异实现有效的定性鉴定。
由于药材中成分较为复杂,故本研究对实验条件进行了综合考察,对提取方法(回流、超声)、提取溶剂(水、20%乙醇、40%乙醇、60%乙醇、80%乙醇、无水乙醇)、提取时间(30、60、90 min)等进行了筛选。根据总离子流的响应度,最终确定提取方法为:以80%乙醇为提取溶剂、超声提取60 min。此外,本课题组还对色谱条件中的流动相体系(乙腈-水、乙腈-0.1%甲酸水溶液、甲醇-0.1%甲酸水溶液、0.1%甲酸乙腈溶液-0.1%甲酸水溶液)进行考察,根据不同流动相条件所得图谱的总离子流的响应度及色谱峰的峰分离效果,最终确定以0.1%甲酸乙腈溶液-0.1%甲酸水溶液为流动相。
综上所述,本研究共从藤梨根中鉴定出58个化学成分,其中包括16个五环三萜类化合物(如羟基积雪草酸、积雪草酸、山楂酸、科罗索酸、齐墩果酸、熊果酸等)、12个黄酮类化合物(如芦丁、槲皮苷、木犀草苷、紫云英苷等)、17个有机酸类化合物(如隐绿原酸、绿原酸、异绿原酸A、异绿原酸C等)等;有9个化合物(如原花青素B1、B2,木犀草素等)为首次从藤梨根中鉴定出来。UHPLC- Q-TOF-MS/MS 技术可快速鉴定藤梨根中的化学成分。
参考文献
[ 1 ] 中国科学院中国植物志编辑委员会.中国植物志:第42卷:第2分册[M].北京:科学出版社,1984:260-261.
[ 2 ] 全国中草药汇编编写组.全国中草药汇编:上册[M].2版.北京:人民卫生出版社,1996:820-821.
[ 3 ] 章红燕,芦柏震,侯桂兰.我院4年间抗肿瘤中草药用药的调查分析[J].中国药业,2002,11(6):63.
[ 4 ] CHANG J,CASE R. Cytotoxic phenolic constituents from the root of Actinidia chinensis[J]. Planta Med,2005,71(10):955-959.
[ 5 ] XU YX,XIANG ZB,JIN YS,et al. Constituents from the roots of Actinidia chinensis and their cytochrome P450 enzyme inhibitory activities[J]. Chem Biodivers,2016,13(11):1454-1459.
[ 6 ] 何國浓,王邦才,王辉,等.藤梨根化学成分的研究:Ⅱ[J].中华中医药杂志,2016,31(6):2353-2355.
[ 7 ] 赫军,马秉智,赵铁,等.藤梨根的化学成分研究[J].中国药学杂志,2014,49(3):184-186.
[ 8 ] 关英,阿选德.藤梨根乙酸乙酯提取物对肺癌A549细胞凋亡的诱导作用[J].中国药房,2015,26(25):3499-3501.
[ 9 ] 吴淑莲,荣福.藤梨根含药血清对肺腺癌A549细胞的抑制作用[J].广东医学,2017,38(16):2432-2435.
[10] CHENG QL,LI HL,HUANG ZQ,et al. 2β,3β,23-trihydroxy-urs-12-ene-28-olic acid(TUA)isolated from Actinidia chinensis Radix inhibits NCI-H460 cell proliferation by decreasing NF-κB expression[J]. Chem Biol Interact,2015. DOI:10.1016/j.cbi.2015.06.038.
[11] KU CY,WANG YR,LIN HY,et al. Corosolic acid inhibits hepatocellular carcinoma cell migration by targeting the VEGFR2/Src/FAK pathway[J]. PLoS One,2015. DOI:10.1371/journal.pone.0126725
[12] WAN M,ZHANG Y,YANG Y,et al. Analysis of the chemical composition of Angelicae pubescentis Radix by ultra-performance liquid chromatography and quadrupole time-of-flight tandem mass spectrometry[J]. J Chin Pharm Sci,2019,28(3):145-159.
[13] SKEHAN P,STORENG R,SCUDIERO D,et al. New colorimetric cytotoxicity assay for anticancer-drug screening[J]. J Natl Cancer Inst,1990,82(13):1107-1112.
[14] WAN SB,CHAN TH. Enantioselective synthesis of afzelechin and epiafzelechin[J]. Tetrahedron,2004,60(37):8207-8211.
[15] SAKURAWI K,YASUDA F,TOZYO T,et al. Endothelin receptor antagonist triterpenoid,myriceric acid A,isolated from Myrica cerifera,and structure activity relationships of its derivatives[J]. Chem Pharm Bull,1996,44(2):343-351.
[16] 袁珂,朱建鑫,張耀,等.猫人参化学成分研究[J].中草药,2008,39(4):505-507.
[17] 甘秀海,周欣,陈华国,等.黑骨藤中极性部位化学成分研究[J].中国中药杂志,2009,34(24):3225-3228.
(收稿日期:2020-02-01 修回日期:2020-05-31)
(编辑:段思怡)

