葡萄糖转运蛋白1抑制剂在结肠癌细胞奥沙利铂耐药中的作用
张江国 吕红 吉明柱

[摘要] 目的 探讨葡萄糖转运蛋白1(GLUT-1)抑制剂在结肠癌细胞奥沙利铂耐药中的作用。 方法 将HT29细胞分为L-OHP敏感组及耐药组,其中敏感组分为0 μM、4 μM、8 μM、16 μM、32 μM、64 μM L-OHP组,耐药组分为0 μM、16 μM、32 μM、64 μM L-OHP组。采用实时聚合酶链反应(PCR)和蛋白质印迹法测定耐药及敏感结肠癌细胞系葡萄糖转运蛋白-1(GLUT-1)基因表达水平。用MTT法测定耐药及敏感结肠癌细胞系细胞活力。 结果 低毒浓度的L-OHP处理可诱导结肠癌细胞系GLUT-1表达。与L-OHP敏感细胞系细胞相比,L-OHP耐药细胞系细胞GLUT-1表达上调。WZB117对GLUT1的抑制显著提高了L-OHP耐药细胞对药物的敏感性。 结论 结肠癌细胞对L-OHP的耐药可能与GLUT1表达上调有关。GLUT1特异性抑制剂可以逆转结肠癌细胞对L-OHP的抵抗。GLUT1可能是未来抗癌药物发展的一个潜在目标。
[关键词] 葡萄糖转运蛋白1;葡萄糖轉运蛋白1抑制剂;结肠癌细胞;奥沙利铂;化疗;耐药
[Abstract] Objective To investigate the role of glucose transporter 1(GLUT-1) inhibitor in oxaliplatin resistance in colon cancer cell. Methods HT29 cells were divided into L-OHP sensitive group and L-OHP resistance group, among which the sensitive components were 0 μM, 4 μM, 8 μM, 16 μM, 32 μM, 64 μM L-OHP group, and the resistance components were 0 μM, 16 μM, 32 μM, 64 μM L-OHP group. Real-time polymerase chain reaction(PCR) and Western blot were used to determine the expression level of glucose transporter-1(GLUT-1) gene in drug-resistant and sensitive colon cancer cells. The cell viability of drug-resistant and sensitive colon cancer cell lines was determined by MTT method. Results L-OHP treatment with low toxic concentration can induce the expression of colon cancer cell line GLUT-1. Compared with that of L-OHP sensitive cell line cells, the expression of GLUT-1 in L-OHP resistant cell line cells was up-regulated. The inhibition of GLUT1 by WZB117 significantly increased the sensitivity of L-OHP resistant cells to drugs. Conclusion The resistance of colon cancer cells to L-OHP may be related to the up-regulation of GLUT1 expression. GLUT1 specific inhibitors can reverse the resistance of colon cancer cells to L-OHP. GLUT1 may be a potential target for the development of anticancer drugs in the future.
[Key words] Glucose transporter type 1; Glucose transporter type 1 inhibitor; Colon cancer cells; Oxaliplatin; Chemotherapy; Drug resistance
结肠癌的化疗作为手术切除肿瘤后的辅助治疗手段,可以有效杀灭微小肿瘤灶及转移灶,明显提高术后无病生存率及延长总生存期。新一代化疗药物奥沙利铂使得辅助化疗上了一个新台阶。它是第三代铂类抗癌药物,药理学特性和其他铂类药物相似,均以DNA为靶点。L-OHP的耐药问题目前也已成为困扰临床医生的一大难题,其耐药机制为DNA损伤修复、药物解毒增加、药物积聚减少、Fas相关磷酸酶-1表达上调等[1]。葡萄糖转运蛋白(GLUT)是细胞膜上的跨膜糖蛋白,能介导细胞内外的葡萄糖以易化扩散的方式相互转运。GLUT-1蛋白质是一种高度疏水的、糖基化程度各异的蛋白质,在缺氧及缺血的恶性肿瘤细胞中表达显著增高,主要参与细胞基础的葡萄糖转运,在细胞能量代谢中起到极其重要作用。癌细胞主要依赖于葡萄糖提供能量,因此癌细胞对于葡萄糖剥夺敏感[2]。肿瘤细胞葡萄糖转运增加主要是由于其细胞膜上GLUT-1上调所致,通过shRNA敲除GLUT-1基因可以增加头颈部肿瘤对化疗药物顺铂的敏感性[3],抑制GLUT1表达可增加结肠癌细胞的敏感性[4,5],提示GLUT1有可能成为克服化疗药物耐药的靶标之一。WZB117是一种新型的GLUT-1不可逆性抑制剂,可以显著降低细胞内葡萄糖的摄入量及ATP水平,进而抑制糖酵解并抑制细胞生长。最近有报道指出WZB117刺激癌细胞可致GLUT-1蛋白表达明显下调,细胞内ATP水平下降,进而引起AMP激活的蛋白激酶的增加、细胞周期蛋白E2以及磷酸化视网膜母细胞瘤抑癌蛋白下降,导致癌细胞周期停滞,衰老和坏死[6]。WZB117能够通过抑制结肠癌细胞膜上的GLUT-1进而克服癌细胞对5氟尿嘧啶的耐药性[7]。
本研究拟对GLUT1和GLUT1抑制剂WZB117在逆转结肠癌细胞对L-OHP耐药性中的作用进行相关研究,明确其在L-OHP耐药性中的作用,为将来在耐化疗药的结肠癌靶向治疗中提供新的武器。
1 资料与方法
1.1 材料与试剂
人结肠癌细胞HT29购自美国ATCC公司,乐沙定(注射用L-OHP)购自比利时Laboratoires Thissen公司,RPMI 1640培养液、新生小牛血清、0.25%胰蛋白酶购自美国Gibco公司,MTT试剂盒购自上海碧云天公司,一步法Realtime RT-PCR试剂购自上海羽朵生物公司,Takara反转录试剂盒购自宝生物公司,抗GLUT1抗体购自英国abcam公司,WZB117购自Sigma-aldrich公司。
1.2 仪器与设备
BioTek ELx800全自动酶标仪购自美国BioTek公司,iCycler荧光定量PCR仪购自美国伯乐公司,Bio-rad凝胶成像系统购自美国伯乐公司。
1.3 试验方法
1.3.1 L-OHP耐藥的结肠癌细胞系的建立 将人结肠癌细胞系HT29细胞放置于含有浓度依次增加的L-OHP的细胞培养基中进行培养,起始的L-OHP的浓度定为HT29细胞经MTT法检测在540 nm波长光测定时吸光度减半时的浓度,后每2周浓度增加10%,挑出对L-OHP耐药的单个克隆的结肠癌细胞进行培养,所有耐药细胞均每4周重复进行L-OHP刺激,使用该细胞进行后续的实验[8]。将上述细胞分为L-OHP敏感组及耐药组,其中敏感组分为0 μM、4 μM、8 μM、16 μM、32 μM、64 μM L-OHP组,耐药组分为0 μM、16 μM、32 μM、64 μM L-OHP组。
1.3.2 实时荧光定量逆转录-聚合酶链反应测定GLUT-1基因表达水平 取对数生长期的耐药株和敏感株HT29细胞,引物探针为Glut1:Forward:5-AACTCTTCAGCCAGGGTCCAC-3,Reverse:5-CA-CAGTGAAGATGATGAAGAC-3,采用RNA提取试剂盒提取,分光光度计测定RNA浓度及纯度后按照反转录试剂盒说明进行反转录,条件为:37℃反转录1 h,85℃灭活反转录酶5 min。反转录后模板用两步法进行扩增,扩增条件为:95℃预变性30 s;95℃变性5 s,60℃延伸30 s,40个循环。采用△△Ct法进行相对定量分析[7]。
1.3.3 Western blot测定GLUT-1蛋白表达水平 收集敏感肿瘤细胞系和耐药肿瘤细胞系肿瘤细胞,预冷PBS清洗后加入含1%蛋白酶抑制剂的RIPA裂解液,冰上裂解20 min,4℃ 12 000转/min离心15 min后吸取上清,加1/4体积的5×蛋白上样缓冲液并100℃变性10 min。以20~30 μg的蛋白量进行SDS-聚丙烯酰氨凝胶电泳,采用湿转使蛋白转至NC膜上,10%脱脂牛奶封闭1 h,加入抗GLUT1抗体,4℃摇床孵育过夜。TBST洗涤3次,每次5 min,加入二抗室温摇床孵育1 h。TBST洗涤3次,每次5 min,均匀滴加ECL发光液后用Bio-Rad凝胶成像仪显影[7]。Image J软件进行图片条带灰度值分析。
1.3.4 MTT法测定L-OHP及WZB117对敏感及耐药肿瘤细胞系活性的影响 收集对数生长期的HT29细胞,将其制备成105个/mL的细胞悬液。分别予100 μL接种于96孔板各孔中,边缘孔用无菌PBS填充。37℃、5%CO2条件下培养24 h,实验分组,加入不同浓度的药物100 μL,每孔终体积为200 μL。各浓度各设18个复孔。培养72 h,在对照孔细胞达到90%融合后,在各孔加入5 mg/mL的MTT试剂20 μL,培养箱内孵育4 h,弃上清液,加入DMSO 150 μL,室温下震荡10~15 min,待紫色结晶完全溶解后,用酶标仪测定570 nm波长吸光度值。重复3次。细胞活性=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
1.4 统计学处理
采用SPSS19.0统计软件分析数据。计量资料用(x±s)表示,组间比较采用两独立样本t检验,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
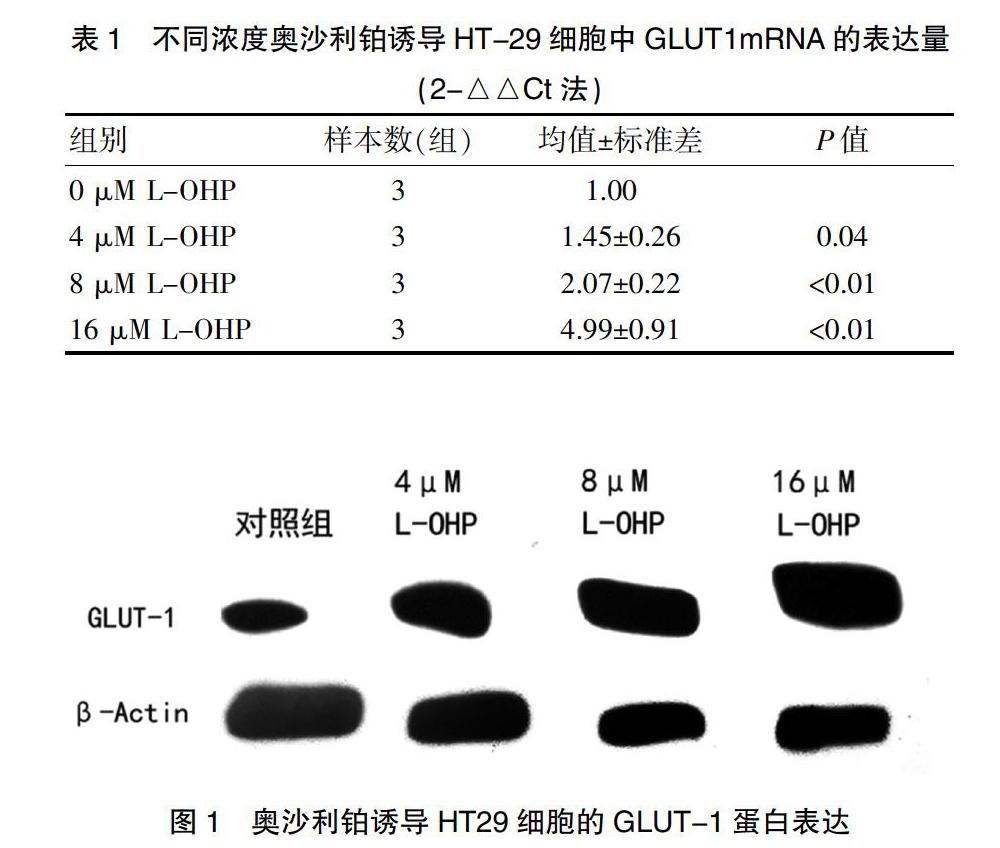
2.1 L-OHP诱导HT29细胞GLUT-1的表达
本研究分析了L-OHP作用HT29细胞后GLUT-1的表达情况。在低浓度的L-OHP处理24 h后,检测HT-29细胞中GLUT1的表达。如表1所示(2-△△Ct法),L-OHP 4 μM时,GLUT1的mRNA表达表达量是空白对照组的(1.45±0.26)倍;L-OHP 8 μM时,GLUT1的mRNA表达量是空白对照组的(2.07±0.22)倍;L-OHP 16μM时,GLUT1的mRNA表达量是空白对照组的(4.99±0.91)倍,较对照组(未受L-OHP作用的HT-29细胞)明显升高(P<0.05)。见图1。L-OHP 0uM时HT-29细胞GLUT1相对蛋白表达量为(0.28±0.02)。4 μM、8 μM、16 μM时,HT-29细胞GLUT1的蛋白相对表达量分别为(0.83±0.04)、(1.55±0.55)、(1.72±0.11),较0 μM时明显增加(P<0.05)。随着L-OHP的浓度增加(最高浓度增加至16 μM),HT-29细胞的GLUT1水平明显增加,且GLUT1表达呈L-OHP剂量依赖性模式。上述结果提示L-OHP作用于HT-29细胞可诱导GLUT1表达增加。见表1。
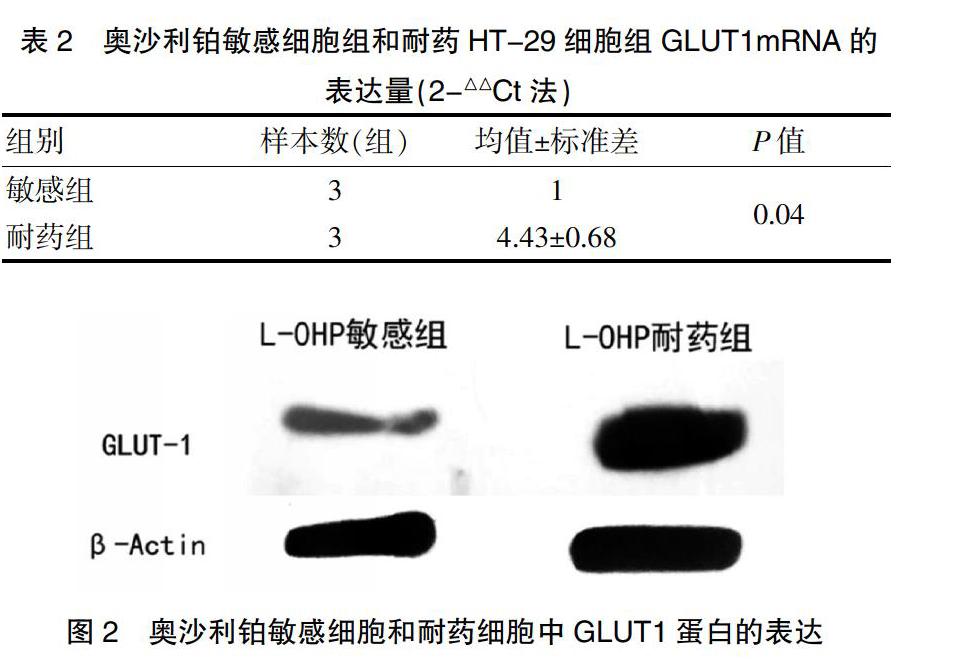
2.2 L-OHP敏感细胞和耐药细胞中GLUT1的表达
为了明确GLUT1在HT-29细胞对L-OHP耐药中的作用,分别检测L-OHP敏感细胞和耐药细胞中GLUT1的表达。如表2、图2所示,16 μM L-OHP作用于耐药细胞株的GLUT1 mRNA表达水平是敏感组的(4.430±0.684)倍,耐药细胞株的GLUT1 mRNA表达较敏感细胞株明显升高(P<0.05)。敏感细胞株的GLUT1 蛋白相对表达量是(0.35±0.03),耐药细胞株的GLUT1蛋白相对表达量是(0.94±0.02),与敏感细胞株相比,耐药细胞株的GLUT1蛋白水平明显升高(P<0.05)。
2.3 L-OHP对敏感和耐L-OHP的HT-29细胞系细胞活性的影响
为了明确GLUT1表达增加是否是L-OHP耐药的主要机制,本研究从HT-29细胞系中选择L-OHP耐药细胞。按照向征等[8]的方法建立耐L-OHP的HT-29细胞系,检测不同浓度(0 μM、16 μM、32 μM、64 μM的L-OHP)作用72 h后L-OHP敏感HT-29细胞系和L-OHP耐药HT-29细胞系细胞活性。如表3所示,16 μM L-OHP时敏感株及耐药株的细胞活性分别为(0.79±0.05)和(0.89±0.02),32 μM L-OHP时敏感株及耐药株的细胞活性分别为(0.58±0.04)和(0.87±0.02),64 μM L-OHP时敏感株及耐药株的细胞活性分别为(0.31±0.05)和(0.74±0.01),L-OHP耐药细胞株接受相同浓度的L-OHP作用后其活性较敏感细胞株明显升高(P<0.05),提示耐药细胞株对L-OHP耐药。
2.4 L-OHP和WZB117对耐药HT-29细胞系活性的影响
GLUT-1特异性抑制剂WZB117能有效抑制GLUT-1的表达,下调糖酵解,抑制癌细胞的生长。如表4所示,用L-OHP、WZB117及L-OHP和WZB117联合作用于L-OHP耐药细胞株。16 μM L-OHP作用的耐药株的细胞活性为(0.86±0.03),5 μM WZB117作用的耐药株的细胞活性为(0.75±0.01),16 μM L-OHP和5 μM WZB117联合作用的耐药株的细胞活性为(0.46±0.02),这表明L-OHP和GLUT-1抑制剂WZB117联合使用对结肠癌细胞活性的抑制作用明显强于单独使用上述任何一种药物(P<0.01)。WZB117对GLUT-1的抑制显著提高了L-OHP对耐药细胞的抑制作用。GLUT-1可能是克服结肠癌L-OHP耐药的一个治疗靶点。
3 讨论
L-OHP常用于结直肠癌的化疗,癌细胞产生对L-OHP的耐药性是化疗失败的常见原因。常见L-OHP的耐药机制为DNA损伤修复、药物解毒增加、药物积聚减少、Fas相关磷酸酶-1表达上调等[1]。本研究首次发现,随着L-OHP的浓度增加,HT-29结肠癌细胞的GLUT-1水平明显增加,且GLUT-1表达呈L-OHP剂量依赖性模式。GLUT-1高表达的HT-29细胞耐药株在多重浓度的L-OHP下表现出更强的存活能力。参与葡萄糖代谢的GLUT-1高表达导致结肠癌细胞对L-OHP耐药,这可能是结肠癌细胞对L-OHP耐药的一种新的机制。
L-OHP作用于HT-29细胞的半抑制浓度(IC50)约为32 μM,因此本研究检测了0 μM、8 μM、16 μM的L-OHP作用于HT-29细胞后GLUT-1基因的表达量,发现在L-OHP16 μM时的GLUT-1的表达量最高,和汪峰等的研究结果相似,因此在后续的实验中选择16 μM L-OHP作用于敏感及耐药细胞株[9]。
Warburg效应是指与正常的细胞相比,癌细胞更喜欢利用有氧糖酵解而不是线粒体氧化磷酸化来產生能量[10]。通过增强Warburg效应可增强结直肠癌细胞的生长,而抑制Warburg效应可明显抑制结直肠癌细胞的生长[11-13]。参与癌细胞有氧糖酵解的GLUT-1表达增加促进癌细胞的增长[14,15],而GLUT-1特异性抑制剂WZB117通过抑制癌细胞膜GLUT-1的活性进而耗尽细胞内的ATP从而使细胞发生衰老和坏死[6]。Liu W等[7]研究也发现WZB117能有效抑制5氟尿嘧啶耐药的结肠癌细胞GLUT-1的表达,进而产生协同抗癌作用。为了进一步明确GLUT-1在L-OHP耐药中的作用,本研究进行了L-OHP和WZB117对耐药HT-29细胞系活性影响的实验。和上述结果相似,本研究首次观察到L-OHP和WZB117联合作用于人结肠癌细胞可产生协同抗肿瘤作用,其可能的机制为WZB 117抑制GLUT-1的活性,进而抑制Warburg效应而逆转结直肠癌细胞对L-OHP的耐药性。
总之,本研究发现结肠癌细胞对L-OHP的耐药可能与GLUT-1表达上调有关,而GLUT-1特异性抑制剂可逆转结直肠癌细胞对L-OHP的耐药性。GLUT-1可能是未来抗癌药物发展的潜在靶点。
[参考文献]
[1] 饶媚,于芝颖,李小平.奥沙利铂治疗肿瘤耐药相关机制研究进展[J].肿瘤预防与治疗,2011,24(3):204-207.
[2] Li LJ,Li GD,Wei HL,et al.Insulin resistance reducessensitivity to Cis-platinum and promotes adhesion,migrationand invasion in HepG2 cells[J]. Asian Pac J Cancer Prev, 2014,15(7):3123-3128.
[3] Wang YD,Li SJ,Liao JX. Inhibition of glucose transporter 1(GLUT1) chemosensitized head and neck cancer cells to cisplatin[J].Technol Cancer Res Treat,2013,12(6):525-535.
[4] He Z,Dong W,Yao K,et al. Daphnetin inhibits proliferation and glycolysis in colorectal cancer cells by regulating the PI3K/Akt signaling pathway[J]. RSC Advances,2018,8(60):34483-34490.
[5] Wu XL,Wang LK,Yang DD,et al. Effects of Glut1 gene silencing on proliferation,differentiation,and apoptosis of colorectal cancer cells by targeting the TGF-β/PI3K-AKT-mTOR signaling pathway[J]. J Cell Biochem,2018, 119(2):2356-2367.
[6] Liu Y,Cao Y,Zhang W,et al. A small-molecule inhibitor of glucose transporter 1 downregulates glycolysis,induces cell-cycle arrest,and inhibits cancer cell growth in vitro and in vivo[J]. Mol Cancer Ther,2012,11(8):1672-1682.
[7] Liu W,Fang Y,Wang XT,et al. Overcoming 5-Fu resistance of colon cells through inhibition of Glut1 by the specific inhibitor WZB117[J].Asian Pac J Cancer Prev,2014,15(17):7037-7041.
[8] 向征,張才全,汤为学.人结肠癌耐药细胞系HT29/L-OHP的建立及其生物学特性[J].第三军医大学学报,2008,30(9):840-843.
[9] 汪峰,艾泽楠,孙胜,等.LCP联合奥沙利铂对结肠癌细胞HT29细胞增殖和细胞周期的影响[J].实用医学杂志,2013,29(6):873-876.
[10] Vander Heiden MG,Cantley LC,Thompson CB.Understanding the warburg effect:The metabolic requirements of cell proliferation[J].Science,2009,324(5930):1029-1033.
[11] Zhang M,Liu T,Sun H,et al.Pim1 supports human colorectal cancer growth during glucose deprivation by enhancing the Warburg effect[J]. Cancer Sci,2018,109(5):1468-1479.
[12] Zhang X,Yu H,Wang F,et al. Pim-2 modulates aerobic glycolysis and energy production during the development of colorectal tumors[J]. Int J Med Sci,2015,12(6):487.
[13] Li Q,Li Y,Liang L,et al. Klotho negatively regulated aerobic glycolysis in colorectal cancer via ERK/HIF1α axis[J].Cell Commun Signal,2018,16(1):26.
[14] Kunkel M,Reichert TE,Benz P,et al. Overexpression of Glut-1 and increased glucose metabolism in tumors are associated with a poor prognosis in patients with oral squamous cell carcinoma[J].Cancer,2003,97(4):1015-1024.
[15] Davis-Yadley AH,Abbott AM,Pimiento JM,et al. Increased expression of the GLUT-1 gene is associated with worse overall survival in resected pancreatic adenocarcinoma[J]. Pancreas,2016,45(7):974.
(收稿日期:2020-02-17)

