巢湖西湖心底泥蓝藻对水体蓝藻生物量的贡献
史小丽,范 帆,2,张 民,阳 振,陈开宁
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)(2:中国科学院大学,北京 100049)
湖泊富营养化是我国目前以及今后相当长一段时期内的重大水环境问题. 蓝藻在富营养化湖泊中大量增殖,形成水华,对饮用水源、旅游水体和工业用水造成严重的危害. 蓝藻水华的发生机制也备受关注,一直都是研究热点. 1980年,Preston等基于湖泊围隔实验结果首次提出了底泥蓝藻复苏可能对水体蓝藻生物量有重要贡献[1]. 随后欧美湖沼学家开展了一系列有关底泥蓝藻复苏的研究[2-5]. 我国学者孔繁翔和高光针对浅水湖泊,提出了蓝藻水华过程的4阶段理论,即蓝藻生长与水华形成可以分为休眠、复苏、生物量增加(生长)、上浮及聚集4个阶段,每个阶段蓝藻的生理特性及主导环境影响因子有所不同[6]. 春季底泥蓝藻的复苏为水体蓝藻生长提供种源,是水体蓝藻生长的起点. 因此基于该理论,通过削减越冬和复苏底泥蓝藻生物量,可能会降低夏季蓝藻水华强度,市场上也开发了用于去除或削减底泥藻种生物量的设备,包括底泥藻种翻耕设备、大型浮动式湖底除藻设备、底泥藻种洗脱船等. 事实上复苏蓝藻对水体蓝藻的贡献是否显著还存在很多争议. 一些研究结果表明底泥蓝藻具有较高复苏量,浮游蓝藻种群主要通过底泥蓝藻复苏进入水柱中,对水柱最大生物量的贡献可高达50%左右[2,7-8];然而有些研究表明底泥蓝藻复苏量只占水柱藻类生物量的很小一部分[9]. 上述截然相反的结论可能是因为蓝藻复苏量受到蓝藻种类、湖泊类型、环境因子等影响所致[3].
巢湖是我国第五大淡水湖泊,也是我国水污染防治的重点水体. 近30年来,随着流域内人类活动加剧,巢湖水体营养盐和有机质浓度增加,湖泊富营养化进程加快[10-11],以微囊藻和鱼腥藻为优势种属的大面积蓝藻水华频繁发生[12]. 巢湖蓝藻水华已经对饮用水供水安全和巢湖水生态健康造成了威胁. 目前蓝藻水华的防控主要是应急处置,比如对夏季蓝藻实施打捞,然而现有的打捞强度并不能有效控制蓝藻生长[13],仅能缓解蓝藻水华大量堆积造成的次生灾害,因此迫切需要加强蓝藻防控方法的研究. 本研究通过调查巢湖西湖心蓝藻在水体和底泥中的周年分布变化规律,并通过原位蓝藻捕获器,研究巢湖西湖心底泥蓝藻上浮和下沉通量,揭示底泥蓝藻种源对水柱蓝藻的贡献程度,回答是否可以通过削减底泥蓝藻种源控制巢湖蓝藻水华,为科学防控蓝藻水华提供理论支撑.
1 研究方法
1.1 采样点选择与采样
采样点位于巢湖西湖心(31.658625°N,117.366904°E),全年水深在3~4 m之间波动,温度变化范围为3.1~31.7℃,总磷平均浓度为0.18 mg/L(0.069~0.29 mg/L),总氮平均浓度为3.27 mg/L(1.64~6.20 mg/L),平均透明度为25.83 cm(5~50 cm). 由于巢湖主要入湖污染物来自于西北部,西巢湖营养盐水平显著高于其他湖区,蓝藻水华发生概率和蓝藻生物量也相对较高,能代表蓝藻水华发生相对严重的湖泊敞水区. 2018年10月-2019年10月,每月采集一次野外样品. 野外样品包括水样和表层泥样:用5 L有机玻璃采水器采集不同水层(上、中、下)水样后,倒入大桶混合均匀,再取2.5 L混合样;用柱状沉积物采样器(采样管内径Φ84 mm)采集沉积物柱状芯样,并现场切分获取0~2 cm及2~4 cm表层样品. 将采集到的水样和泥样低温避光保存,并于采样当日带回实验室处理分析. 利用多参数水质仪(YSI 6600, 美国YSI公司)原位测定水体理化指标,包括水温、溶解氧(DO)、pH、浊度、氧化还原电位和电导率. 浮游藻类样品通过鲁哥试剂固定.
1.2 野外蓝藻捕获器的安装
在巢湖西湖心安装了自行设计的针对强扰动浅水湖泊的底泥复苏蓝藻捕集装置和下沉蓝藻收集装置. 底泥复苏蓝藻捕集装置由一个旋转支架和一根锚定滑杆构成,旋转支架可沿锚定滑杆上下滑动,旋转支架上装有2组长度不同上浮蓝藻捕集器,每组4个. 上浮蓝藻捕集器由捕集管和捕集管末端的收集瓶组成. 在布设时,先将旋转支架提拉至水面以上,并使捕集器管口竖直朝上,向管内注入无蓝藻的滤后原位湖水,然后下放拉绳使旋转支架及捕集器管口没入水面下,拉动支架在水中翻转180°并用锁止手柄锁定,使捕集器管口朝下,继续下放,直至长捕集器管口插入表泥,此时短捕集器管口悬于底泥上方约10 cm处. 插入表泥的长捕集器用于捕获静态复苏的蓝藻,悬于表泥之上的短捕集器用于捕获有风浪扰动状态下的复苏蓝藻,比较两种工况下的蓝藻复苏量. 下沉蓝藻收集装置包括下沉蓝藻收集管、收集管管架和锚定滑杆,收集管底部具有底塞. 布设时,将下端口具有底塞的收集管装载入管架,并向管内注入无蓝藻的滤后原位湖水,然后下放收集装置至湖底(图1).

图1 底泥复苏蓝藻捕集装置示意图Fig.1 Schematic diagram of cyanobacteria capture device for sediment recovery
1.3 室内分析
水样带回实验室后,用GF/C 玻璃纤维滤膜过滤,滤液参照标准方法测定溶解性营养盐[14]. 取2 mL原水样,使用调制叶绿素荧光仪(PHYTO-PAM,德国WALZ公司)测定蓝藻门生物量(以叶绿素a(Chl.a)表征)及蓝藻门、绿藻门和硅藻门的光合活性,每次检测重复3次.
对底泥蓝藻生物量和光合活性检测前,首先对底泥中活性蓝藻细胞进行离心分离和提纯:用胶头吸管或注射器吸取1 mL野外采集的底泥样品(吸取前将采样袋中泥样混匀)至15 mL离心管中,加入10 mL 29%(v/v)的Percoll密度分离液(美国GE公司)摇匀,用离心机(Allegra X-22R,美国Beckman公司)在7200 r/min下离心30 min,取出后用移液枪贴管壁缓慢吸取含藻上清液2 mL于PAM测量杯中进行检测. 每次检测重复3次. 对复苏蓝藻捕集装置及下沉蓝藻收集装置所获得的样品的检测方法分别与上述水样和泥样的检测方法相同.
浮游藻类通过显微镜观察和计数. 每个水样根据藻类生物量的多少取500~1000 mL按100∶1的比例用鲁哥固定液固定,静置48 h后,浓缩到一定的体积,浓缩后样品用于藻类的鉴定,藻类鉴定参照文献[15]. 用每个物种的细胞浓度乘以估计的该物种的细胞体积就得到了每个物种的生物体积(mm3/L)[16],根据通常的假设浮游植物的密度近似1 mg/mm3,生物体积可直接转化为生物量(mg/L).
1.4 结果分析
利用Microsoft Excel 2010、Origin 8.0 for Windows和ArcGIS 9.3软件进行数据整理、统计分析和制图.
2 结果
2.1 巢湖西湖心浮游藻类群落结构和全年演替规律
巢湖西湖心浮游藻类优势种属为微囊藻属(Microcystis)、席藻属(Phormidioideae)、十字藻属(Crucigenia)、卵形隐藻(Cryptomonasovata)和鱼腥藻属(Anabaena),生物量比例分别达到了43.39%、23.7%、13.04%、7.9%和6.01%. 浮游藻类在月尺度上发生了明显的演替,6-10月主要以微囊藻属为优势种属;8月隐藻属的比例较高;11月和12月主要藻类种属为卵形隐藻、鱼腥藻属和微囊藻属;1-3月以十字藻属、席藻属为主,伴有少量扁裸藻属(Phacus);4月主要为席藻属;5月微囊藻属和席藻属共同存在(图2). 藻类的光合能力全年也发生了明显变化,其中蓝藻的光合活性在5-8月最高,9月至来年3月保持在一个较低水平;绿藻的光合活性在5月达到峰值,而在夏季低于检测限;硅藻的活性全年都相对较高,1月达到峰值(图3).
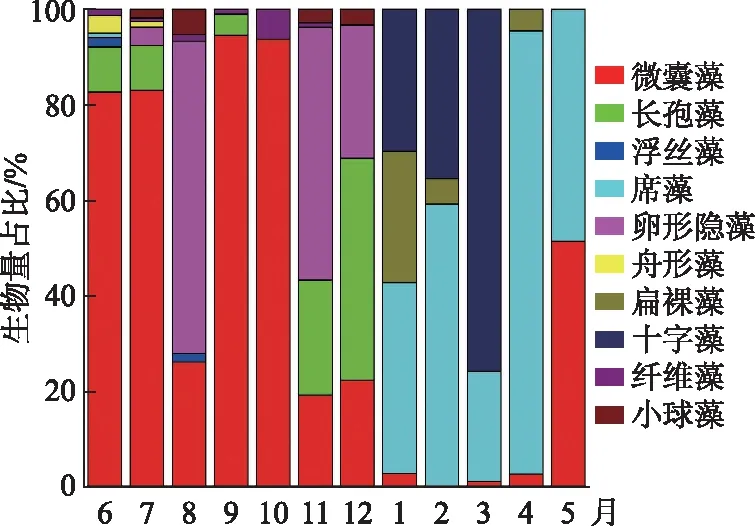
图2 巢湖西湖心浮游藻类群落结构的演替Fig.2 The succession of phytoplankton community structure in the center of western Lake Chaohu
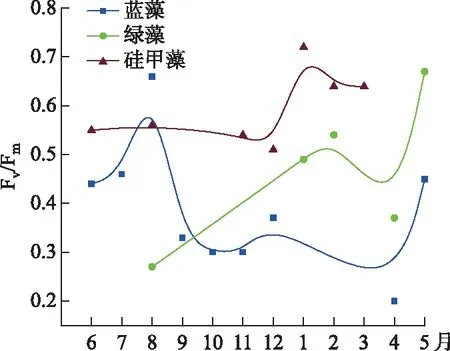
图3 巢湖西湖心浮游藻类光合活性的变化Fig.3 The photosynthetic activity of phytoplankton in the center of western Lake Chaohu
2.2 巢湖水体和底泥蓝藻生物量的时间演替格局
从时间尺度上看,巢湖西湖心水柱蓝藻生物量一年有两个峰值,出现在2月和9月,分别达到了8和12 μg/L,11-1月和3-6月处于相对较低水平. 底泥蓝藻生物量全年呈现出一定的变化规律,11月底泥蓝藻生物量上升,在来年2月达到峰值,随后下降,在夏季降到最低值. 巢湖西湖心底泥蓝藻生物量最高值达到1500 μg/g(DW),最低值低于检测限(图4).
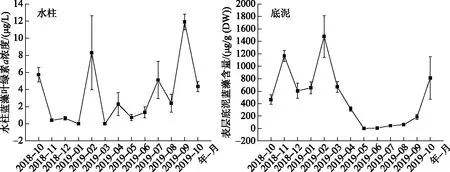
图4 巢湖西湖心水柱和底泥蓝藻生物量Fig.4 The chlorophyll-a concentration of cyanobacteria in water column and sediment in the western center of Lake Chaohu
2.3 蓝藻生物量在水柱和底泥中的相对分布规律
巢湖西湖心水柱蓝藻生物量9月达到峰值,水柱的Chl.a总量最高为4.17 μg /cm2. 底泥蓝藻生物量在10月开始升高,在来年2月达到最高值,底泥蓝藻Chl.a含量达到0.85 μg /cm2. 底泥蓝藻主要分布在表层(0~2 cm),次表层底泥(2~4 cm)蓝藻生物量仅在11月相对较高. 水柱与底泥蓝藻生物量的比值全年发生了很大的变化,在夏季(6-8月),两者最小比值约为24,最大比值超过100,说明绝大部分蓝藻主要分布在水柱中,而在10月至来年4月,水柱与底泥蓝藻生物量比值相对较低,最低小于2(图5).

图5 蓝藻在水柱和沉积物中的分布Fig.5 The distribution of cyanobacteria biomass between water column and sediment
2.4 巢湖西湖心蓝藻垂直迁移通量
通过设定捕获器,得到了巢湖西湖心底泥蓝藻静态释放和有扰动影响的动态释放通量. 在没有扰动影响的情况下,从底泥主动迁移到水体中的蓝藻生物量在全年都很低,而扰动带来的底泥蓝藻向水体迁移的通量远远高于静态迁移通量,全年有两个峰值,分别出现在6月和10月,最高值达到了700 ng Chl.a/(d·cm2)(图6). 蓝藻从水柱向底泥迁移的通量全年也有两个峰值,分别在11月和3月,最高值达到了70.55 ng Chl.a/(d·cm2)(图7).
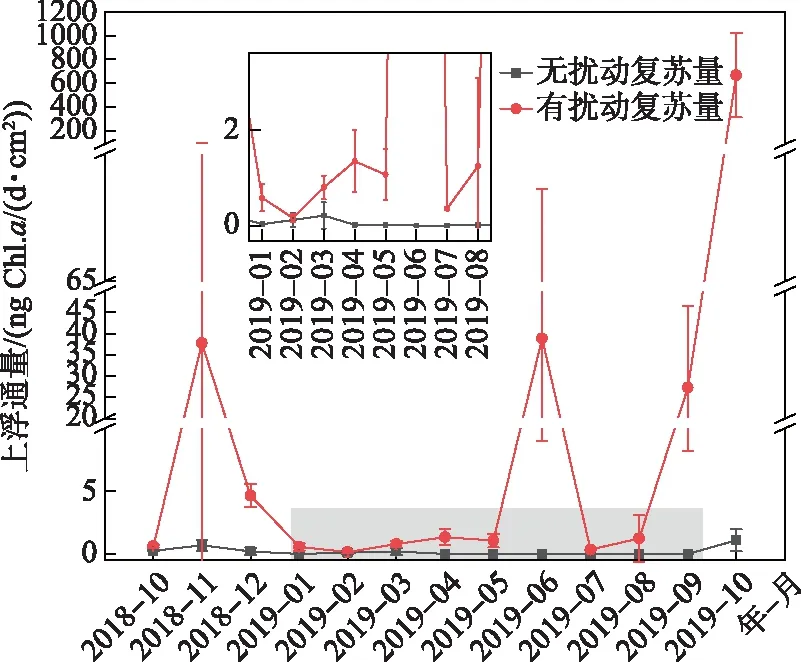
图6 蓝藻从底泥迁移到水柱中的生物量Fig.6 The recruitment biomass of cyanobacteria from sediment to water

图7 蓝藻从水柱进入底泥的生物量Fig.7 The sedimentation biomass of cyanobacteria from water column to sediment
3 讨论
3.1 蓝藻在水体和底泥中的分布规律
由于本研究采用Percoll溶液提取底泥蓝藻,样品量较低,用PAM可实现快速测定,蓝藻生物量用蓝藻Chl.a浓度表征. 为了与底泥蓝藻检测方法一致,水体蓝藻生物量也用该方法测定,因此绝对值小于常规方法(抽提过GF/C滤膜的Chl.a)的测定结果. 西巢湖湖心水柱和底泥蓝藻生物量具有时间变化规律. 水柱蓝藻生物量在2月和9月达到峰值,蓝藻优势种属分别为席藻属和微囊藻属. 水柱蓝藻活性在10月降到最低,表明此时蓝藻细胞大量衰亡,造成大量水柱蓝藻沉降到底泥,致使底泥表层蓝藻生物量显著升高. 法国Grangent水库的全年监测结果表明,春季水体蓝藻酯酶活性开始增加,到夏季达到峰值,随后酯酶活性下降,在秋末达到最低值,冬季一直处于较低水平[17],这与本研究中的光合活性年度变化规律一致. 湖泊蓝藻在水华末期,会经历衰老和程序性死亡,这可能与不利的环境条件有关系,包括低光强、CO2限制、氧化还原条件或盐离子压力等[18-19]. 不同种群蓝藻的衰亡下沉特征不同,例如铜绿微囊藻(M.aeruginosa)的沉降速率远远高于挪氏微囊藻(M.novacekii)和水华微囊藻(M.flos-aquae)[20]. 此外蓝藻形态或生理类型对沉降有重要影响. 底泥蓝藻生物量3月开始明显下降,在5-8月处于较低水平. 已有研究报道,底泥蓝藻在低温,例如5℃时可存活22周,随着温度的升高,底泥蓝藻会发生死亡降解,25℃时90%的藻细胞会在3个月内死亡[21]. 此外,我们的显微镜观察发现,随着温度升高,底泥蓝藻在胶鞘中的完整细胞越来越少.
本研究首次对巢湖西湖心底泥和水体蓝藻生物量进行了周年调查,结果表明,底泥蓝藻生物量在10月达到最大值,但此时仍小于水柱蓝藻生物量. 一些研究表明大部分微囊藻会在水体中分解死亡,只有少部分微囊藻会沉降在底泥[22]. 本团队已有研究结果表明,太湖水体蓝藻的裂解速率在10月达到峰值[23],造成水体溶解性有机质浓度显著增加[24]. 虽然秋季大量蓝藻衰亡沉降到底泥,冬季太湖微囊藻水华强度也远远小于夏、秋季,但微囊藻仍能在低于10℃的水体中保持较低活性,蓝藻死亡和分解速度也相对较低,有利于蓝藻水华的维持,当温度高于12.5℃时,便重新生长[25].
3.2 底泥蓝藻垂直迁移通量的变化规律
孔繁翔等的“四阶段”理论认为,湖泊底泥表面“休眠”越冬的蓝藻,有较强的适应低温和低光照能力,会在春季复苏,并上浮至上层水柱中生长,这部分种源在适宜的水环境中大量增殖,最终对夏季蓝藻生物量有重要的贡献. 然而底泥中微囊藻是否能进入水体还存在很大的争议. 一些研究认为蓝藻会有从水体到底泥的下沉过程,但不会有太多复苏蓝藻进入水体[9]. 有研究在浅水区底泥样品中发现了70%~80%只有胶鞘没有细胞的群体微囊藻,因此认为微囊藻沉降到底泥后可能会快速分解[3]. 太湖梅梁湾原位捕获器实验结果表明,底泥藻种对水柱藻种的贡献只有2.15%[26]. 事实上,水体蓝藻生物量可能远远高于其垂直迁移量的通量,底泥复苏蓝藻量对水体蓝藻的贡献并不显著[27]. 然而另一些研究认为底泥复苏蓝藻是水体蓝藻的主要贡献者[1]. 结合原位生长速率和底泥蓝藻复苏通量,足以解释夏季适宜条件下的水体蓝藻能达到的生物量[5].
本研究在巢湖西湖心安装了针对强扰动浅水湖泊的底泥复苏蓝藻捕集装置,定期观测每月水体蓝藻下沉和底泥蓝藻上浮的通量. 观测结果表明,水体蓝藻下沉通量远远高于底泥蓝藻上浮通量,比值最高达到一百倍以上;同时水体蓝藻的下沉通量在全年有明显的双峰变化模式,11月最高,3月出现了另一个峰值,表明巢湖西湖心蓝藻在秋季和春季有明显的从水柱向底泥迁移的过程,可能分别与微囊藻和席藻的衰亡下沉有关,这与底泥蓝藻生物量的两个峰值有很好的吻合. 我们也分析了蓝藻上浮和下沉通量与水柱生物量的比值,发现春、夏季蓝藻上浮/下沉通量在水柱蓝藻生物量中的占比都很小,小于1%. 秋末冬初(9-12月)蓝藻垂直迁移通量的贡献相对较大,特别是2018年11月蓝藻下沉量是水柱蓝藻生物量的6倍,表明此时水体中大部分蓝藻都衰亡沉降了,其他3个月蓝藻下沉迁移通量对水柱蓝藻的贡献大部分在10%~30%之间;扰动造成的底泥蓝藻上浮通量对水柱蓝藻的贡献也是在10月和11月相对较高,特别是在2018年11月,是水柱蓝藻生物量的3.8倍. 蓝藻衰亡下沉导致大部分蓝藻聚集在水-沉积物界面上,随着风浪的扰动,又会进入水体,被捕获器获取,但由于藻自身已处于衰亡期,最终还是会沉降到底泥上. 随着风浪扰动,这可能是一个反复的过程.
蓝藻从底泥向水体中的迁移是通过调节浮力的主动迁移,还是通过再悬浮的被动迁移,仍然存在广泛争议. 本研究结果表明底泥蓝藻向水体中的静态释放量在全年都很低,而在模拟自然湖流扰动条件下,在6月和10月底泥蓝藻发生了两次明显的向上迁移过程. 这可能与高底泥蓝藻生物量和风浪扰动有很大关系. 本研究结果表明,大部分底泥蓝藻分布在表层0~2 cm,在风浪扰动频繁的大型浅水湖泊,底泥再悬浮对底泥蓝藻的垂直迁移有重要的影响. 生物扰动或风浪扰动带来的再悬浮,使埋在下层底泥的藻类获得光照[28]. 高光强有利于底泥蓝藻的复苏,因此湖泊深度是影响越冬和迁移蓝藻量的重要因素,通常认为浅水区域的底泥藻种复苏是水体蓝藻的重要来源[29]. 此外温度也是影响底泥蓝藻复苏的主要因子,野外原位调查和室内试验结果表明,底泥蓝藻在9~12℃之间复苏进入水体[30],这可能与微囊藻群体在此温度范围内上浮能力增强[31]和底泥群体蓝藻粒径增大有关[32]. 底泥来源(近岸/敞水区)也是影响蓝藻复苏的重要因子,在同样条件下,近岸带蓝藻更容易复苏. Erken湖的研究结果表明底泥蓝藻复苏量在水深为1 m的近岸湖区最大,而在超过3 m深的湖区内则很小[33]. 本研究的模拟装置悬挂在巢湖西湖心,全年平均水深为3.3 m,由于藻类的生长和底泥再悬浮,水体平均透明度只有30 cm左右,因此底泥表层的光强相对很弱,不利于底泥蓝藻的生长和复苏,即便在温度适宜的条件下,也没有观察到明显的复苏现象. 本研究结果仅代表巢湖敞水区底泥蓝藻复苏的现状,需要进一步对近岸区域蓝藻复苏进行调查和研究.
4 结论
1)巢湖西湖心蓝藻的主要优势种属在5-10月为微囊藻属,11-12月为鱼腥藻属,1-4月为席藻属.
2)巢湖西湖心水柱蓝藻生物量在1月和9月达到两个峰值,底泥蓝藻生物量在10月到来年2月最高,主要分布在0~2 cm的底泥表层.
3)巢湖西湖心蓝藻主要分布在水柱中,底泥蓝藻生物量对湖泊蓝藻生物量的贡献很小,单位面积水柱蓝藻与底泥蓝藻量在6月的比值大于100,在11月到来年3月间的比值相对较小.
4)巢湖西湖心蓝藻在11月和2月有明显从水柱迁移到底泥的过程;而底泥蓝藻靠自身主动复苏迁移到水体中的通量很低,向上迁移通量主要受底泥蓝藻生物量和再悬浮的影响.
5)削减巢湖西湖心底泥种源的最佳时期为10月至来年2月,但由于底泥蓝藻向水体复苏迁移的量较低,水柱蓝藻生物量高于底泥蓝藻生物量,即使削减了底泥种源,也不能有效降低水体蓝藻生物量.
6)本研究结果仅能说明巢湖敞水区蓝藻复苏的状况,需要进一步对近岸区域进行调查研究.

