离子强度对煮制前后猪肉胶原蛋白乳化特性的影响
祝超智 李珊珊 崔文明 赵改名 李佳麒 银峰 焦阳阳 唐颖达

摘 要:为研究离子强度对煮制前后猪肉胶原蛋白乳化特性的影响,测定煮制前后不同NaCl浓度(0.0、0.2、0.4、0.6 mol/L)猪肉可溶性胶原蛋白和不溶性胶原蛋白的乳化特性,包括乳化活性指数(emulsification activity index,EAI)、
乳化稳定性指数(emulsion stability index,ESI)、黏度及乳化液微观结构,同时测定猪肉胶原蛋白溶解度。结果表明:随着介质离子强度的提高,猪肉可溶性胶原蛋白溶解度降低,黏度增大,EAI先升高后降低,ESI先降低后升高;猪肉不溶性胶原蛋白溶解度升高,黏度增大,EAI、ESI均呈先升高后降低趋势。改变胶原蛋白的离子强度或对胶原蛋白进行热处理,均能使猪肉可溶性胶原蛋白和不溶性胶原蛋白的乳化特性发生显著变化。
关键词:离子强度;猪肉胶原蛋白;乳化特性;溶解度
Effect of Ionic Strength on the Emulsification Characteristics of Pork Collagen before and after Cooking
ZHU Chaozhi, LI Shanshan, CUI Wenming, ZHAO Gaiming*, LI Jiaqi, YIN Feng, JIAO Yangyang, TANG Yingda
(College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China)
Abstract: In order to explore the effect of ionic strength on the emulsification characteristics of pork collagen before and after cooking, this study evaluated the emulsification properties of soluble and insoluble pork collagen in the presence of different concentrations of NaCl (0.0, 0.2, 0.4 and 0.6 mol/L), including emulsification activity index (EAI), emulsion stability index (ESI), viscosity, emulsion microstructure, and solubility. The results showed that with increasing ionic strength, the solubility of soluble collagen decreased, the viscosity increased, EAI first increased and then decreased, while ESI exhibited the opposite trend; the solubility and viscosity of insoluble collagen increased, and both EAI and ESI showed a trend of first increase and then decrease. In conclusion, the change in ionic strength or heat treatment could significantly change the emulsification characteristics of both soluble and insoluble pork collagen.
Keywords: ionic strength; pork collagen; emulsification characteristics; solubility
DOI:10.7506/rlyj1001-8123-20191206-300
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2020)06-0008-06
引文格式:
祝超智, 李珊珊, 崔文明, 等. 离子强度对煮制前后猪肉胶原蛋白乳化特性的影响[J]. 肉类研究, 2020, 34(6): 8-13. DOI:10.7506/rlyj1001-8123-20191206-300. http://www.rlyj.net.cn
ZHU Chaozhi, LI Shanshan, CUI Wenming, et al. Effect of ionic strength on the emulsification characteristics of pork collagen before and after cooking[J]. Meat Research, 2020, 34(6): 8-13. DOI:10.7506/rlyj1001-8123-20191206-300.
http://www.rlyj.net.cn
膠原蛋白是一种三螺旋纤维状蛋白质[1],存在于动物的皮肤、血管、骨骼、肌腱、韧带等部位,在哺乳动物体内分布广且含量多,与各个组织和器官功能相关,占体内蛋白质总量的25%~30%[2],与细胞间信息传递、组织形成和成熟、细胞增生和分化、细胞免疫、肿瘤转移及伤口愈合、钙化作用、血液凝固和衰老等有紧密
联系[3]。胶原蛋白具有良好的生物相容性[4]、可降解性、低过敏性及生物活性,在食品加工[5-7]、医药保健[2,8]和化妆品[9-10]等领域有着非常广泛的应用。
刘晶晶等[11]研究表明,胶原蛋白对乳化肉制品的嫩度、质构、剪切力和出品率有直接影响。王碧等[12]研究水解胶原蛋白的乳化性能,结果表明,随着胶原蛋白溶液质量浓度的增加,胶原蛋白的乳化活性和乳化稳定性增强,在酸性、碱性溶液中表现出较高的乳化活性和乳化稳定性,同时,一定浓度的电解质也可以提高胶原蛋白的乳化活性和乳化稳定性。
食盐是肉类加工不可缺少的辅料,能有效提高离子强度。添加一定量的食盐可以提高肉制品的乳化
能力[13-14]。食盐可以直接影响胶原蛋白的理化和加工特性,但过高用量会影响人体健康,过低用量可能会影响蛋白的加工特性,导致肉制品品质变化[15-16]。蛋白质分子间的相互作用力对乳化性也有明显影响[17]。胶原蛋白溶液黏度受到多种因素的影响,随着外加电解质的改变而改变;在偏离胶原蛋白等电点时,由于外在离子的影响,胶原蛋白溶液黏度也会发生变化[18]。目前关于NaCl对肌肉蛋白质加工特性影响的研究较多,但对可溶性胶原蛋白和不溶性胶原蛋白乳化特性影响的研究较少。
本研究以冷鲜猪肉为原料,提取并分离可溶性与不溶性胶原蛋白,以煮制前后胶原蛋白为乳化剂,大豆油为油相,模拟肉汤构建乳化体系,用NaCl改变介质的离子强度,研究离子强度对冷鲜猪肉胶原蛋白乳化特性(包括乳化活性指数(emulsification activity index,EAI)、
乳化稳定性指数(emulsion stability index,ESI)、乳化液黏度)的影响以及离子强度和煮制处理造成胶原蛋白乳化性质差异的原因,以期优化乳化型肉制品的生产配方,降低NaCl用量,为低盐乳化型肉制品的加工生产提供理论依据。
1 材料与方法
1.1 材料与试剂
猪里脊(带皮)(长白猪,胴体质量120 kg,平均日龄180 d,宰后pH24 h 5.8±0.1)购于双汇丰产路店,于-18 ℃冰箱贮藏备用,使用前在4 ℃冰箱解冻24 h;非转基因大豆油 益海嘉里金龙鱼粮油食品股份有限公司。
碳酸氢钠、氯化钠、磷酸氢二钠、磷酸二氢钠、六水氯化钙 国药集团化学试剂有限公司;氯胺T 天津大茂化学试剂有限公司;对二甲氨基苯甲醛 上海易恩试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 北京索莱宝生物科技有限公司;异丙醇 天津市富宇精细化工有限公司;正丙醇 天津市风船化学试剂科技有限公司;所用试剂均为分析纯。
1.2 仪器与设备
UV-2600紫外-可见分光光度计 日本岛津有限公司;
DZKW-C恒温水浴锅 上海树立仪器有限公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;NDJ系列黏度计 上海精天电子仪器有限公司;Allegra 64R高速冷冻离心机 贝克曼库尔特商贸(中国)有限公司;Eclipse 80i科研级显微镜 日本尼康仪器有限公司;T10 Ultra-Turrax高速分散器 德国IKA公司;BPG-9156A精密鼓风干燥箱 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 猪肉胶原蛋白的提取
1.3.1.1 肉样加热预处理
在4 ℃条件下将肉样解冻24 h,剔除表面脂肪和肌膜,切成1.0 cm×1.0 cm×2.0 cm肉块,用蒸煮袋包装,在水浴锅中沸水(100 ℃)加热90 min,流水冷却至室温,立即取出,用吸水纸吸干肉块表面水分,待用。
1.3.1.2 可溶性胶原蛋白和不溶性胶原蛋白的分离
采用Ringers试剂溶解法[1]。配制Ringers试剂(1.8 g NaCl、0.25 g KCl、0.06 g CaCl2·6H2O、0.05 g NaHCO3、0.186 g碘乙酸,溶于1 L蒸馏水),精确称量预处理后样品5 g,加入8 mL Ringers试剂,用高速分散器将肉样打碎,混匀溶胀1 h后在77 ℃水浴中加热1 h;冷却至室温,3 300×g离心20 min,收集上清液,重复2 次。所得上清液即为可溶性胶原蛋白,沉淀为不溶性胶原蛋白。
1.3.2 猪肉胶原蛋白含量测定
参考GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》测定羟脯氨酸含量,按照式(1)~(2)分别计算猪肉中不溶性胶原蛋白和可溶性胶原蛋白含量。
(1)
(2)
1.3.3 不同NaCl浓度猪肉胶原蛋白溶液的制備
参考吴菊清等[19]的方法,称取一定量胶原蛋白(可溶性胶原蛋白和不溶性胶原蛋白)溶于NaCl浓度为0.0、0.2、0.4、0.6 mol/L的磷酸盐缓冲液
(50 mmol/L Na2HPO4-NaH2PO4,pH 6.5)中,配制不同NaCl浓度的胶原蛋白溶液(NaCl浓度分别为0.0、0.2、0.4、0.6 mol/L),使最终溶液中可溶性胶原蛋白质量浓度均为34 ?g/mL,不溶性胶原蛋白质量浓度均为
25 ?g/mL。1 组于4 ℃左右保存待用;另1 组于100 ℃水浴30 min,冷却至室温,待用;分别作为煮制前后胶原蛋白溶液。
1.3.4 猪肉胶原蛋白溶解度测定
采用双缩脲法[20]并稍作修改。分别取7 mL煮制前后不同NaCl浓度的可溶性胶原蛋白和不溶性胶原蛋白溶液,1 500×g离心10 min,取上清液及离心前不同NaCl浓度的胶原蛋白溶液各2 mL,分别加入8 mL双缩脲试剂混匀,同时取不同NaCl浓度的磷酸盐缓冲液(50 mmol/L
Na2HPO4-NaH2PO4,pH 6.5)2 mL与8 mL双缩脲试剂混匀后作为空白对照,置于20~25 ℃保温30 min,用紫外分光光度计于540 nm波长处测定吸光度,每个处理重复测定3 次。以胶原蛋白溶液中羟脯氨酸质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程为y=0.189 2x+
0.046 0(R2=0.999 1),根据标准曲线及羟脯氨酸与胶原蛋白含量换算关系得出胶原蛋白质量浓度。胶原蛋白溶解度按式(3)计算。
(3)
式中:ρ2为离心后上清液中胶原蛋白质量浓度/(?g/mL);ρ1为离心前溶液中胶原蛋白质量浓度/(?g/mL)。
1.3.5 猪肉胶原蛋白乳化液的制备
参考郝月慧[21]的方法,并进行适当修改。分别取煮制前后4 mL 34 ?g/mL不同NaCl浓度可溶胶原蛋白溶液和25 ?g/mL不溶胶原蛋白溶液于10 mL离心管中,加入1 mL大豆油,用高速分散器进行匀浆,14 000 r/min匀浆20 s,暂停10 s,共匀浆1 min,得到不同NaCl浓度的胶原蛋白乳化液。
1.3.6 猪肉胶原蛋白乳化液EAI及ESI测定
参考Ramírez-Suárez等[22]的方法,并稍作修改。取煮制前后不同NaCl浓度的可溶性胶原蛋白和不溶性胶原蛋白乳化液,分别于制备后0 min和静置10 min时于乳液底部迅速移取30 μL,用0.1 g/100 mL SDS溶液稀释500 倍,以0.1 g/100 mL SDS溶液作为空白,立即于500 nm波长处测定吸光度,按式(4)~(5)计算乳化液EAI及ESI。
式中:ρ为乳化前胶原蛋白溶液质量浓度/(g/mL);
φ为乳化液中油相体积分数/%;A0为0 min时胶原蛋白乳化液吸光度;500为稀释倍数;A10为静置10 min时胶原蛋白乳化液吸光度;10为间隔时间/min。
1.3.7 猪肉胶原蛋白乳化液黏度测定
采用数显式黏度计,选择1号转子在60 r/min转速下迅速测定新制猪肉胶原蛋白乳化液黏度,每个处理组平行测定3 次。
1.3.8 猪肉胶原蛋白乳化液微观结构观察
迅速从离心管底部取适量新制乳化液,在载玻片上涂抹均匀,在4 ℃条件下冷却1 d,在相差显微镜下观察拍照,放大倍数400。
1.4 数据处理
所有实验均重复3 次,结果表示为平均值±标准差。采用SPSS 16.0统计软件进行统计学分析,数据间显著性分析采用多因素方差分析和Duncans多重比较法,显著性水平设为P<0.05。
2 结果与分析
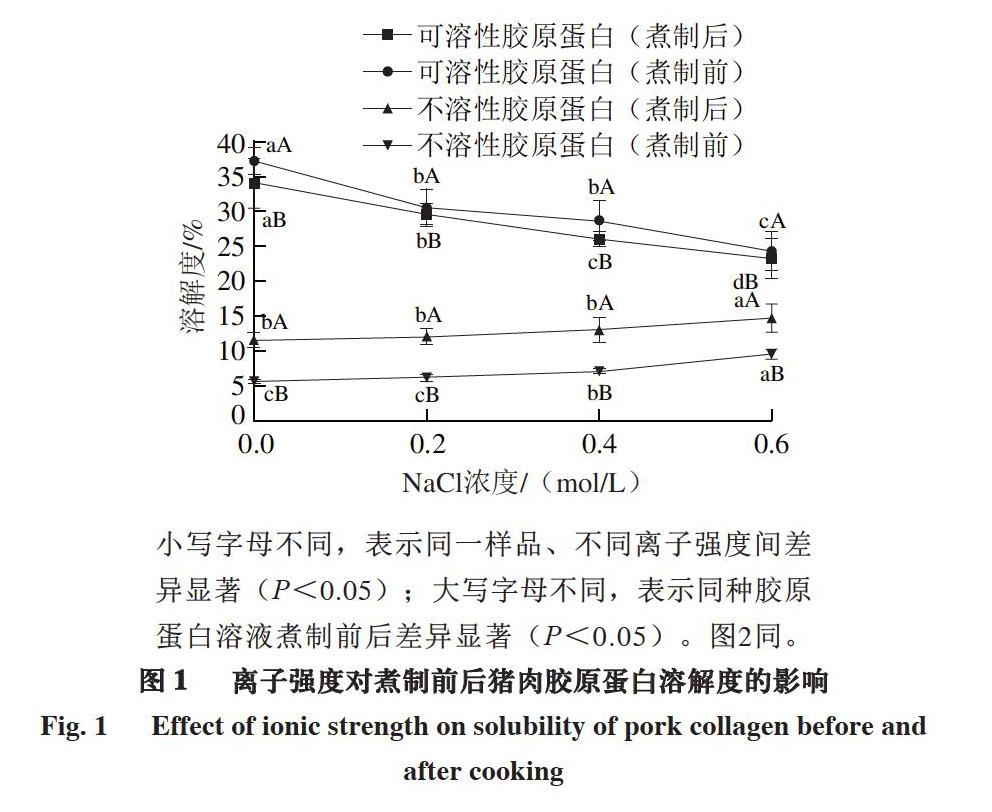
2.1 离子强度对煮制前后猪肉胶原蛋白溶解度的影响
小写字母不同,表示同一样品、不同离子强度间差异显著(P<0.05);大写字母不同,表示同种胶原蛋白溶液煮制前后差异显著(P<0.05)。图2同。
由图1可知,随着介质离子强度的提高,不溶性胶原蛋白溶解度逐渐增加,NaCl浓度为0.6 mol/L时达到最大。可溶性胶原蛋白溶解度的变化趋势与不溶性胶原蛋白相反,随着离子强度的增加逐渐下降,NaCl浓度为0.6 mol/L时,溶解度达到最小。这可能是由于胶原蛋白产生盐析[23],使其溶解度降低,NaCl浓度为0.6 mol/L时的盐析程度最大。100 ℃煮制处理对可溶性胶原蛋白与不溶性胶原蛋白溶解度的影响不同,煮制30 min可以显著提高不溶性胶原蛋白溶解度(P<0.05),但对于可溶性胶原蛋白,其溶解度相对于未经煮制的处理组显著降低(P<0.05)。这可能是由于加热使胶原蛋白变性,从而影响其溶解度,另外,煮制时溶解的猪肉胶原蛋白会随着蒸煮损失流失,也会导致溶解度降低[24]。
2.2 离子强度对煮制前后猪肉胶原蛋白乳化特性的影响
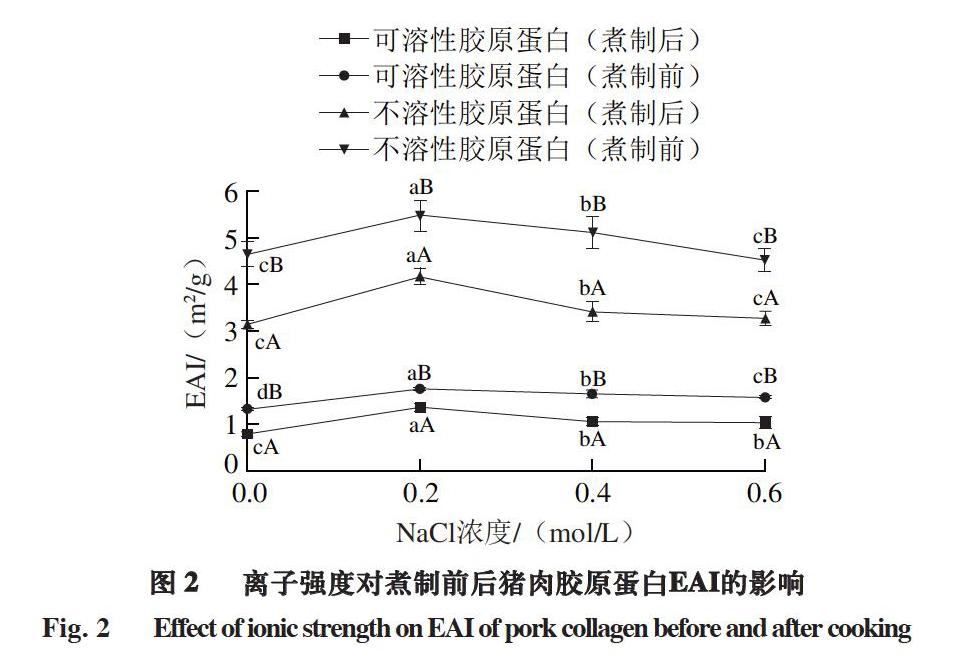
2.2.1 离子强度对煮制前后猪肉胶原蛋白乳化活性的影响
乳化活性是蛋白质之间或蛋白质与脂肪之间的相互作用[25-26],乳化活性增加有助于乳化物的形成[27]。由图2可知,NaCl浓度(0.0~0.2 mol/L)较低时,随着离子强度增加,煮制前后猪肉可溶性胶原蛋白EAI均呈现上升趋势,NaCl浓度为0.2 mol/L时达到最大,之后随着离子浓度增加,NaCl濃度0.4、0.6 mol/L可溶性胶原蛋白的EAI均显著下降(P<0.05)。不溶性胶原蛋白EAI的变化趋势与可溶性胶原蛋白相同,随着离子强度增加,EAI先升高后下降,NaCl浓度为0.2 mol/L时达到最大。这是由于NaCl的加入可能起到两方面作用[18,28-29]:一方面,离子强度增加会降低胶原蛋白分子间斥力,有利于胶原蛋白溶解,胶原蛋白充分发挥表面活性剂的作用,使油滴更容易与其结合,从而提高乳化性;另一方面,随着离子强度增加,盐离子会对扩散的双电层厚度进行压缩,导致乳化液液滴表面电位降低,乳化液体系斥力能垒下降,因此液滴间易产生聚集,引起乳化活性降低。离子强度较低时,前者起主要作用,随着离子强度增加,后一种作用更明显,胶原蛋白乳化活性随着NaCl浓度的增加而降低[30-31]。因此,一定范围内离子强度的增加有利于减少胶原蛋白间的排斥力,提高其EAI,但当离子强度超过一定范围,胶原蛋白出现凝聚,使其EAI降低。煮制后猪肉胶原蛋白EAI较煮制前显著降低(P<0.05),这可能是由于加热使表面电荷减少,导致乳化液体系斥力下降,液滴间易产生聚集,从而引起乳化性下降[32]。
2.2.2 离子强度对煮制前后猪肉胶原蛋白乳化稳定性的影响
由表1可知,随着NaCl浓度的增加,猪肉胶原蛋白ESI的变化趋势较为复杂,煮制前后可溶性胶原蛋白ESI均为先降低后升高再下降,NaCl浓度0.4 mol/L组显著高于0.0、0.2 mol/L组(P<0.05),0.6 mol/L组较0.4 mol/L组有下降趋势,但煮制后猪肉可溶性胶原蛋白ESI下降趋势不明显。可溶性胶原蛋白的ESI与EAI具有相反的变化趋势,即在EAI较低的离子强度条件下,ESI较高,NaCl浓度为0.2 mol/L时,猪肉可溶性胶原蛋白EAI达到最大,但此时ESI最低。这与高金龙[18]的研究一致。随着NaCl浓度上升,猪肉不溶性胶原蛋白ESI先升高后降低,NaCl浓度为0.2 mol/L时ESI最高;NaCl浓度(0.0~0.2 mol/L)较低时ESI较高,随着离子强度增加,ESI显著下降(P<0.05),0.4、0.6 mol/L组间差异显著(P<0.05)。煮制后猪肉胶原蛋白ESI较煮制前显著提高(P<0.05),这可能是由于加热加速了蛋白质巯基转化为二硫键,增大了蛋白质空间位阻,从而提高了乳化液稳定性[33]。
2.2.3 离子强度对煮制前后豬肉胶原蛋白黏度的影响
由表2可知,随着NaCl浓度增加,煮制前后猪肉可溶性胶原蛋白黏度均逐渐增大,NaCl浓度达到0.6 mol/L时,可溶性胶原蛋白黏度达到最大,且显著高于其他实验组(P<0.05)。随着NaCl浓度增加,不溶性胶原蛋白黏度逐渐增加,各实验组间均有显著差异(P<0.05),0.6 mol/L组显著高于其他实验组(P<0.05)。猪肉胶原蛋白经过煮制后,黏度显著增大(P<0.05)。这是由于胶原蛋白是典型的两性聚电解质,NaCl的加入产生以下几方面作用:1)增强溶剂极性,从而增强胶原蛋白及多肽疏水缔合作用,容易形成具有大流体力学体积的聚集体,离子强度越大,这种作用越大,黏度越大;2)屏蔽胶原蛋白及多肽分子内正负基团的相互作用,使盐键受到破坏,分子链伸展,黏度升高;3)离子强度越大,对聚合物侧基电荷的屏蔽作用越强,更容易引起链蜷曲,造成黏度下降;但由于前两方面的作用对黏度的贡献远大于后者,因此盐的加入导致黏度明显上升[34-35]。
2.3 离子强度对煮制前后猪肉胶原蛋白乳化液微观结构的影响
2.3.1 离子强度对煮制前后猪肉可溶性胶原蛋白乳化液微观结构的影响
由图3可知,离子强度较低时(NaCl浓度0.0~0.2 mol/L),猪肉可溶性胶原蛋白乳化液粒径随着NaCl浓度的增加逐渐变小,粒径较大的乳化液液滴数量也逐渐变少,NaCl浓度0.2 mol/L时的乳化液粒径最小,大微粒数量最少,分布较均匀。随着离子强度继续增加,乳化液微粒直径逐渐增大,大微粒数量增多。猪肉可溶性胶原蛋白经过煮制,乳化液微粒粒径同样随着离子强度的增加先变小后增大。煮制前胶原蛋白乳化液微粒分布较煮制后更加密集、均匀。
A~D. NaCl浓度分别为0.0、0.2、0.4、0.6 mol/L;
下标1、2. 分别表示煮制前、煮制后。图4同。
2.3.2 离子强度对煮制前后猪肉不溶性胶原蛋白乳化液微观结构的影响
由图4可知,猪肉不溶性胶原蛋白乳化液微粒呈条状,离子强度(NaCl浓度0.0~0.2 mol/L)较低时,随着NaCl浓度的增加,不溶性胶原蛋白乳化液微粒粒径逐渐减小,分布均匀。NaCl浓度为0.2 mol/L时的乳化液微粒分布最均匀。随着离子强度继续增加,乳化液颗粒分布逐渐稀疏。煮制前不溶性胶原蛋白乳化液微粒分布较煮制后更加密集、均匀。
3 结 论
以猪肉胶原蛋白为乳化剂,大豆油为油相,模拟构建煮制肉汤乳化体系,测定不同离子强度条件下猪肉可溶性胶原蛋白与不溶性胶原蛋白的乳化特性。结果表明:在一定范围内,NaCl浓度的增加有利于提高猪肉胶原蛋白乳化性;NaCl浓度为0.2 mol/L时,猪肉胶原蛋白EAI达到最大,随着NaCl浓度继续增加,猪肉胶原蛋白EAI逐渐降低;猪肉胶原蛋白ESI的变化较为复杂,可溶性胶原蛋白的ESI变化趋势与EAI相反,即在EAI较高的离子强度时ESI较小,不溶性胶原蛋白的ESI与EAI具有相同的变化趋势;同时,随着离子强度的提高,猪肉可溶性胶原蛋白溶解性降低,黏度显著提高。经煮制处理后,可溶性胶原蛋白溶解度和EAI降低,ESI和黏度增加;不溶性胶原蛋白EAI降低,蛋白溶解度、ESI和黏度均增大。
参考文献:
[1] WU Xiaosa, CAI Luyun, CAO Ailing, et al. Comparative study on acid-soluble and pepsin-soluble collagens from skin and swim bladder of grass carp (Ctenopharyngodon idella)[J]. Journal of the Science of Food and Agriculture, 2016, 96(3): 815-821. DOI:10.1002/jsfa.7154.
[2] 韩霜, 马良, 王雪蒙, 等. 兔皮胶原蛋白的加工特性[J]. 食品科学, 2017, 38(5): 21-25. DOI:10.7506/spkx1002-6630-201705004.
[3] 焦道龙, 陆剑锋, 张伟伟, 等. 水产动物胶原蛋白的研究现状及发展趋势[J]. 食品科学, 2009, 30(17): 334-338.
[4] 陈诗妍. 胶原蛋白在食品中的应用分析[J]. 现代食品, 2019(18):
27-28; 31. DOI:10.16736/j.cnki.cn41-1434/ts.2019.18.009.
[5] BILEK S E, BAYRAM S K. Fruit juice drink production containing hydrolyzed collagen[J]. Journal of Functional Foods, 2015, 14:
562-569. DOI:10.1016/j.jff.2015.02.024.
[6] 高晶晶. 鳕鱼胶原蛋白在食品加工中的应用[J]. 农产品加工(学刊), 2014(10): 79-80. DOI:10.3969/jissn.1671-9646(X).2014.10.055.
[7] 尹利端, 石丽花, 王桐, 等. 海洋胶原蛋白肽在功能性食品中的应用[J]. 明胶科学与技术, 2013, 33(2): 55-58. DOI:10.3969/j.issn.1004-9657.2013.02.001.
[8] 朱航, 戴聪杰. 响应面优化马鲛鱼鱼皮胶原蛋白的提取工艺[J]. 食品安全导刊, 2019(31): 64-67. DOI:10.16043/j.cnki.cfs.2019.31.028.
[9] 穆畅道. 一种胶原蛋白面膜及其制备方法: CN102138870A[P]. 2011-08-03.
[10] 苗强. 一种鱼鳞胶原蛋白化妆品: CN101999992A[P]. 2011-04-06.
[11] 刘晶晶, 雷元华, 李海鹏, 等. 加热温度及时间对牛肉胶原蛋白特性及嫩度的影响[J]. 中国农业科学, 2018, 51(5): 977-990. DOI:10.3864/j.issn.0578-1752.2018.05.015.
[12] 王碧, 王坤余, 叶勇. 水解胶原蛋白的溶解性和乳化性研究[J]. 皮革化工, 2003, 20(1): 5-8.
[13] ZORBA O, GOKALP H, YETIM H, et al. Salt, phosphate and oil temperature effects on emulsion capacity of fresh or frozen meat and sheep tail fat[J]. Journal of Food Science, 1993, 58(3): 492-496. DOI:10.1111/j.1365-2621.1993.tb04308.x.
[14] YAPAR A, ATAY S, KAYACIER A, et al. Effects of different levels of salt and phosphate on some emulsion attributes of the common carp (Cyprinus carpio L., 1758)[J]. Food Hydrocolloids, 2006, 20(6):
825-830. DOI:10.1016/j.foodhyd.2005.08.005.
[15] DICKINSON B D, HAVAS S. Reducing the population burden of cardiovascular disease by reducing sodium intake: a report of the Council on Science and Public Health[J]. Archives of Internal Medcine, 2007, 167(14): 1460-1468. DOI:10.1001/archinte.167.14.1460.
[16] FERN?NDEZ-GIN?S J M, FERN?NDEZ-L?PEZ J, SAYASBARBER? E, et al. Meat products as functional foods: a review[J]. Journal of Food Science, 2005, 70(2): 37-43. DOI:10.1111/j.1365-2621.2005.tb07110.x.
[17] 徐寶才, 孙建清, 周辉, 等. 原料肉组成对低温乳化香肠质构特性的影响及其配方优化[J]. 南京农业大学学报, 2011, 34(4): 111-116.
[18] 高金龙. 山羊皮中胶原蛋白的提取及理化特性研究[D]. 呼和浩特: 内蒙古农业大学, 2010: 6-8.
[19] 吴菊清, 邵俊花, 魏朝贵, 等. 离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响[J]. 食品科学, 2014, 35(23): 14-19. DOI:10.7506/spkx1002-6630-201423003.
[20] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[21] 郝月慧. 三种糖醇影响无糖海绵蛋糕品质的比较研究[D]. 无锡: 江南大学, 2014: 7-9.
[22] RAM?REZ-SU?REZ J C, XIONG Y L. Rheological properties of mixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths[J]. International Journal of Food Science and Technology, 2003, 38(7): 777-785. DOI:10.1046/j.1365-2621.2003.00731.x.
[23] 王群. 改性胶原蛋白表面施胶剂的合成及应用研究[D]. 西安: 陕西科技大学, 2015: 18-19.
[24] 李超. 加热处理对鸭肉嫩度的影响及其机制研究[D]. 南京: 南京农业大学, 2012: 15-17.
[25] 周纷, 孙迪, 许帅强, 等. 不饱和脂肪酸对猪肉蛋白质乳化特性的
影响[J]. 食品科学, 2018, 39(24): 34-40. DOI:10.7506/spkx1002-6630-201824006.
[26] DASK P, KINSELLA J E. Stability of food emulsions: physicochemical role of protein and nonprotein emulsifiers[J]. Advances in Food and Nutrition Research, 1990, 34: 81-20. DOI:10.1016/S1043-4526 (08) 60007-8.
[27] ZORBA ?. The effects of the amount of emulsified oil on the emulsion stability and viscosity of myofibrillar proteins[J]. Food Hydrocolloids, 2005, 20(5): 698-702. DOI:10.1016/j.foodhyd.2005.06.010.
[28] 张素风, 王群, 王学川, 等. 水解胶原蛋白乳化性和乳化稳定性
研究[J]. 陕西科技大学学报(自然科学版), 2014, 32(4): 10-13; 18. DOI:10.3969/j.issn.1000-5811.2014.04.003.
[29] 胡娜, 乔美靓, 刘毅, 等. 乳化型猪皮胶原蛋白的溶解性和乳化性
研究[J]. 肉类研究, 2010, 24(6): 10-14.
[30] AIDER M, DJENANE D, OUNIS W B. Amino acid composition, foaming, emulsifying properties and surface hydrophobicity of mustard protein isolate as affected by pH and NaCl[J]. International Journal of Food Science and Technology, 2012, 47(5): 1028-1036. DOI:10.1111/j.1365-2621.2012.02937.x.
[31] CHOVE B E, GRANDISON A S, LEWIS M J. Emulsifying properties of soy protein isolate fractions obtained by isoelectric precipitation[J]. Journal of the Science of Food and Agriculture, 2001, 81(8): 759-763. DOI:10.1002/jsfa.877.
[32] CHEN Jingwang, MU Taihua, ZHANG Miao, et al. Effect of heat treatments on the structure and emulsifying properties of protein isolates from cumin seeds (Cuminum cyminum)[J]. Food Science and Technology International, 2018, 24(8): 673-687. DOI:10.1177/1082013218788753.
[33] 易建華, 孙艺飞, 朱振宝. 影响乳清分离蛋白乳化特性的因素研究[J].
陕西科技大学学报, 2017, 35(4): 112-116. DOI:10.3969/j.issn.1000-5811.2017.04.021.
[34] 王碧, 王坤余, 贾冬英, 等. 胶原蛋白及多肽的黏度特性[J]. 中国
皮革, 2003(11): 23-26.
[35] 李宇龙. 盐对胶原溶液黏度行为的影响[D]. 济南: 齐鲁工业大学, 2013: 20-23.

