大鲵肌肉分离蛋白特性
杨慧 陈德经 陈海涛 董梦尧


摘 要:为研究大鲵肌肉蛋白组成及特性,从大鲵肌肉中分离肌浆蛋白、肌原纤维蛋白及肌基质蛋白,测定其含量、氨基酸组成、分子质量、紫外光谱和红外光谱,利用扫描电子显微镜观察蛋白微观结构。结果表明:肌浆蛋白含量为4.91%,分子质量为20~200 kDa;肌原纤维蛋白含量为9.03%,主要包含肌球蛋白重链(200 kDa)、肌动蛋白(43 kDa)和原肌球蛋白(36 kDa);肌基质蛋白含量为2.28%,分子质量分布在29~40 kDa、160~200 kDa;3 种分离蛋白在280 nm波长处均有最大紫外吸收峰,肌原纤维蛋白在酰胺A、B、Ⅰ、Ⅱ、Ⅲ带均有红外特征吸收峰,肌浆蛋白和肌基质蛋白仅在酰胺Ⅰ、Ⅱ、Ⅲ带出现红外特征吸收峰。扫描电子显微镜图像显示,肌浆蛋白蛋白束平滑,肌原纤维蛋白为棒块状或颗粒状聚合物,肌基质蛋白有完整的纤维结构。
关键词:大鲵;蛋白质;肌浆蛋白;肌原纤维蛋白;肌基质蛋白
Abstract: In this paper, the composition and characteristics of giant salamander muscle proteins were studied. Sarcoplasmic, myofibrillar and muscle matrix proteins were isolated from giant salamander muscle, and their protein content, amino acid composition, molecular mass, ultraviolet (UV) spectra and infrared (IR) spectra were determined, and protein microstructures were observed by scanning electron microscope (SEM). The results showed that the content of sarcoplasmic protein was 4.91%, with a molecular mass of 20–200 kDa; the content of myofibrillar protein was 9.03%, mainly including 200 kDa myosin heavy chain, 43 kDa actin and 36 kDa myosin; and the content of muscle matrix protein was 2.28%, with molecular mass distribution in the range of 29–40 and 160–200 kDa. All three proteins exhibited maximum UV absorption peaks at 280 nm. There were characteristic IR absorption peaks for myofibrillar protein in the amide A, B, Ⅰ, Ⅱ and Ⅲ regions, while the characteristic IR absorption peaks of sarcoplasmic protein and muscle matrix protein appeared only in the amide Ⅰ, Ⅱ and Ⅲ regions. The SEM images showed that the surface of sarcoplasmic protein was smooth, myofibrillar protein was a rod-shaped or granular polymer, and muscle matrix protein had a more intact fiber structure.
Keywords: giant salamander; protein; sarcoplasmic protein; myofibrillar protein; muscle matrix protein
DOI:10.7506/rlyj1001-8123-20200515-121
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2020)07-0028-05
引文格式:
杨慧, 陈德经, 陈海涛, 等. 大鲵肌肉分离蛋白特性研究[J]. 肉类研究, 2020, 34(7): 28-32. DOI:10.7506/rlyj1001-8123-20200515-121. http://www.rlyj.net.cn
YANG Hui, CHEN Dejing, CHEN Haitao, et al. Characteristics of proteins isolated from giant salamander muscle[J]. Meat Research, 2020, 34(7): 28-32. DOI:10.7506/rlyj1001-8123-20200515-121. http://www.rlyj.net.cn
大鲵(Andrias davidianus)俗称娃娃鱼,属脊索动物门、两栖纲、有尾目、隐鳃鲵科。大鲵全身是宝,肌肉、黏液、皮肤、骨头和油脂均有较高的营养和药用价值,大鲵机体中肌肉占比最高,占体质量的50%左右。现代医学认为,经常食用大鲵可益智、延缓衰老、提高造血和免疫功能、防止心脑血管、恶性贫血和恶性肿瘤等疾病[1]。大鲵肌肉必需氨基酸含量较高[2],不饱和脂肪酸包括油酸(32.60%)、亚油酸(14.70%)、亚麻酸(6.80%)、二十碳五烯酸(3.50%)和二十二碳六烯酸(4.20%)等[3],营养远高于牛肉和鹿肉。此外,大鲵肉粉还具有抗疲劳和提高免疫力的作用[4]。近年来,对大鲵的研究主要集中在大鲵养殖繁殖技术[5-8]、大鲵皮肤胶原蛋白[9-10]和大鲵黏液[11-12]等领域,目前大鲵肌肉分离蛋白特性的研究还很少,倪冬冬[13]研究了温度对大鲵肌原纤维蛋白的影响。
蛋白质是肌肉的主要成分,根据溶解性可将其分为肌浆蛋白、肌原纤维蛋白和肌基质蛋白。肌浆蛋白为水溶性蛋白,与肉的呈味特性和色泽有关,还可参与细胞的代谢反应[14]。肌原纤维蛋白为盐溶性蛋白,与肉制品凝胶特性、肌肉弹性等密切相关[15]。肌基质蛋白为不溶性蛋白,与肉嫩度和弹性相关[16]。分离蛋白理化及功能特性的研究可为大鲵肉烹调特性及大鲵蛋白产品的精深加工提供实践指导作用。
本研究对大鲵肌肉蛋白质进行分离,分析分离所得蛋白质含量、氨基酸组成、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)图谱、紫外光谱、红外光谱和扫描电子显微镜图像,以期为大鲵蛋白产品的综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
大鲵肌肉 汉中龙鲵生物工程股份有限公司。
氢氧化钠、盐酸、浓硫酸、冰乙酸、氯化钠、磷酸氢二钠、磷酸二氢钠、正丙醇、异丙醇、高氯酸、柠檬酸、无水乙酸钠(均为分析纯) 天津市盛奥化学试剂有限公司;SDS、蛋白Marker、考马斯亮蓝G250、丙烯酰胺、四甲基乙二胺、乙二胺四乙酸、三羟甲基氨基甲烷、过硫酸铵、甘氨酸、溴酚蓝、β-巯基乙醇、甘油(均为电泳级) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
UV-1750紫外-可见分光光度计 日本岛津仪器公司;LGJ-40E真空冷冻干燥机 北京四环科学仪器厂有限公司;QYKDN-C凯氏定氮仪 上海乔跃电子有限公司;Biochrom 30+全自动氨基酸分析仪 大昌华嘉商业有限公司;PE28 pH计 瑞士梅特勒-托利多仪器有限公司;DYCZ-24DN垂直电泳仪 北京六一生物科技有限公司;JA5003分析天平 上海舜宇恒平科学仪器有限公司;VERTEX70傅里叶红外光谱仪 德国Bruker公司;TGL-20M冷冻离心机 湖南湘仪离心机仪器有限公司;Phenom台式扫描电子显微镜 美国FEI公司。
1.3 方法
1.3.1 大鲵肌肉蛋白质的分离提取
参考Saito[17]方法。称取绞碎的大鲵肉糜250 g,加入4 倍体积0.05 mol/L、pH 7.5磷酸盐缓冲液,磁力搅拌辅助提取3 h,4 ℃、8 000 r/min离心10 min,收集上清液,沉淀物再加入上述磷酸盐缓冲液,重复上述操作,合并上清液即得水溶性肌浆蛋白。向沉淀中加入4 倍体积含0.6 mol/L NaCl磷酸盐缓冲溶液,磁力搅拌辅助提取8 h,4 ℃、8 000 r/min离心10 min,继续加入含0.6 mol/L NaCl磷酸盐缓冲溶液,重复提取、离心操作,合并上清液,即得盐溶性肌原纤维蛋白。所得的沉淀用蒸馏水反复洗涤5 次,即得肌基质蛋白。
蛋白除盐:选用MD77(截留分子质量7 000 Da)規格的透析袋进行脱盐,透析袋使用前用沸水煮10 min,而后分别将肌浆蛋白和肌原纤维蛋白装入透析袋中,置于装满纯水的大烧杯中透析(4 ℃冰箱),4 h更换1 次透析液。用1 g/100 mL AgNO3检验氯离子的存在,无氯离子存在时透析结束,脱盐所得的蛋白质真空冷冻干燥备用。凯氏定氮法测定各分离蛋白的蛋白质含量。
1.3.2 大鲵肌肉分离蛋白的氨基酸种类及含量测定
参考罗敏等[18]的方法,分别称量大鲵肉糜、肌浆蛋白、肌原纤维蛋白和肌基质蛋白冻干粉0.500 g于安培瓶中,加入10 mL 6 mol/L盐酸,充氮气30 s,重复3 次,封口,放入105 ℃恒温干燥箱内水解24 h,冷却后定容至10 mL容量瓶中,0.22 μm微孔滤膜过滤,取出1 mL烘干,再加入200 μL蒸馏水烘干,重复3 次后,加入pH 2.2的磷酸缓冲液1 mL,过0.22 μm微孔滤膜后注入氨基酸自动分析仪测定氨基酸组成及含量。
1.3.3 大鲵肌肉分离蛋白的SDS-PAGE分析
参考戴春阳[19]的方法。采用5%浓缩胶、15%分离胶对大鲵肌浆蛋白、肌原纤维蛋白及肌基质蛋白进行SDS-PAGE分析。配制质量浓度为1 mg/mL的蛋白溶液,肌浆蛋白和肌原纤维蛋白用pH 7.5磷酸盐缓冲液溶解,肌基质蛋白用尿素溶解。每孔蛋白Marker上样量为5 ?L,蛋白溶液上样量为10 ?L。设置电泳初始电压为80 V,当样品前沿刚好进入分离胶后将电压提高到120 V,电泳时间约4 h。
1.3.4 大鲵肌肉分离蛋白的紫外光谱测定
将肌浆蛋白、肌原纤维蛋白溶于中性磷酸盐缓冲液,肌基质蛋白溶于0.5 mol/L盐酸溶液,而后置于紫外-可见分光光度计的卡槽中,测定220~800 nm波长范围的吸光度,波长间隔为1 nm,绘制吸光度随波长变化的曲线图。
1.3.5 大鲵肌肉分离蛋白的红外光谱测定
采用溴化钾压片法[20]:准确称取200 mg溴化钾粉末4 份,3 份分别与1 mg透析、冷冻干燥后的肌浆蛋白、肌原纤维蛋白和肌基质蛋白样品混匀,另1 份作空白对照,置于玛瑙钵体中研成细粉后进行压片。使用红外光谱仪测定4 000~400 cm-1区间内的透过率。
1.3.6 大鲵肌肉分离蛋白的扫描电子显微镜观察
取少许肌浆蛋白、肌原纤维蛋白和肌基质蛋白冻干粉末,将直径12 mm双面碳导电胶片粘贴在钉型样品台上,而后将样品均匀覆盖在胶片表面,用镊子将钉型样品台夹起放于电镜标准样品杯中,旋转样品杯,动力除尘器吹几次,除去灰尘后放置于电镜载物台,调节最佳视野和放大倍数对样品进行微观结构观察。
1.4 数据处理
结果以平均值±标准差表示,用Excel软件进行数据分析,用Origin 8.5软件绘图。
2 结果与分析
2.1 大鲵肌肉的蛋白质组成及含量
由图1可知,大鲵肌肉中肌原纤维蛋白含量最高,为9.03%,其次是肌浆蛋白(4.91%),肌基质蛋白含量最低,为2.28%。大鲵肌肉蛋白质含量为17.08%,3 种蛋白占大鲵肌肉总粗蛋白的比例为肌原纤维蛋白(52.87%)>肌浆蛋白(28.75%)>肌基质蛋白(13.35%),这与Tornberg[21]研究的动物肌肉中肌浆蛋白占总蛋白30%~35%、肌原纤维蛋白占总蛋白55%~60%的结论相似。鱼类肌肉蛋白质种类大致相同,但不同物种间蛋白质含量差异较大。草鱼肌肉中肌浆蛋白、肌原纤维蛋白和肌基质蛋白分别占总蛋白的24.31%、46.23%和10.19%,鲤鱼肌肉中肌浆蛋白、肌原纤维蛋白和肌基质蛋白分别占总蛋白的22.12%、55.92%和8.54%[22]。罗非鱼肉中蛋白质含量为肌原纤维蛋白(49.48%)>肌浆蛋白(29.34%)>肌基质蛋白(15.54%)[23]。高白鲑肌肉蛋白质中肌原纤维蛋白占总蛋白质的35.86%,肌浆蛋白占28.73%,肌基质蛋白占16.27%,且3 种蛋白质含量均随贮藏时间的延长呈下降趋势[24]。
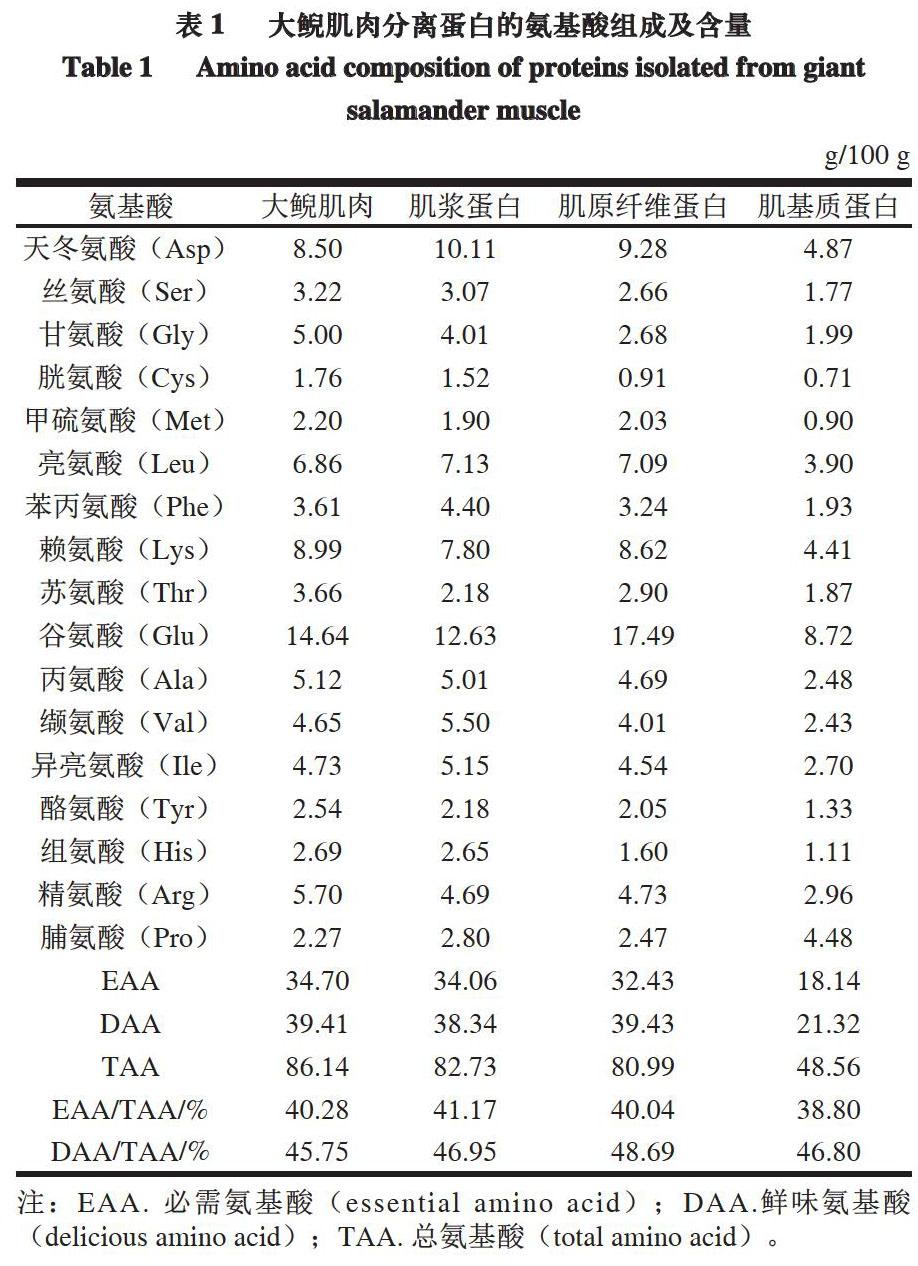
2.2 大鲵肌肉蛋白质的氨基酸组成及含量
由表1可知,大鲵肌肉和3 种分离蛋白中均检测出17 种氨基酸,其中包括7 种必需氨基酸(色氨酸在水解过程中被破坏,未测),肌浆蛋白、肌原纤维蛋白必需氨基酸含量丰富,其占总氨基酸含量的比例分别为41.17%、40.04%,符合联合国粮农组织/世界卫生组织理想模式推荐的必需氨基酸占总氨基酸比例为40%,是理想的优质蛋白。肌基质蛋白的总氨基酸含量仅为48.56 g/100 g,这可能和肌基质蛋白在酸性溶液中溶解性较低,因而蛋白不能完全水解有关。大鲵分离蛋白的氨基酸组成与大鲵肌肉的氨基酸组成无明显差别,含量最高的为谷氨酸,其次为天冬氨酸、赖氨酸、亮氨酸,这和文献[25]所报道的一些淡水鱼的氨基酸含量高低顺序基本一致。大鲵肌原纤维蛋白的谷氨酸、赖氨酸含量明显高于肌浆蛋白,谷氨酸残基和赖氨酸残基是谷氨酰胺转氨酶作用的底物,其较高的含量有利于谷氨酰胺转氨酶发挥作用,促使肌原纤维蛋白分子间谷氨酸、赖氨酸发生转氨基反应的交联作用,增强凝胶网络结构,提高鱼糜制品的凝胶强度[22]。肌基质蛋白的脯氨酸含量明显高于肌浆蛋白和肌原纤维蛋白,这主要是由于肌基质蛋白多为肌肉中不溶性结缔组织,结缔组织主要包含胶原蛋白和弹性蛋白,而胶原蛋白中富含脯氨酸。
2.3 大鲵肌肉蛋白质的SDS-PAGE分析结果
SDS-PAGE图可反映出蛋白质之间发生的交联、聚集及降解情况。由图2可知,大鲵肌肉分离蛋白质条带清晰、杂带较少,说明提取纯度较高。大鲵肌原纤维蛋白主要有3 个条带,其分子质量分别为220、43、36 kDa,分别代表肌球蛋白重链、肌动蛋白和原肌球蛋白,这与前人研究结果[26]相符。大鲵肌浆蛋白的分子质量主要分布在20~200 kDa,28~36 kDa蛋白条带较明显,实验结果与Chan等[27]的肌浆蛋白电泳图相似。大鲵肌基质蛋白分子质量分布范围较广,29~240 kDa间均出现条带,29~40 kDa、160~200 kDa条带密集且颜色最深,可能是碱溶性蛋白和胶原蛋白[28]的特征条带。
2.4 大鲵肌肉蛋白质的紫外光谱分析
由图3可知,同一波长下,肌基质蛋白的紫外吸收值最大,其次是肌浆蛋白,肌原纤维蛋白最小。肌浆蛋白和肌原纤维蛋白均在280 nm波长处出现最大吸收值。相比于其他2 种蛋白,肌基质蛋白在220~300 nm区间内的紫外吸收信号比较杂乱,但其在280 nm波长处也有较强的吸收峰,说明大鲵分离蛋白均含有色氨酸和酪氨酸。蛋白质产生紫外吸收光谱主要是由于色氨酸、酪氨酸、苯丙氨酸和组氨酸残基侧链基团对紫外光的吸收,生色基团不同,紫外吸收峰位置也不同。色氨酸在280 nm波长处有特征吸收峰,酪氨酸在275 nm附近有特征吸收峰,苯丙氨酸在257 nm附近有特征吸收峰[29]。
2.5 大鲵肌肉蛋白质的红外光谱分析结果
由图4可知,3 种分离蛋白出现若干特征吸收峰,大鲵肌原纤维蛋白在酰胺A带(3 300 cm-1左右)、酰胺B带(3 100 cm-1左右)、酰胺Ⅰ带(1 660 cm-1左右)、酰胺Ⅱ带(1 570 cm-1左右)和酰胺Ⅲ带(1 350 cm-1左右)均有特征吸收峰出现,这与大黄鱼肌原纤维蛋白譜带[30]较为一致。肌浆蛋白、肌基质蛋白的红外图谱较相似,其在酰胺Ⅰ、Ⅱ、Ⅲ带均有特征吸收峰。与肌原纤维蛋白不同的是,肌浆蛋白、肌基质蛋白在酰胺A、B带未出现红外特征吸收峰。酰胺键通常是表征蛋白质二级结构变化的特征官能团,酰胺A带主要由N-H的伸缩振动引起,酰胺B带由-CH2不对称伸缩振动引起,酰胺Ⅰ带由C=O伸缩振动引起,酰胺Ⅱ带由C-N伸缩振动及N-H弯曲振动引起,酰胺Ⅲ带由N-H变形振动引起[31]。
2.6 大鲵肌肉蛋白质的扫描电子显微镜图分析
由图5可知,大鲵肌浆蛋白、肌原纤维蛋白和肌基质蛋白在微观结构上存在明显区别。肌浆蛋白表面光滑、形态规则,蛋白束平滑,聚合紧密;肌原纤维蛋白内部有很多棒块状或颗粒状聚合物,聚合物不平整、无规则排列,形成细致、紧密的网状结构;肌基质蛋白主要为结缔组织,具有较完整的纤维结构。
3 结 论
大鲵肌肉中肌浆蛋白、肌原纤维蛋白和肌基质蛋白含量分别为4.91%、9.03%、2.28%。肌浆蛋白、肌原纤维蛋白必需氨基酸含量丰富,其占总氨基酸含量的比例分别为41.17%、40.04%,肌基质蛋白因含胶原蛋白,脯氨酸含量明显高于肌浆蛋白和肌原纤维蛋白。大鲵肌原纤维蛋白主要由原肌球蛋白(36 kDa)、肌动蛋白(43 kDa)和肌球蛋白重链(200 kDa)组成,肌浆蛋白分子质量主要分布在20~200 kDa,肌基质蛋白分子质量分布在29~40 kDa、160~200 kDa。3 种分离蛋白在280 nm波长处均有最大紫外吸收峰出现,肌原纤维蛋白在酰胺A、B、Ⅰ、Ⅱ、Ⅲ带均有红外特征吸收峰,但肌浆蛋白和肌基质蛋白的红外特征吸收峰仅在酰胺Ⅰ、Ⅱ、Ⅲ带出现。扫描电子显微镜图像显示,大鲵肌肉肌浆蛋白蛋白束平滑,聚合紧密,肌原纤维蛋白内部有很多棒块状或颗粒状聚合物,聚合物无序排列,肌基质蛋白有较完整的纤维结构。
[21] TORNBERG E. Biophysical aspects of meat tenderness[J]. Meat Science, 1996, 43(Suppl 1): 175-191. DOI:10.1016/0309-1740(96)00064-2.
[22] 贾丹. 青鱼肌肉蛋白质及其凝胶特性的研究[D]. 武汉: 华中农业大学, 2016: 28-29.
[23] 唐小丹, 周春霞, 洪鹏志, 等. 罗非鱼肉蛋白的分离及其性质研究[J]. 食品科技, 2011, 36(6): 156-159; 166.
[24] 于亚文, 朱新荣, 邱恒恒, 等. 冻藏条件下高白鲑肌肉蛋白质的生化特性[J]. 食品科技, 2017, 42(11): 157-162. DOI:10.13684/j.cnki.spkj.2017.11.029.
[25] 王玉林, 林婉玲, 李来好, 等. 4 目13 种淡水鱼肌肉基本营养成分分析[J]. 食品工业科技, 2019, 40(11): 277-283. DOI:10.13386/j.issn1002-0306.2019.11.046.
[26] MIGNINO L A, PAREDI M E. Physico-chemical and functional properties of myofibrillar proteins from different species of molluscs[J]. LWT-Food Science and Technology, 2006, 39(1): 35-42. DOI:10.1016/j.lwt.2004.12.004.
[27] CHAN J T Y, OMANA D A, BBTTI M. Application of high pressure processing to improve the functional properties of pale, soft, and exudative (PSE)-like turkey meat[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 216-225. DOI:10.1016/j.ifset.2011.03.004.
[28] 李華. 大鲵皮中胶原蛋白的提取及性质研究[J]. 淡水渔业, 2013, 43(2): 71-74.
[29] 涂宗财, 马达, 王辉, 等. 超声波对鸡肉肌浆蛋白理化性质和结构的影响[J]. 食品科学, 2013, 34(19): 32-36.
[30] 张登科, 张慧恩, 朱艳杰, 等. 超高压处理对养殖大黄鱼肌原纤维蛋白结构的影响[J]. 食品科学, 2019, 40(9): 61-67. DOI:10.7506/spkx1002-6630-20180409-113.
[31] ZHANG Tao, LI Zhaojie, WANG Yuming, et al. Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J]. Food Research International, 2016, 83: 152-161. DOI:10.1016/j.foodres.2016.03.007.

