等离子体纳米探针在细胞成像中的应用
刘文晗 谢晓冬 殷 敏 陈 楠
1(中国科学院上海应用物理研究所中国科学院微观界面物理与探测重点实验室 上海201800)
2(中国科学院大学 北京100049)
3(上海师范大学化学与材料科学学院 上海200234)
贵金属(如金、银、铂等)纳米材料具有独特的物 理、化学和光学性质,因而被广泛应用于化学传感、生物检测和医学诊断等领域[1-7]。贵金属纳米材料之所以能在肿瘤成像和靶向放射治疗中发挥作用[5,8-9],是因为实体肿瘤组织普遍具有提高渗透滞留(Enhanced Permeability and Retention,EPR)效应,纳米颗粒容易在肿瘤部位发生富集[10]。由于贵金属纳米粒子具有较高的原子序数和X 射线吸收系数,所以可作为肿瘤体内成像的造影剂以及放射治疗的增敏材料[11-12]。纳米贵金属能够有效地吸收X射线并与辐射相互作用,发射二次电子,这些二次电子既可以直接造成DNA的损伤[13-15],又可以在细胞内产生大量的氧自由基,增加肿瘤细胞对辐射的敏感性,从而实现以较低的剂量射线获得良好的放疗效果[16-17]。
贵金属纳米材料还具有局域表面等离子体共振(Localized Surface Plasmon Resonance,LSPR)效应。研究人员基于其LSPR 效应开发了一系列传感器,这些传感器具有实时和高灵敏等特点,且无需标记,被广泛应用于化学和生物检测。虽然电化学传感和基于框架核酸的新型检测手段等在多种疾病的诊断中发挥了重要作用,但是成像学的方法,在对肿瘤细胞进行检测和诊断时具有高灵敏性和实时性等优势[18-20]。基于纳米贵金属的LSPR 效应所制备的等离子体纳米探针(Plasmonic Nanoprobes,PNPs)具有明显区别于生物组织的散射光颜色和光谱信号,可以利用暗场显微镜(Dark Field Microscope,DFM)进行观测[21-23]。与荧光探针相比,PNPs具有更高的灵敏性和特异性,且不容易发生光漂白,暗场成像过程也避免了激光直接照射细胞所产生的毒性,特别适合用来对活细胞进行观测。对于PNPs 在细胞内动态行为的研究,则为更好地理解细胞生命活动的过程提供了可能[24-25]。此外,等离子体纳米探针的LSPR效应对于其周围的介电常数非常敏感,能够实时反映观测过程中环境的变化,因而具有更快的响应速度和更高的检测灵敏度[26]。除了单个PNP 的形貌对于其LSPR 效应的影响,两个或多个纳米探针相互靠近,会显著改变其局部电荷分布,最终导致散射光谱的红移,这种效应被称作等离子体耦合(Plasmon Coupling)。基于该效应所设计的纳米等离子尺等探针体系,使得实时监测生物分子动态过程中的距离变化成为可能[27-28]。
本文综述了国内外基于暗场成像的PNPs 的最新进展,重点介绍其在细胞成像方面的应用;总结了利用PNPs观测细胞膜表面受体、原位检测细胞内的生物分子和实时追踪胞内转运途径等方面的应用,并展望了这一领域的发展前景。
1 等离子体纳米探针与暗场显微成像技术
1.1 等离子体纳米探针
具有LSPR 效应的纳米颗粒被用作等离子体纳米探针,对生物分子和细胞结构进行标记、检测和实时成像。就化学组成而言,PNPs 包括纳米金(Gold Nanoparticles, AuNPs) 、 纳 米 银 (Silver Nanoparticles,AgNPs) 、 纳 米 铂 (Platinum Nanoparticles,PtNPs)和包含这些贵金属成分的复合纳米颗粒等。PNPs 的化学组分和尺寸决定其光学性质。例如,粒径为40 nm 单颗粒球形AuNPs 探针在暗场下呈现绿色光斑,而相同大小的AgNPs则具有蓝色散射光信号。对于球形PNPs,其散射吸收可以用Mie理论[29]解释,随着粒径增大,球形PNP的散射光强度增强。此外,纳米颗粒的形貌也会对其LSPR 光学性质产生影响。随着纳米颗粒的合成技术日趋成熟,多种具有复杂形貌结构的PNPs 被合成,如:球形、棒状、二维多边形、三维多边体、分枝状、复杂型和空心结构等[30]。其中,由于其化学惰性和优异的生物兼容性,各种形貌的纳米金探针被制备和应用于细胞标记及成像分析。在最近的一项研究 中 ,Chakkarapani 等[31]根 据 纳 米 金 棒(Gold Nanorods,AuNRs)各向异性的光学特性,利用集成光片成像的超分辨显微镜实时观察了单个PNP 在聚集体中的三维取向,获得了低至64 nm 的轴向分辨率和28 nm 的空间分辨率(图1(a))。Zhang 等[32]利用DNA 介导的定向自组装技术制备了等离子体性质可调的海参状金纳米晶(Gold Nanocrystals,AuNCs)。时域有限差分(Finite-difference Timedomain,FDTD)方法的计算结果表明:等离子体共振峰的变化与合成的AuNCs的尺寸、形貌的精确变化是一致的;该AuNCs 具有良好生物相容性,可以用于光热治疗和成像分析(图1(b))。如图1(c)所示,Shen 等[33]借助Poly-A30寡核苷酸链对纳米金的表面生长过程进行控制,得到了一系列粒径约50 nm的带“刺突”的纳米金星结构,随刺突的长度和粗细比(δ)增大,其对应的LSPR 散射光信号颜色从暗绿色逐步变化至橙红色,相应的散射光谱也从560 nm红移至660 nm左右。该方法得到了超多元化的PNPs,其对应的特征光谱种类超过了传统荧光探针的多色极限。研究者们借助该探针,实现了单个细胞内多种蛋白质的标记和实时定量成像。此外,这类带有突刺结构的PNPs,由于尖端的电荷分布更为密集,其LSPR 性质对于周围环境的敏感性也比球形对称结构的纳米探针要高。因此,利用各种手段,如DNA纳米技术,实现对PNPs形貌的设计和调控,从而制备超多色和超灵敏的生物探针成为了新的发展趋势。

图1 多种形貌的纳米等离子探针(a)纳米金棒的光片三维成像[31],(b)海参状纳米金探针[32],(c)形貌可控的多色纳米金星探针[33]Fig.1 Plasmonic probes with varied shapes(a)3D light sheet imaging with nanorods[31],(b)The trepang-like Au nanocrystals[32],(c)The tunable multiplex gold nano-star probes[33]
1.2 暗场显微成像技术
暗场显微成像技术是检测单个纳米颗粒散射光信号的有效手段。暗场显微镜可以观测到粒径在20~200 nm的PNPs 的信号,并可检测到探针粒子间仅数纳米的距离改变,突破了普通光学显微镜约200 nm 的空间分辨率限制[34]。暗场显微镜成像和采集光谱的原理如图2(a)所示,卤素灯或白激光发出的入射光通过装配有暗场环的暗场聚光镜之后,形成环形光,斜照射在样品上,在样品下方使用一个数值孔径小于聚光镜的物镜,收集样品的散射光,并将光学信号通过显微镜镜片系统传递至暗场成像感光电荷耦合元件(Charge-coupled Device,CCD),然后透过狭缝到达光谱仪中,从而分别获得样品的暗场图像和散射光谱。这类暗场光谱仪通过狭缝采集单颗粒PNP 的高精度光谱,适合于构建生化体系中的超灵敏探针[35]。如果需要同时采集视野内多个探针的光谱,就需要利用高光谱暗场显微成像系统,基于狭缝型的高光谱速度较慢,如El-Khoury 等[36]对44 μm×59 μm面积内的数百个纳米银颗粒采集高光谱,需要大约30 s。之后Kirchner 等[37]研发了一种“快照型”设备,可以同时采集图像和视野内所有粒子的光谱,整个视野的光谱扫描时间缩短至1 ms,且光谱的分辨率仍能保持0.21 nm,如图2(b)所示,样品的信号通过分光镜后,同时进入成像系统和光谱扫描系统。光谱采集不是通过狭缝,而是直接使用透射光栅片,使光线发生平行衍射,在CCD 上形成光谱条纹。这一系统要求样品中探针的分布比较稀疏,否则扫描得到的单颗粒光谱信号的拉伸条纹会互相重叠。
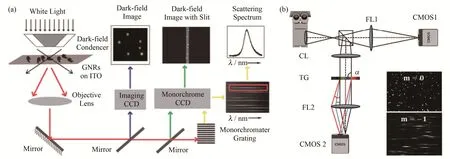
图2 暗场光谱采集装置(a)彩色CCD、光谱CCD和狭缝光谱仪耦合的暗场显微镜示意图[35],(b)快照型暗场高光谱光路示意图[37]Fig.2 Setups of dark-field spectroscopies(a)Dark-field microscope coupled with color CCD,spectro-CCD and a slit-spectrometer[35],(b)Snapshot hyperspectral imaging setup[37]
2 等离子体纳米探针与细胞成像研究
2.1 用于研究细胞膜表面受体的PNPs
细胞膜表面存在多种多样的受体蛋白,它们能识别、结合特异的配体分子,从而激活和启动信号转导的级联途径,调控细胞内的生理过程发生相应的变化[38-39]。研究者们已经发现,受体在细胞膜表面的运动和聚集常常是信号转导的关键步骤。因此,针对细胞膜表面受体的分布和聚集进行研究,有助于理解其生理功能[40-42]。将PNPs 与识别膜受体的特异性抗体进行偶联,使之能够结合和标记活细胞表面受体,便于在暗场显微镜下对其进行实时观察。这种基于等离子体纳米探针的暗场成像方式,不会对细胞造成侵入性损伤,且探针不易发生光漂白,适合进行长时间观测。更重要的是,当膜受体发生聚集时,探针粒子间距离的改变会造成其散射光谱和暗场图像颜色的改变(图3(a))。例如,Wang等[43]利用抗体标记的纳米金探针,对于跨膜蛋白ErbB1 和ErbB2在不同种类癌细胞表面的分布进行了成像分析(图3(a))。随着受体密度增大,纳米金探针间的距离缩短,当颗粒间的距离小于颗粒表面等离子体耦合发生的距离(<5 nm)时,散射光波长会发生明显的红移,并伴随散射光强的增加。此外,Wang等[44]先根据不同聚集程度的纳米银探针所对应的暗场散射光谱,将团聚的纳米银分为4类,然后用修饰有表皮生长因子(Epidermal Growth Factor Receptor,EGFR)抗体的30 nm 纳米银探针与A431细胞进行孵育后,根据探针的分布和对应的暗场散射光谱,定量描述了细胞膜表面EGFR的表达、密度和空间分布(图3(b))。另外,该研究组还利用修饰有EGFR 抗体的粒径为40 nm 的纳米金观察到了EGFR 在细胞伪足结构上的富集分布,并用扫描电镜(Scanning Electronic Microscopy,SEM)成像结果印证了这一发现[44]。在近期的一项研究工作中,Guo等[45]利用抗体修饰的纳米金探针对于细胞膜表面的人表皮生长因子受体2(HER2)进行了原位暗场成像(图3(c)),他们设计了一对非对称的纳米金探针,1号探针(Au1)修饰有HER2抗体和炔基,2号探针(Au2)修饰有叠氮基和能够起始滚环复制扩增(Rolling Circle Amplification,RCA)的DNA 链。在铜离子存在下,铜催化的叠氮-炔基环加成反应引发纳米金探针的聚集和光谱的红移,而RCA反应则进一步增强了红移效应。这一策略将RCA 引入暗场显微成像分析,为利用暗场显微镜在活细胞水平观测多种生物分子提供了可能。
2.2 用于对细胞内生物分子进行原位观测的PNPs
纳米金、纳米银等探针可以被大多数类型的细胞所摄取,通过对内吞进入细胞的PNPs进行成像和示踪,可以实现对于生物分子的检测和分析。
PNPs可以与细胞内的小分子发生相互作用,在此过程中探针的光散射信号发生改变,反映出目标分子空间分布和局部浓度的变化。例如,Xiong等[46]发展了一种以核壳结构的Au@Ag复合纳米棒为探针,通过单粒子暗场散射光谱,对活细胞中内源性的硫化氢进行原位检测的成像技术。由于硫化物对于银的刻蚀作用,在探针表面形成Ag2S,诱导光谱发生红移,因此通过检测光谱变化的动力学,能间接测定局部硫化物浓度及其波动(图4(a))。
PNPs也可用于蛋白酶活力的测定。Tajon等[28]构建了一种纳米等离子体“尺子”,包含两个多层核壳结构的Zn0.4Fe2.6O4@SiO2@Au纳米颗粒,两个颗粒以一段可以被蛋白酶caspase-3 特异性识别和切割的肽链连接。Caspase-3 是细胞激活凋亡过程的标志性蛋白酶,细胞凋亡发生时,caspase-3 活性上升,将两个纳米颗粒中间的连接序列切断,由于等离子体耦合作用的消失,散射光的强度发生明显下降(图4(b))。通过暗场显微镜对纳米等离子体“尺子”的光强进行成像和定量分析,研究者们在药物处理的慢性白血病细胞K562 细胞中检测到了2~4 倍的caspase-3活性上调。该探针为实现可视化的高通量药物筛选提供了全新的可能。
最近,Wang等[47]利用等离子体纳米探针实现了对于单个细胞内表观遗传信息的定位和定量表征。如图4(c)所示,纳米金和纳米银颗粒分别被修饰了针对不同胞嘧啶修饰形式的抗体,由于探针间距离靠近会引起光谱红移,利用高光谱暗场显微成像实现了单个细胞内染色质胞嘧啶羧基修饰(5-carboxylcytosine,5caC)的定量和空间定位,还得到了局部的修饰基团密度。研究者们通过比较不同细胞周期的成像结果,证明5caC这种表观遗传修饰在细胞周期中仍能保持稳定。
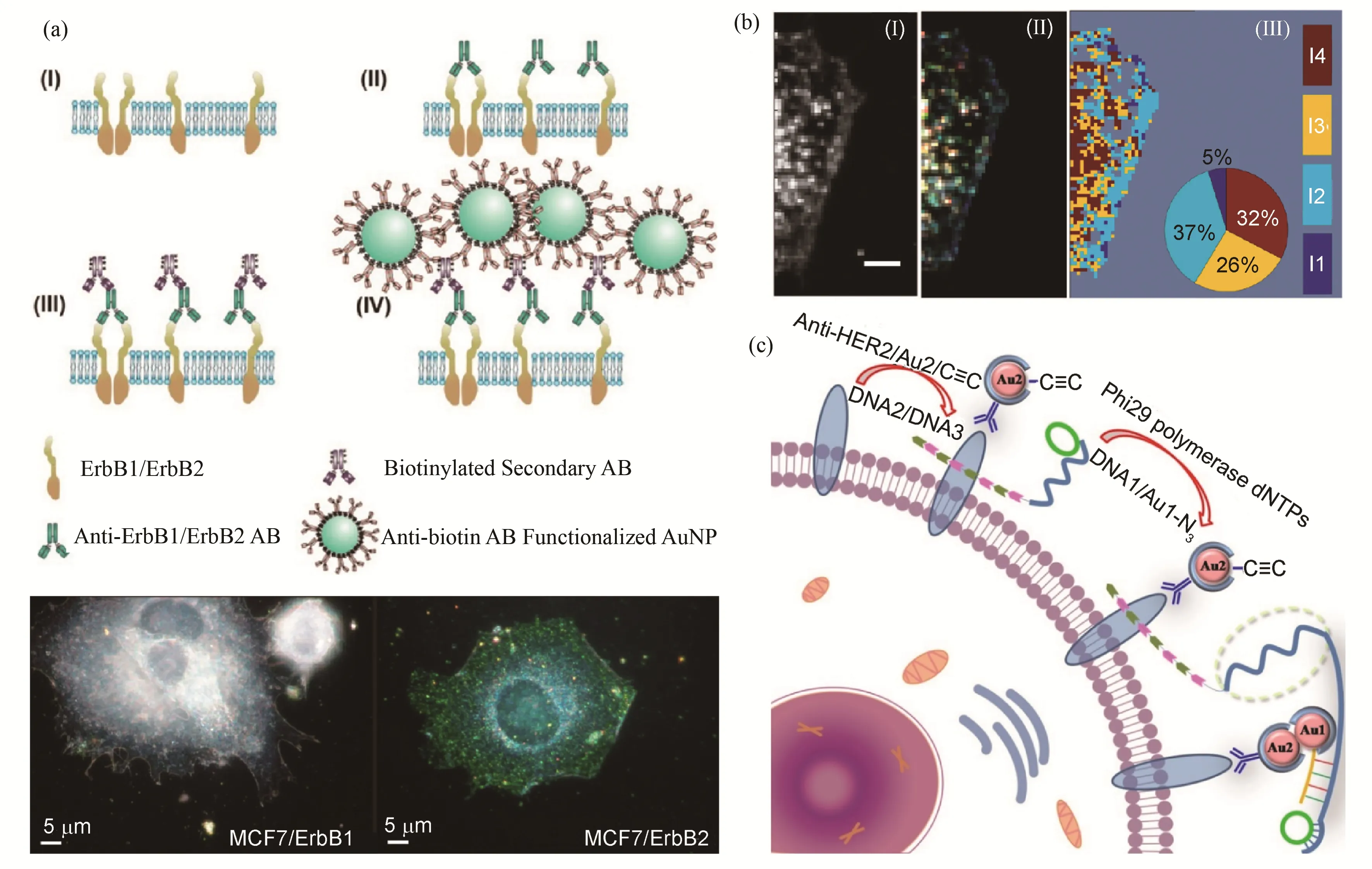
图3 暗场成像检测细胞表面受体分布(a)纳米金免疫标记ErbB跨膜蛋白[43],(b)纳米银标记EGFR受体蛋白分布密度[44],(c)纳米金RCA反应原位标记HER2蛋白分布[45]Fig.3 Cell membrane receptors distribution detection by dark-field microscopy(a)ErbB transmembrane protein immunolabeled by AuNP[43],(b)EGFR receptor density mapped by AgNP probes[44],(c)In situ labeling of HER2 proteins by RCA reaction with AuNP probes[45]
等离子体纳米探针在核酸成像分析方面也得到了广泛应用。Lee 等[48]在粒径为40 nm 的纳米金表面分别修饰了两条DNA单链,它们能够与乳腺癌易发基因(Breast cancer susceptibility gene 1,BRCA1)的两段外显子(exon8和exon12)对应的mRNA序列互补结合。如图5 所示,对于正常细胞内的BRCA1剪切形式,exon8和exon12相隔较远,结合的纳米金探针不容易发生耦合;而对于一些突变致癌类型的mRNA,由于exon9、exon10、exon11在mRNA剪接的过程中丢失,exon8和exon12序列相邻,结合的纳米金探针距离靠近,引起LSPR 光谱发生红移。这一方法实现了对于不同形式mRNA 剪接中间体的可视化,高灵敏的分辨。在最近的一项研究工作中,Li等[49]使用一对修饰有两段非对称DNA序列的、粒径为20 nm 的纳米金探针,这两个探针能够识别和结合同一mRNA分子的相邻序列。单个20 nm的纳米金的LSPR 散射光强度不足以被暗场显微镜捕捉,从而降低了游离探针的背景信号。当目标mRNA分子存在时,两个纳米金探针结合形成的纳米金二聚体发生等离子体耦合,散射光强度大大提高。研究者们成功地利用该探针在肿瘤细胞中检测到了单个mRNA分子。
2.3 用于观察细胞内转运过程的PNPs
等离子体纳米探针具有优异的光稳定性,特别适合活细胞实时成像,被应用于纳米颗粒的摄取和细胞内转运过程的研究。Qian 等[50]依托活细胞暗场成像系统,对摄取了纳米金探针(30 nm)的细胞进行了长达数十个小时的连续观察,捕捉到了修饰有核定位信号肽(Nuclear Localization Signal,NLS)的纳米金进入细胞核的动态过程,并观测了完整的细胞分裂周期过程中PNPs 的分布变化。纳米颗粒进入细胞后,普遍会发生团聚,聚集状态会对其生物学功能(如载药、光热治疗等)产生影响[51-52]。传统的荧光探针很难对纳米颗粒的聚集状态进行精确的分析。PNPs发生团聚时,聚集体内的粒子数与其散射光谱的波长存在相关性,这一特性被用来区分探针在细胞内的团聚程度。为了更准确地对暗场图像进行识别,研究人员将暗场图像从常用的红绿蓝(RGB)三色模型转换为包含有色度(Hue,H)、饱和度(Saturation,S)、亮度(Brightness,B)的HSB 颜色模型,后者能够更加准确地表现光谱特征[53]。借助于HSB 模型,Wang 等[54]对于纳米金聚集引起的颜色变化进行了定量分析,发现暗场图像中信号的亮度和色度的比值与聚集体中包含的颗粒数目具有良好的相关性(图6(a))。基于这一发现,该研究组进一步利用截面暗场显微镜对于细胞内纳米金探针的聚集状态进行了成像和分析[25]。结果表明:细胞内的纳米金探针可以根据其团聚程度分为4 类(N=1~3、N=4~6、N=7~12、N≥12)。为了实时地追踪纳米金在细胞内运输和聚集的过程,Liu等[55]发展了暗场和荧光联用的显微成像系统,通过纳米金表面修饰带有荧光的DNA 链,构建了同时具有LSPR 散射光信号和荧光信号的双标纳米金探针(fPlas-gold),通过表达融合荧光蛋白的方式,对细胞内的微管结构和内涵体、溶酶体等细胞器进行了荧光标记,结合荧光和暗场两个通道的成像信息,研究者们实时动态地观测了纳米金颗粒被细胞摄取、在胞内沿着微管转运并不断聚集的过程(图6(b)),并首次揭示了聚集体大小对其运动速率的影响。
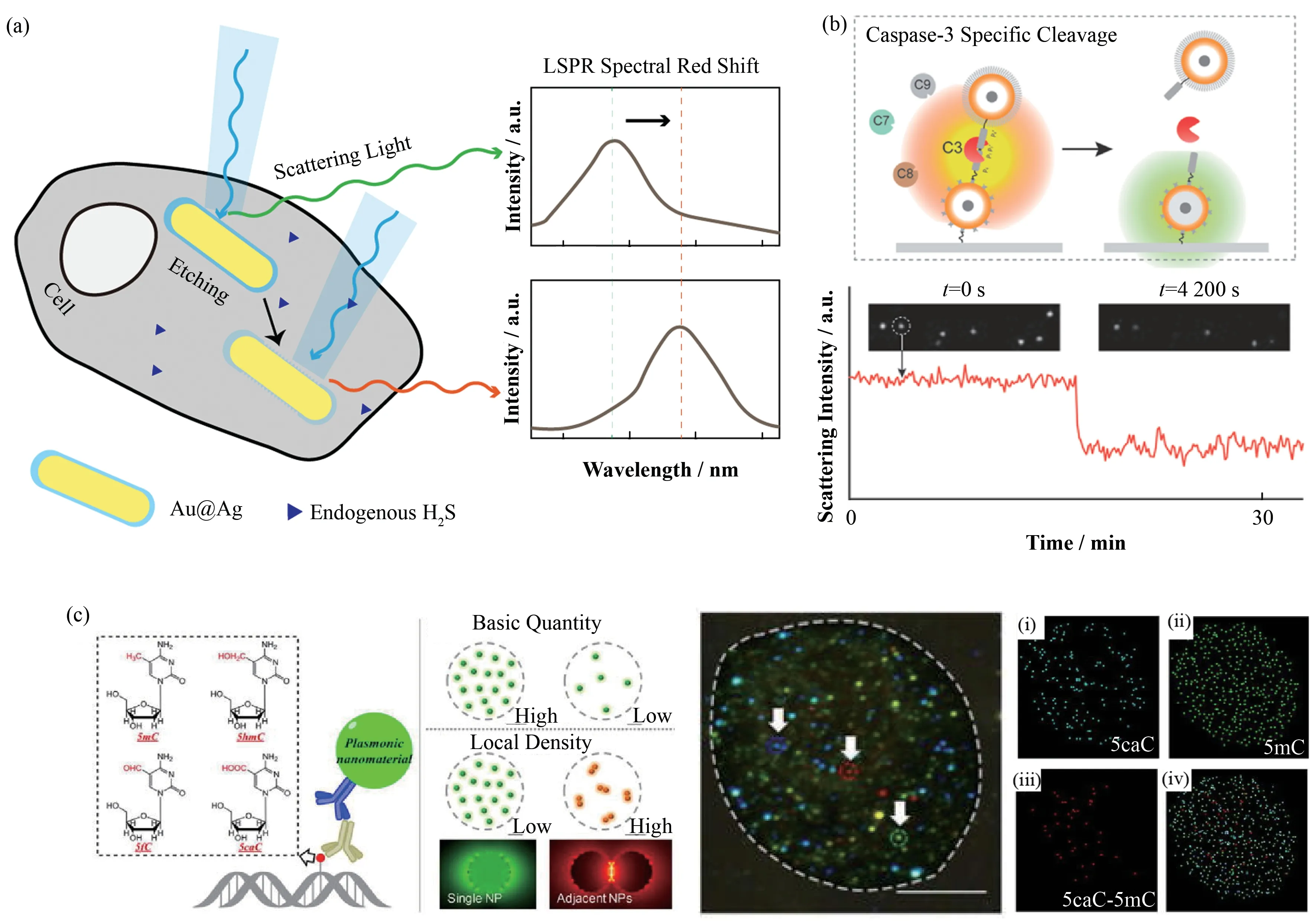
图4 暗场成像检测活细胞内分子(a)Au@Ag复合纳米棒实时监测胞内硫化氢[46],(b)纳米等离子尺子监测细胞凋亡过程[28],(c)抗体修饰AuNP和AgNP等离子纳米探针检测染色质胞嘧啶羧基修饰[47]Fig.4 Intracellular molecule real-time monitoring by dark-field microscopy(a)Intracellular sulphide sensing with Au@Ag core-shell nanorod[46],(b)Apoptosis detected by plasmon ruler[28],(c)Chromatin 5caC modification probed by immunolabeled AuNPs and AgNPs[47]
细胞在暗场成像时容易产生较为严重的散射光背景,通过使用甘油、蔗糖等介质提高样品的折射率等手段能够减弱细胞背景[56],但这种方法并不适用于活细胞样品的观察。为了实现胞内PNPs 信号的高通量自动化分析,使用偏置模糊聚类算法(Biasmodified Fuzzy C-means algorithm,BM-FCM)[57]在减少弥散性的散射背景干扰方面取得了较好的效果[58]。然而,该方法并不能有效地过滤一些由细胞内的囊泡或者脂肪滴所形成的点状散射光斑。目前,对于暗场图片中细胞内的等离子体探针信号,仍然需要对暗场粒子光斑的形状和颜色进行人工判断,或通过采集光谱的方法来进行准确的鉴定。
3 总结与展望
研究纳米材料与细胞的相互作用,对于促进多种纳米载体、纳米探针和诊疗制剂的临床转化至关重要。作为一种与荧光成像互补的技术,暗场显微成像在活细胞的可视化研究方面具有独特的优势。近期,研究者们在等离子体纳米探针的优化和暗场成像系统的改进方面取得许多进展,促进了活细胞暗场成像的应用。本文介绍了等离子体纳米探针的最新进展,分三个方面总结了等离子体纳米探针在细胞成像中的应用。目前,在荧光成像领域,已有许多成熟而高效的软件系统可以进行图像的自动化处理和数据分析,而暗场的图像和数据分析手段较为滞后,常常依赖于有经验的研究者进行手动分析,亟需开发相应的自动化数据分析工具。相信随着等离子体纳米探针的进一步优化,暗场显微成像技术会对细胞研究产生更为深远的影响。
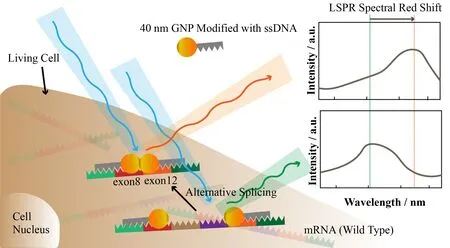
图5 纳米金探针耦合检测细胞质中的mRNA剪接[48]Fig.5 Detection of mRNA splicing based on plasmon coupling of AuNPs[48]

图6 纳米金聚集与胞内转运(a)纳米金聚集体暗场和对应的SEM图像[49],(b)fPlas-gold探针被细胞摄取和在胞内的运动与聚集[55]Fig.6 AuNP aggregation and intracellular trafficking(a)The correlative dark-field images and SEM images of aggregates with increasing number of AuNPs[49],(b)The internalization and trafficking of fPlas-gold[55]

