聚乙烯亚胺官能化核-壳型磁性钴纳米粒/血红蛋白传感器制备及过氧化氢的测定
裴新月, 黎夏彤, 樊 璨, 舒 婷, 吴 诗, 闵 清, 王 诗*
(湖北科技学院药学院,湖北咸宁 437100)
电化学生物传感器在临床诊断、农残分析、食品药品工业等领域具有广泛的应用前景。在电化学生物传感器的研制中,一个关键的技术就是如何将生物材料稳定、高活性地固定到基体电极表面,构成传感器的敏感膜。近年来磁性纳米粒(Magnetic Nanoparticles,MNPs)由于其兼具纳米粒的表面与界面效应,以及特殊的磁学性质成为研究的热点。MNPs以磁性材料为中心,在其表面连接生化活性功能基团,不但具备良好的磁导向性,也具有良好的生物相容性[1]。将MNPs作为固定化载体,在外加磁场的作用下可将生物材料定位于电极表面[2,3],应用于酶传感器[4,5]、免疫传感器[6,7]、DNA传感器[8]等生物传感器中。
目前MNPs的使用以铁及铁系氧化物居多[9],但Fe、Fe3O4很容易被氧化成γ-Fe2O3,导致粒子发生聚集和沉淀,不能形成稳定的分散体系,限制了其应用。通过对MNPs进行修饰,如外包高分子形成核-壳结构,可以降低其表面能,得到分散性良好的MNPs[10,11]。因为利用壳结构不仅保护磁性核心纳米颗粒不受环境影响降解,也防止聚结[12]。在壳的外层修饰连接功能化基团,如羟基、胺和氨基,有利于MNPs在水性介质中形成更稳定的分散体[13 - 15]。血红蛋白(Hb)在生命活动和生物代谢过程中起着重要的作用,由于其具有过氧化物酶和细胞色素P450的生物催化作用,是研究生物大分子电化学的理想模型物。但Hb直接固定在电极上变性失活,且电子转移率低。本研究制备了聚乙烯亚胺(PEI)官能化的核-壳型磁性钴纳米粒(Co@C-PEI MNPs),利用Co@C-PEI MNPs良好的磁性和生物相容性固载Hb,制备Hb/Co@C-PEI MNPs修饰的丝网印刷传感器(Hb/Co@C-PEI/SPE)。配合实验室自制的反应池,将Hb/Co@C-PEI/SPE用于H2O2的测定,取得良好效果。
1 实验部分
1.1 仪器及试剂
CHI660E电化学工作站(上海辰华);JB-2磁力搅拌器(上海雷磁);UV-8000紫外分光光度计(日本,岛津);Quanta 250扫描电镜(美国,FEI);Tecnai-G2-TwinF20能谱扫描仪(美国,FEI);JEM-2010FEF透射电镜(日本,JEOL);XRD -6000X射线衍射仪(日本,岛津)。实验室用多功能丝网印刷设备(珠海凯为)。
丝网印刷ED 423SS碳油墨、ED 427SS银油墨、CNC-01 Ag/AgCl油墨及ED 452SS BLUE绝缘油墨,均购于美国Acheson;PVC片材(上海新立);碳包覆钴纳米粒(Turbobeads Llc);猪血红蛋白(上海源叶);H2O2(Sigma)每次试验前重新配制;其他试剂均为分析纯。实验用水均为二次蒸馏水。
1.2 实验方法
1.2.1 Co@C-PEI MNPs的制备依照文献方法[16]制备Co@C-PEI MNPs:取200 mg Co@C纳米粒和100 mg 3-苯基环氧乙烷-2,2-二腈(0.59 mmoL),于120 ℃下微波加热4 min。在磁铁的帮助下回收冷却颗粒,并用乙酸乙酯和乙醚洗涤。蒸发溶剂后,得到204 mg纳米粒备用。在氮气保护下于烧瓶中加入8.5 mL四氢呋喃和320 μL三甲基氯硅烷(2.56 mmoL),搅拌的同时加入96.8 mg硼氢化钠。将所得溶液在80 ℃下加热4 h,冷却至室温后,加入160 mg备用的纳米粒。将反应混合物在80 ℃加热24 h,然后用四氢呋喃和乙醚洗涤,真空干燥后得到157 mg 氨基官能化Co@C纳米粒。取该纳米粒100 mg于10 mL二氯甲烷中超声分散15 min。搅拌的同时加入778 μL二甲亚胺(15 mmoL)和15 μL的HCl,加热至80 ℃保持24 h。使用外部磁铁收集纳米粒,然后用100 mL二氯甲烷、750 mL水洗涤,在50 ℃真空干燥即得284 mg Co@C-PEI MNPs。
1.2.2 Hb/Co@C-PEI/SPE的制备于PVC基材表面逐层套印导电银轨、工作电极、Ag/AgCl参比电极和辅助电极,置烘箱中烘干,最后印刷绝缘层,紫外烘干。制备的丝网印刷传感器(SPE)用水清洗,氮气吹干备用[17]。吸取5 μL Co@C-PEI混悬液滴加在SPE的表面,SPE下方放置磁铁,室温干燥后即制得Co@C-PEI/SPE。取5 μL Hb溶液修饰于工作电极表面,在4 ℃下干燥,制得Hb/SPE。将Hb溶液加至Co@C-PEI混悬液中混匀,取5 μL修饰于工作电极表面,在SPE下方放置磁铁,4 ℃下干燥后即制得Hb/Co@C-PEI/SPE,于4 ℃下保存备用。Hb/Co@C-PEI/SPE结构见图1。
1.2.3 反应池的制备及使用反应池由二部分组成,上部分由聚二甲基硅氧烷凝固态的方体和外包有环氧树脂的固化态外壳组成,中间开有适应SPE反应区域的孔洞;下部分由环氧树脂固化态组成,内嵌磁铁,通过角码和螺丝与上部分连接(图2内插图)。使用时将SPE放置于下部分的表面,然后覆盖上部分,调整SPE的位置使其反应区域(包含工作电极、参比电极及辅助电极)位于上部分的孔洞中,下部分的磁铁位于SPE的反应区域正下方。将SPE与电化学工作站相连接,即可开始测试(图2)。
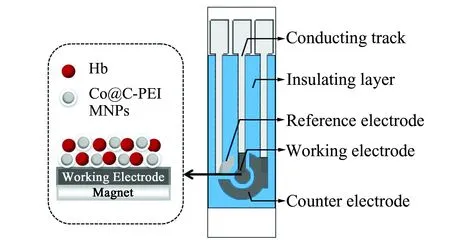
图1 Hb/Co@C-PEI/SPE示意图Fig.1 Schematic diagram of Hb/Co@C-PEI /SPE

图2 SPE放置于反应池(内插图为反应池)Fig.2 The SPE placed in the laboratory-constructed cell(Inset:laboratory-constructed cell)
1.2.4 电化学测定方法循环伏安法(CV)扫描范围-1.0~0.2 V;电流-时间响应实验(i-t)工作电位为-0.46 V,间隔加样时间为50 s。0.1 mol/L磷酸盐缓冲溶液(PBS)由NaH2PO4和Na2HPO4配制,溶液在使用前高纯氮气除氧20 min,并且在氮气氛下进行实验。
2 结果与讨论
2.1 Co@C-PEI MNPs的表征
图3是所制备的Co/C-PEI MNPs的典型透射电镜(TEM)图像。可以看出Co/C-PEI MNPs具有核-壳结构,其尺寸范围为20~100 nm,碳壳的厚度仅为1~3 nm。能谱(EDX)分析表明Co/C-PEI MNPs由内Co核和外碳壳组成,其中Cu的信号来自铜网。
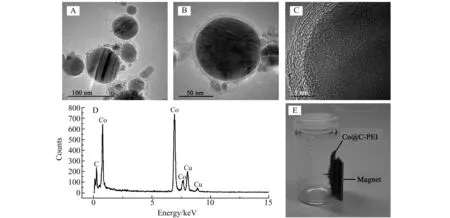
图3 Co@C-PEI MNPs的TEM(A-C),EDX(D)及实物图(E)Fig.3 TEM images(A-C),EDX spectrum(D) and photograph(E) of the Co@C-PEI MNPs
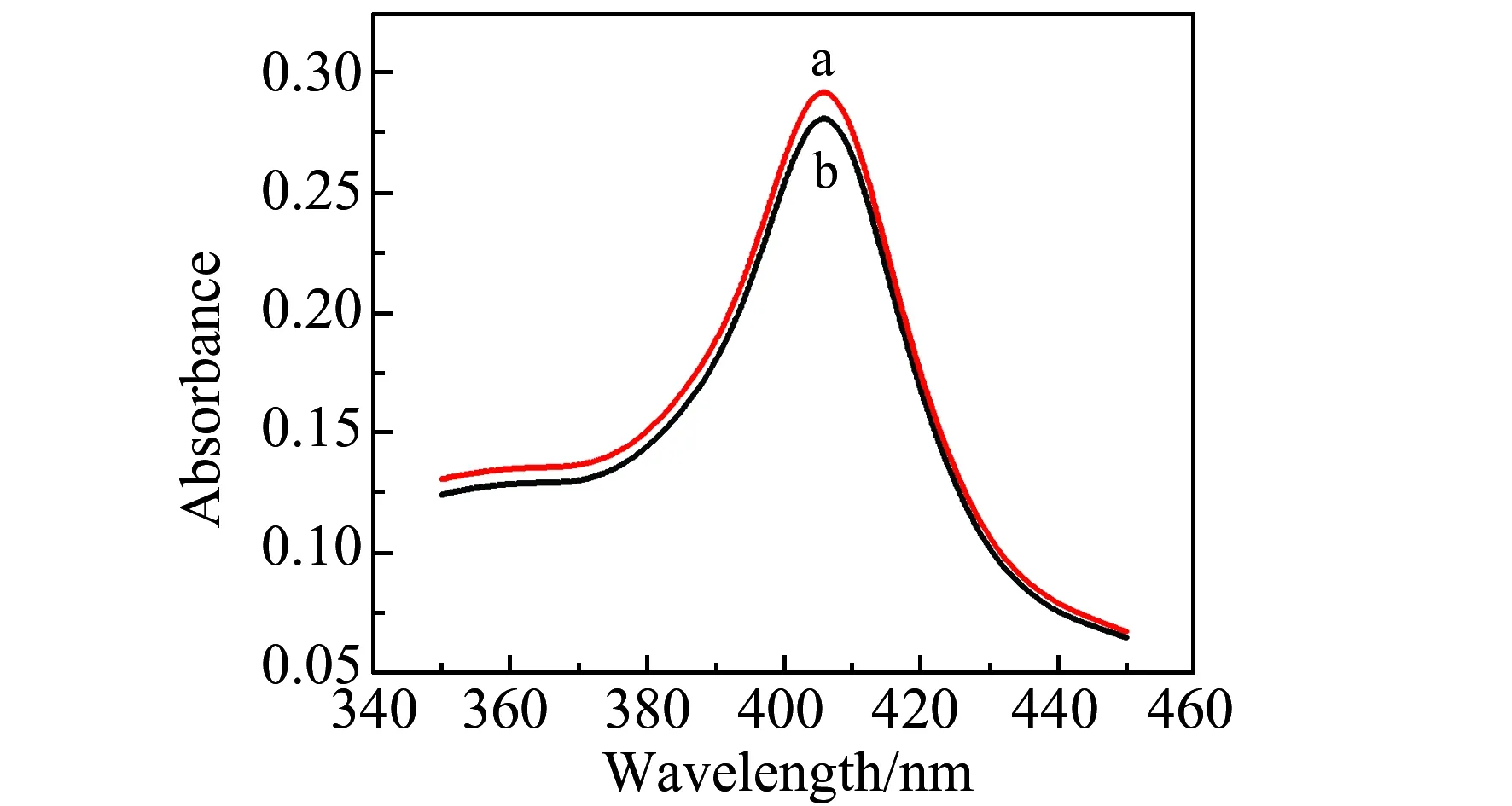
图4 Hb(a)和Hb/Co@C-PEI MNPs混合液(b)的UV-Vis吸收光谱Fig.4 UV-Vis absorption spectra of Hb (a) and Hb/Co@C-PEI MNPs (b) in water
2.2 紫外-可见吸收光谱
利用紫外-可见吸收光谱吸收带的位置和形状观察Hb是否变性。如图4所示,Hb/Co@C-PEI MNPs混合溶液与Hb溶液的光谱吸收带的形状基本一样,出峰位置均在405 nm处,与天然态Hb分子的Soret吸收带一致,表明Hb在Co@C-PEI MNPs溶液中可保持自然构象。
2.3 修饰传感器的表征
分别对未修饰传感器(bare SPE)和Hb/Co@C-PEI修饰传感器(Hb/Co@C-PEI/SPE)进行扫描电镜(SEM)表征。未经过修饰的工作电极表面粗糙,含有大量分布不均匀的片层结构,布满碳墨颗粒(图5A);经过修饰后,工作电极表面更为平整,可见分散的Co@C-PEI 纳米粒(图5B),这些磁性纳米粒在外加磁铁的作用下不但有利于Hb在电极表面的富集,还能改变工作电极表面电化学特性,有利于电子在工作电极表面传递。

图5 未修饰传感器(A)和Hb/Co@C-PEI修饰的传感器(B)的SEM图Fig.5 SEM images of the bare SPE(A) and Hb/Co@C-PEI/SPE(B)
2.4 修饰传感器的电化学特性
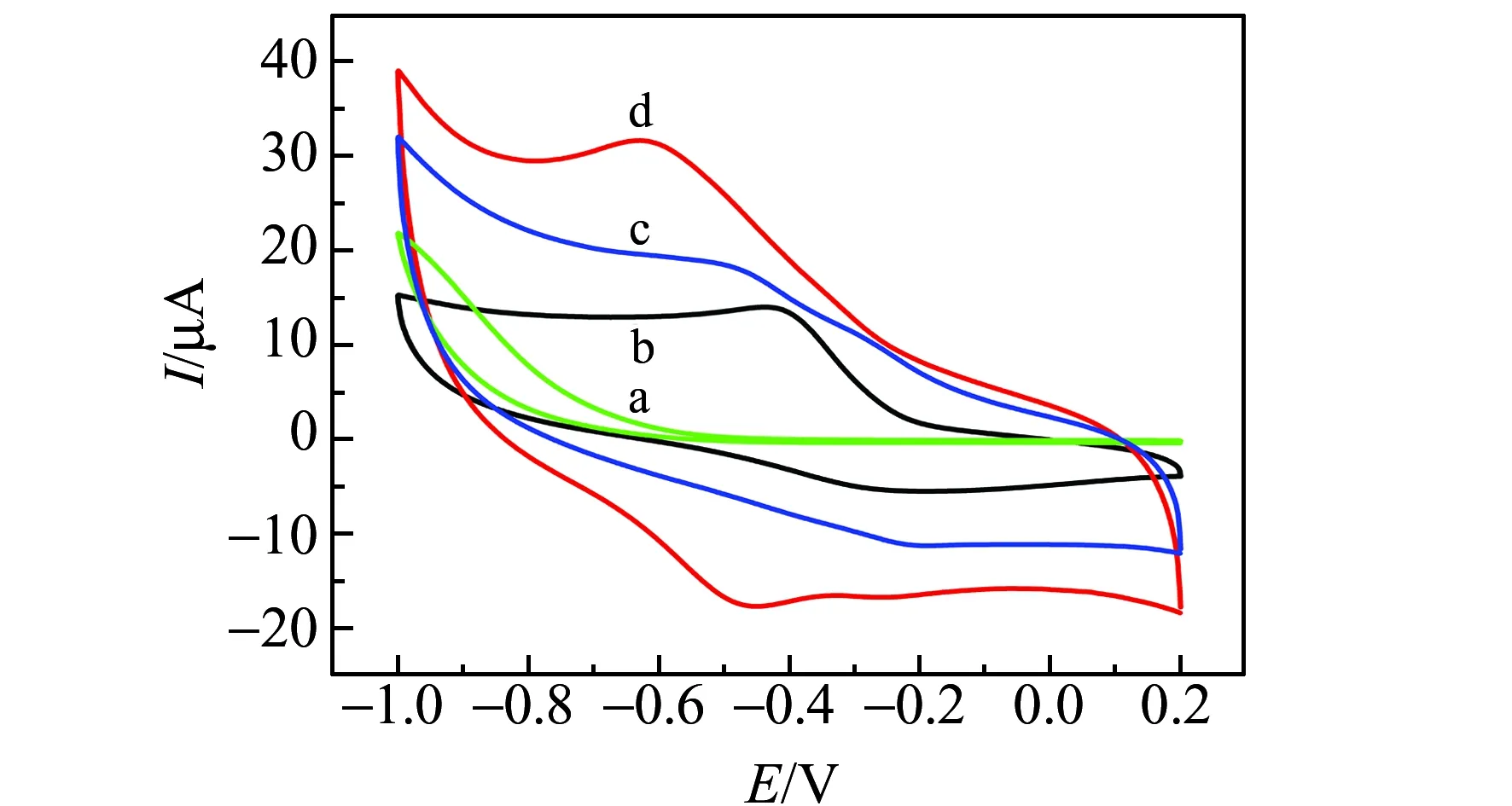
图6 未修饰传感器(bare SPE)(a)、血红蛋白修饰传感器(Hb/SPE)(b)、Co@C-PEI MNPs修饰传感器(Co@C-PEI/SPE)(c)和Co@C-PEI MNPs/血红蛋白修饰传感器(Hb/Co@C-PEI/SPE)(d)在0.1 mol/L PBS中的循环伏安曲线(扫描速度:100 mV/s)Fig.6 Cyclic voltammetric curves of 0.1 mol /L PBS solution at bare SPE(a),Hb/SPE(b),Co@C-PEI/SPE(c) and Hb/Co@C-PEI/SPE(d)(scan rate:100 mV/s)
采用循环伏安法(CV)考察未修饰传感器(bare SPE)、Co@C-PEI MNPs修饰传感器(Co@C-PEI/SPE)、血红蛋白修饰传感器(Hb/SPE)和Co@C-PEI MNPs/血红蛋白修饰传感器(Hb/Co@C-PEI/SPE)在pH为8.0的0.1 mol/L PBS中的电化学响应。如图6所示,Co@C-PEI/SPE与bare SPE相比背景电流增大,说明Co@C-PEI MNPs具有良好的导电性,并且具有大的比表面积。而Hb/SPE只有还原峰(-0.42 V),无对应氧化峰出现,但Hb/Co@C-PEI/SPE在电位-0.52 V和-0.61 V出现了一对氧化还原峰。表明Co@C-PEI MNPs能保持Hb的活性,实现Hb血红素中心Fe(Ⅲ)/Fe(Ⅱ)与电极间的直接电子转移。通过公式:Q=nFAΓ*,计算得Hb在Hb/Co@C-PEI/SPE上的表观覆盖量(Γ*)为1.90×10-10mol/cm2,有活性的Hb约为电极表面Hb总量(3.68×10-9mol/cm2)的5.16%,并大于血红蛋白理论单层覆盖量1.89×10-11mol/cm2 [18],说明电极表面Co@C-PEI MNPs固载了多层Hb参加了反应。
采用CV法在不同扫描速率下测定Hb/Co@C-PEI/SPE表面的电化学响应(图7)。随着扫描速率的增加,氧化还原峰电流也相应地增加,在40~300 mV/s扫速范围内,其氧化峰电流与还原峰电流与扫描速度成正比,说明Hb/Co@C-PEI/SPE表面电极过程为表面控制过程。
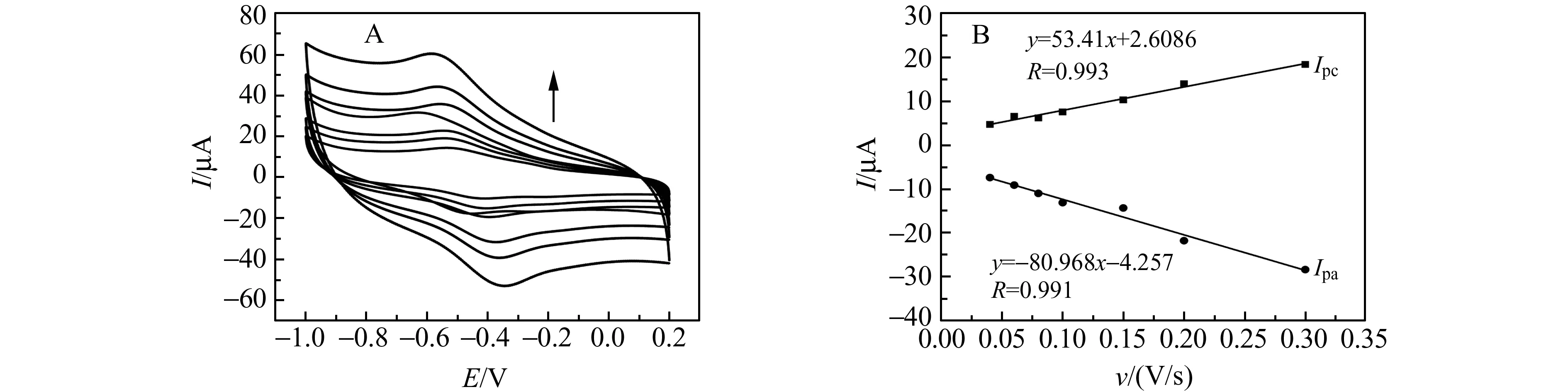
图7 (A)不同扫描速率下Hb/Co@C-PEI/SPE的CV响应(内→外:扫描速度分别为40,60,80,100,150,200,300 mV/s);(B)峰电流(Ipa,Ipc)与扫描速度的线性关系Fig.7 (A) Cyclic voltammetric curves of 0.1 mol/L PBS solution at Hb/Co@C-PEI/SPE(Inner→Outer:scan rate are 40,60,80,100,150,200,and 300 mV/s,respectively);(B) The relationships of Ip(Ipa,Ipc) vs.scan rate
通过CV法考察不同pH对Hb/Co@C-PEI/SPE电化学行为的影响。在pH为4.0~10.0范围内,随着pH值增加,Hb的氧化还原峰的峰形几乎不变,但氧化峰电位和还原峰电位均发生负移。当pH值为8.0时,峰电流最大,灵敏度最高。综合考虑峰电流大小和峰形,选择pH值为8的0.1 mol/L PBS为测定介质。
2.5 不同浓度修饰材料对Hb电化学响应的影响
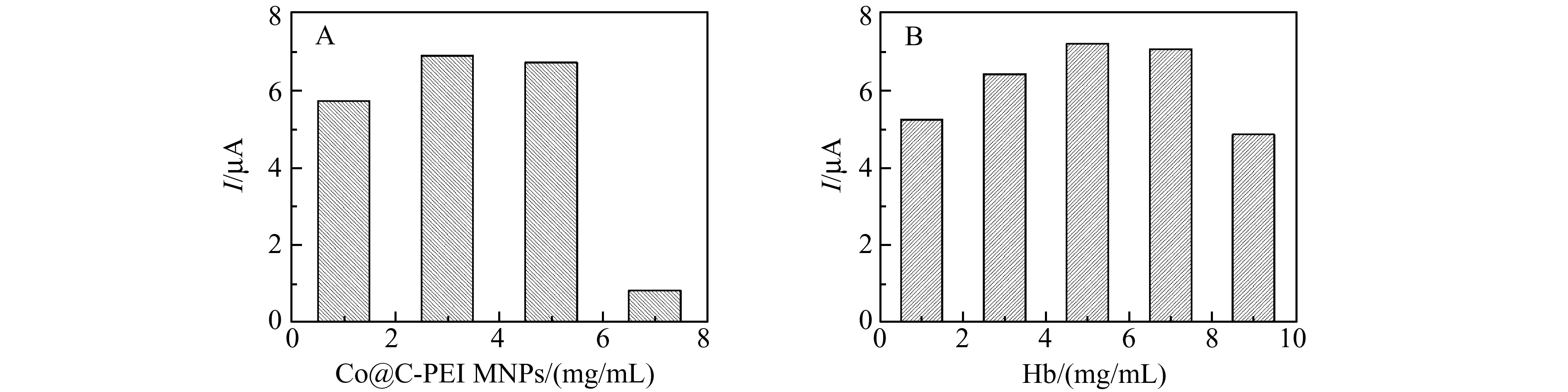
图8 Co@C-PEI MNPs浓度(A)及Hb浓度(B)对Hb电化学响应的影响Fig.8 Effects of Co@C-PEI MNPs(A) and Hb(B) on the peak current of Hb responses
采用CV法考察Hb/Co@C-PEI修饰液中Co@C-PEI MNPs浓度,以及Hb浓度对Hb电化学响应的影响。当Co@C-PEI MNPs的浓度从1.0 mg/mL增加到3.0 mg/mL时,Hb峰电流逐渐增加。当浓度超过3.0 mg/mL,Co@C-PEI MNPs的背景电流增加,Hb峰电流的灵敏度反而降低(图8A)。Hb的浓度从1.0 mg/mL增加到5.0 mg/mL时,Hb峰电流随着Hb的增加而增加。当浓度超过5.0 mg/mL,Hb峰电流的逐渐降低,可能是由于超过了Co@C-PEI MNPs的负载能力(图8B)。因此在本实验中Hb/Co@C-PEI修饰液中Co@C-PEI MNPs的浓度为3.0 mg/mL,Hb浓度为5.0 mg/mL。根据SPE工作电极的实际面积及修饰液的干燥时间,选择Hb/Co@C-PEI的修饰量为5 μL。
2.6 Hb/Co@C-PEI/SPE对H2O2的检测
2.6.1 循环伏安行为在溶液中加入H2O2后,观察Hb/Co@C-PEI/SPE对H2O2电催化还原的CV响应(图9),Hb的还原峰电流电流增加,氧化峰电流减小。随着H2O2浓度的增高,还原峰增加的越明显,为典型的电催化还原H2O2的过程。
2.6.2 H2O2线性、检测限及干扰实验采用电流-时间曲线(i-t),在恒定电位-0.46 V检测Hb/Co@C-PEI/SPE对H2O2的响应(图10)。在3.0×10-6~6.0×10-3mol/L浓度范围内,还原峰电流Ip与H2O2的浓度c呈线性关系,线性方程为:Ip=0.024c+5.4146(R=0.995),检测限(S/N=3)为1.37×10-6mol/L。
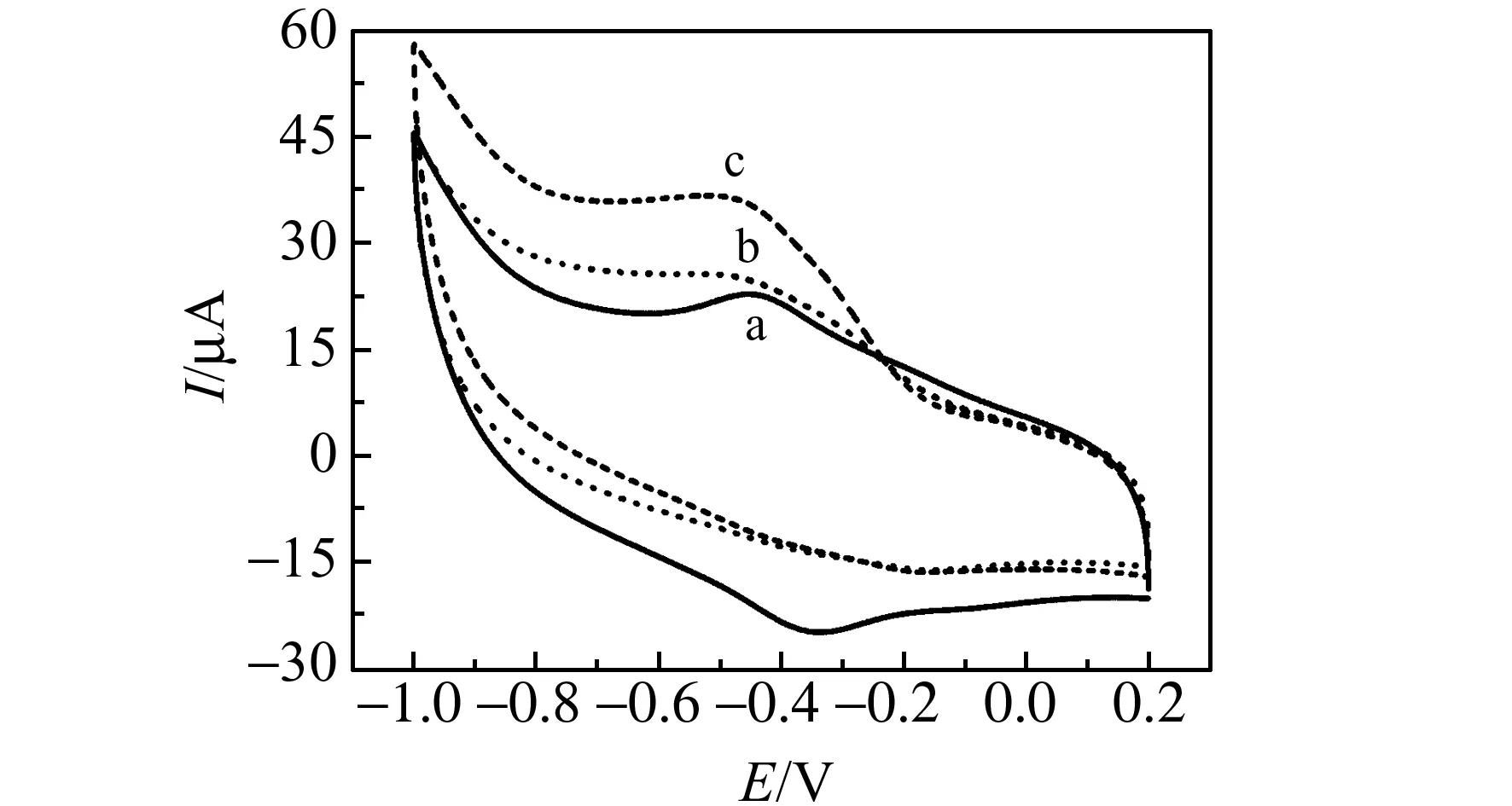
图9 Hb/Co@C-PEI/SPE在含不同浓度H2O2的PBS中的CV曲线(a→c:0.00,3.0×10-6 mol/L,3.0×10-5 mol/L,扫速:100 mV/s)Fig.9 CV curves for Hb/Co@C-PEI/SPE in 0.1 mol/L PBS containing different concentrations of H2O2(a→c:0.00,3.0×10-6 mol/L,3.0×10-5 mol/L,scan rate:100 mV/s)
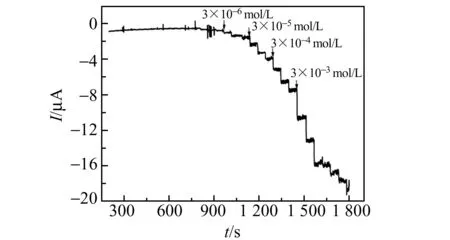
图10 Hb/Co@C-PEI/SPE对逐渐加入的H2O2的i -t 曲线(H2O2:3.0×10-6~6.0×10-3 mol/L,工作电位为-0.46 V)Fig.10 Amperometric i -t curve of Hb/Co@C-PEI/SPE at applied potential of -0.46 V upon successive additions of H2O2 in PBS(H2O2:3.0×10-6~6.0×10-3 mol/L)
采用i-t曲线,在电位-0.46 V对一些常见物质进行干扰实验。在H2O2为6.0×10-6mol/L条件下,金属离子如Na+、K+、Ca2+、Mg2+(浓度为6.0×10-6mol/L);有机物如葡萄糖、抗坏血酸、多巴胺和尿酸(浓度为6.0×10-6mol/L)对H2O2的测定基本不产生影响。
2.6.3 Hb/Co@C-PEI/SPE的稳定性和重现性随机抽取5片Hb/Co@C-PEI/SPE,测定6.0×10-6mol/L 的H2O2,相对标准偏差(RSD)为6.67%。将制备好的Hb/Co@C-PEI/SPE置于4 ℃干燥保存,两周后进行测定,H2O2的测定基本不受影响(误差<5%),表明Hb/Co@C-PEI/SPE具有较好的稳定性。
3 结论
本实验制备了Co@C-PEI MNPs,在外加磁场的作用下固定Hb,实验结果表明,Co@C-PEI MNPs具有良好的分散性、导电性与生物相容性,Hb在Co@C-PEI MNPs中能保持其活性,表现出良好的电化学行为。Hb/Co@C-PEI/SPE配合自制的电化学反应池,实现了Hb活性中心与电极之间的直接电子传递,电催化H2O2的还原。Co@C-PEI MNPs为生物材料的固载及生物传感器的构建提供了新方法,与自制传感器的组合易于制成便携式设备,有望成为临床检测的有效工具。

