盐胁迫环境下发菜胞外多糖抗氧化作用及镇痛抗炎活性
常相娜,陈雪峰,龚 频,杨文娟,王 兰,袁 霞,刘 宁
(陕西科技大学食品与生物工程学院,陕西 西安 710021)
发菜(Nostocflagelliforme)又名发状念珠藻,是一种陆生经济蓝藻[1],发菜的营养价值很高,富含碳水化合物和蛋白质[2-3]。食用发菜对佝偻病、高血压、产后血亏等疾病有改善作用,发菜还能通便利尿、清热解毒、愈合伤口及降低血脂与胆固醇含量[4-6]。发菜可以在逆境(低温、少水、高盐等)下生存,因为发菜在生长代谢过程中分泌到细胞外的长链多糖,即发菜胞外多糖(extracellular polysaccharide,EPS)一方面作为渗透调节物质发挥作用;另一方面会在细胞表面形成保护膜,保护机体蛋白质不失活。陈雪峰等[7]研究发现处于0.3 mol/L NaCl胁迫环境时,EPS的分泌量较常规非盐胁迫培养细胞增加50.3%,且EPS的结构与部分理化性质也发生了改变[8],说明EPS是应激性的代谢产物,可抵抗逆境胁迫。
贾士儒[9]与Kanekiyo[10-11]等对常规培养发菜产生EPS的活性进行了研究,结果表明无盐胁迫发菜胞外多糖具有抗病毒、抗肿瘤及免疫调节等活性。范华等[12]研究了盐胁迫培养产生的发菜EPS的抗肿瘤活性及免疫活性,结果表明盐胁迫发菜胞外多糖比无盐胁迫发菜胞外多糖具有更好的抗肿瘤及免疫活性。陈雪峰等[7]报道了在BG-110(无氮)培养液、光照强度60 μmol/(m2·s)、NaCl浓度0.3 mol/L、连续培养6 d条件下获得的盐胁迫发菜胞外多糖具有抗氧化性。氧化应激与炎症、高脂血症的发生密切相关[13],抗氧剂则能够改善上述症状。陈雪峰等[7]的研究已证实盐胁迫发菜胞外多糖的抗氧化性,推测发菜清热解毒、降低血脂的功效与此有关。因此,本实验拟进一步研究其他培养条件下盐胁迫发菜胞外多糖抗氧化与抗炎镇痛活性。以BG-11(含氮)培养液、光照强度30 μmol/(m2·s)、NaCl浓度0.3 mol/L、连续培养15 d条件下获得的盐胁迫发菜胞外多糖为研究对象,采用温浴甩尾法及急性炎症模型对发菜EPS的镇痛抗炎作用进行初步研究,并结合研究发菜EPS体外的抗氧化作用,旨在为进一步开发利用发菜EPS提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
清洁级雄性昆明种小鼠,体质量(20±2)g,使用许可证号:SYXK2012(陕)2012-006,由西安交通大学医学院提供。
发菜细胞 陕西科技大学微生物制造研究室;二甲苯、冰醋酸(分析纯) 上海国药集团;生理盐水济宁辰欣药业股份有限公司;阿司匹林 石家庄石药集团欧意药业有限公司;醋酸地塞米松 河南国药集团容生制药有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)(分析纯) 美国Sigma公司;VC(分析纯) 天津市天力化学试剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BSA224S-CW型电子天平 德国Sartorius公司;UV-1100型紫外-可见分光光度计 上海美谱达仪器有限公司;KW-1000D型数显恒温水浴锅 上海梅香仪器有限公司;MGC-400HP光照培养箱 上海善志仪器设备有限公司;SW-CJ-1D超净工作台 苏州净化设备有限公司;H-1850R高速低温离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 发菜EPS的制备
将离心收集的对数期发菜细胞接种于含0.3 mol/L NaCl的BG-11培养液中,对照组不含NaCl。将细胞悬浮液置于光照培养箱中培养,光照强度30 μmol/(m2·s),光暗比12∶12(8∶00~20∶00光环境,20∶00~次日8∶00暗环境),白天温度25 ℃,夜晚温度10 ℃,连续培养15 d。参照陈雪峰等[14]的研究方法,过滤分离发菜培养液,Sevag法去除蛋白后收集培养液并浓缩,4 ℃醇沉,静置24 h后经离心分离发菜EPS,并装入透析袋,透析48 h去除小分子物质,冷冻干燥得发菜EPS。
1.3.2 发菜EPS体外抗氧化作用测定
1.3.2.1 羟自由基清除能力测定
准确吸取不同质量浓度的无盐胁迫发菜胞外多糖与盐胁迫发菜胞外多糖样品溶液1.0 mL,4.5 mmol/L FeSO41 mL,4.5 mmol/L水杨酸-乙醇溶液1 mL,混匀后加入4.4 mmol/L H2O21 mL启动Fenton反应,以VC为对照,37 ℃水浴30 min后8 000 r/min离心3 min,于510 nm波长处测定吸光度[15]。羟自由基清除率按公式(1)计算。
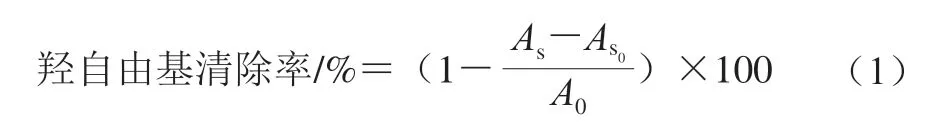
式中:As为样品吸光度;As0为样品本底吸光度;A0为空白对照吸光度。
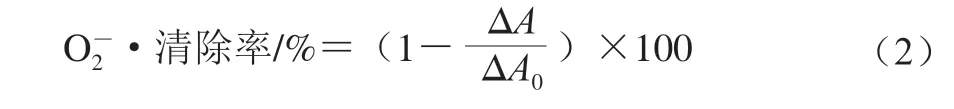
式中:ΔA0为邻苯三酚自氧化速率的吸光度;ΔA为加入样品后邻苯三酚的自氧化速率的吸光度。
1.3.2.3 DPPH自由基清除能力测定
参照陈雪峰等[17]方法并加以改进。准确吸取不同质量浓度无盐胁迫发菜胞外多糖与盐胁迫发菜胞外多糖样品溶液1.0 mL,加入0.03 mg/mL DPPH溶液4.5 mL,摇匀,37 ℃水浴30 min后,在517 nm波长处测定吸光度。以VC为对照。DPPH自由基清除率按公式(3)计算。

式中:As为样品吸光度;As0为样品本底吸光度;A0为空白对照吸光度。
1.3.3 小鼠温浴甩尾法镇痛实验
将小鼠尾尖部(<3 cm)浸入(50±0.5)℃的恒温水浴中,记录小鼠尾部自被放入水中起至出现甩尾的时间/s,此时间记为小鼠的基础痛阈值。经预选确定基础痛阈在2~10 s的小鼠进行温浴甩尾实验。合格小鼠96 只,随机分成12 组,每组8 只。采用皮下注射和腹腔注射两种方式给小鼠注射发菜EPS。空白对照组注射0.9%的生理盐水,阳性对照组为阿司匹林(30 mg/kgmb),再取4 组分别注射不同剂量发菜EPS(无盐胁迫发菜胞外多糖组:30 mg/kgmb;盐胁迫发菜胞外多糖组:低、中、高剂量分别为3、10、30 mg/kgmb)。每组小鼠在注射发菜EPS前(0 min)测定小鼠的基础痛阈值。在注射发菜EPS后每隔10 min测量一次小鼠的痛阈值,记录小鼠1 h内的痛阈值的变化,在测定过程中,痛阈值超过60 s按60 s计算[18]。
1.3.4 二甲苯致小鼠耳廓肿胀抗炎实验
取雄性昆明小鼠60 只,随机分成6 组,每组10 只,分别为生理盐水空白对照组、地塞米松阳性对照组(3 mg/kgmb)与不同剂量发菜EPS组(无盐胁迫发菜胞外多糖组:30 mg/kgmb;盐胁迫发菜胞外多糖组:低、中、高剂量分别为3、10、30 mg/kgmb)。各组每天上午10时腹腔注射发菜EPS一次(0.1 mL/10 gmb),连续5 d。末次注射发菜EPS前30 min,于每只小鼠左耳正反两面涂二甲苯30 μL,右耳为对照。致炎4 h后将小鼠颈部脱臼处死,沿耳廓剪下左、右两耳,以8 mm打孔器在两耳相同部位打下圆耳片,称质量,按公式(4)、(5)分别计算耳肿胀度和肿胀抑制率[19-20]。

1.4 数据统计与分析
实验结果均以平均值±标准差表示。数据处理采用SPSS 22.0统计软件,使用ANOVA程序对数据进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 发菜EPS体外抗氧化作用结果
2.1.1 羟自由基清除能力

图 1 发菜EPS羟自由基清除能力Fig. 1 Scavenging capacity of Nostoc flagelliforme extracellular polysaccharide on ·OH radical
如图1所示,无盐胁迫发菜胞外多糖与盐胁迫发菜胞外多糖均表现出对羟自由基的清除能力。与对照组相比,当发菜EPS质量浓度低于0.4 mg/mL时,羟自由基的清除能力从高到低为盐胁迫发菜胞外多糖>无盐胁迫发菜胞外多糖>对照组;当发菜EPS质量浓度为1~2 mg/mL时,羟自由基清除能力从高到低为对照组>盐胁迫发菜胞外多糖>无盐胁迫发菜胞外多糖。总体来看,盐胁迫发菜胞外多糖的羟自由基清除能力优于无盐胁迫发菜胞外多糖。当发菜EPS质量浓度达到0.8 mg/mL时,盐胁迫发菜胞外多糖组的羟自由基清除率达到51.81%,此质量浓度下无盐胁迫发菜胞外多糖组的羟自由基清除率为42.40%。伴随发菜EPS质量浓度增大羟自由基的清除能力也逐渐增强,呈现出较为明显的量效关系,但增幅逐渐减小。
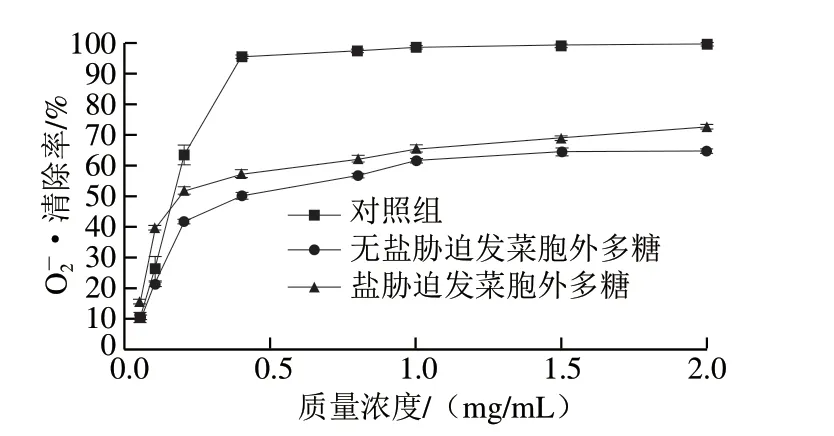
图 2 发菜EPS的·清除能力Fig. 2 Scavenging capacity of Nostoc flagelliforme extracellular polysaccharide on · radical
2.1.3 DPPH自由基清除能力
图3所示为盐胁迫发菜胞外多糖与无盐胁迫发菜胞外多糖的DPPH自由基清除能力结果。相比于对照组,在测定质量浓度范围下,DPPH自由基清除能力从高到低为对照组>盐胁迫发菜胞外多糖>无盐胁迫发菜胞外多糖。总体来看,盐胁迫发菜胞外多糖与无盐胁迫发菜胞外多糖对DPPH自由基清除能力低于对羟自由基与·。当发菜EPS质量浓度达到2 mg/mL时,盐胁迫发菜胞外多糖与无盐胁迫发菜胞外多糖的DPPH自由基清除能力分别为41.97%和36.46%,盐胁迫发菜胞外多糖对DPPH自由基的清除能力优于无盐胁迫发菜胞外多糖,且在实验质量浓度范围内,DPPH自由基清除能力与发菜EPS质量浓度呈现正相关。

图 3 发菜EPS DPPH自由基清除能力Fig. 3 Scavenging capacity of Nostoc flagelliforme extracellular polysaccharide on DPPH radical
2.2 不同注射方式下发菜EPS的镇痛作用
通过温浴甩尾法评价EPS的镇痛作用。0 min时各组小鼠痛阈值差异无统计学意义。由图4可知,皮下注射发菜EPS后,除生理盐水组外,皮下注射盐胁迫发菜胞外多糖与无盐胁迫发菜胞外多糖均有镇痛效果(图4A),各组小鼠在20、30、40 min时痛阈值均延长,表明发菜EPS具有显著的镇痛作用(P<0.05);由图4B可知,皮下注射发菜EPS在30 min时所有剂量都表现出极显著的镇痛效果(P<0.01)。伴随发菜EPS在小鼠体内代谢,注射发菜EPS 50、60 min时,镇痛作用不再显著。注射相同质量浓度的发菜EPS溶液,盐胁迫发菜胞外多糖镇痛效果比无盐胁迫发菜胞外多糖更好(图4A)。由图4B可知,盐胁迫发菜胞外多糖低、中、高剂量痛阈值分别为4.92、5.04、4.99 s,结果表明皮下注射盐胁迫发菜胞外多糖10 mg/kgmb发菜EPS溶液可显著延长温浴导致的小鼠甩尾反应时间,使痛阈值达到最大。图5所示的腹腔注射发菜EPS镇痛效果与皮下注射具有相类似规律,注射相同质量浓度的发菜EPS溶液,盐胁迫发菜胞外多糖镇痛效果比无盐胁迫发菜胞外多糖更好(图5A);图5B则表明不同剂量的盐胁迫发菜胞外多糖相比较,低、中、高剂量最高痛阈值分别为5.12、5.42、5.17 s,中剂量10 mg/kgmb发菜EPS溶液效果最好。
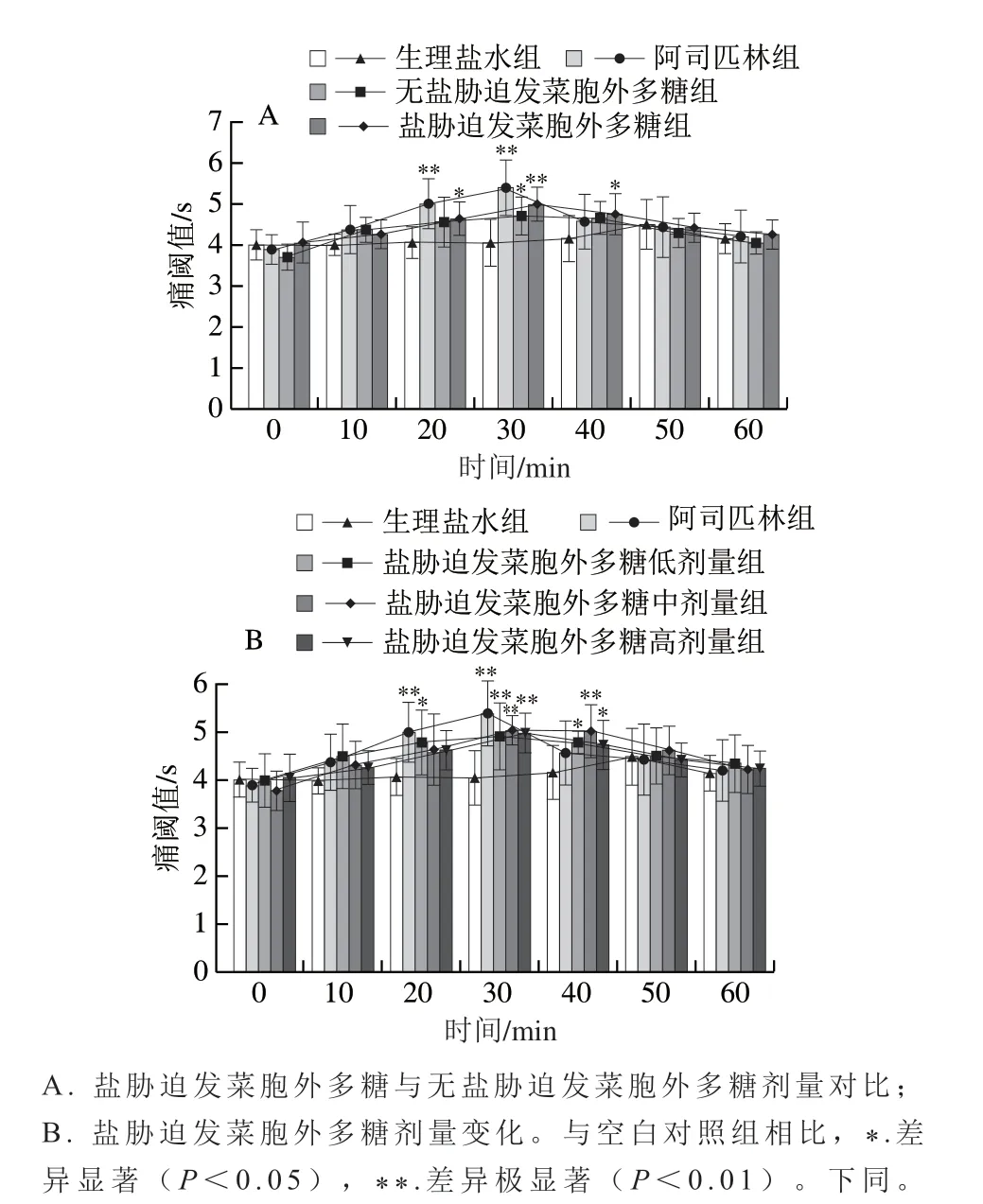
图 4 皮下注射发菜EPS对小鼠温浴甩尾痛阈值的影响(n =8)Fig. 4 Analgesic effect of subcutaneous administration of Nostoc flagelliforme extracellular polysaccharide (n = 8)
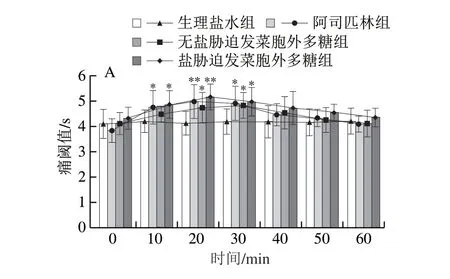

图 5 腹腔注射发菜EPS对小鼠温浴甩尾痛阈值的影响(n =8)Fig. 5 Analgesic effect of intraperitoneal administration of Nostoc flagelliforme extracellular polysaccharide (n = 8)
结合图4与图5,比较皮下注射和腹腔注射两种发菜EPS注射方式,相较于阿司匹林组,腹腔注射发菜EPS镇痛效果优于皮下注射的镇痛效果。皮下注射发菜EPS后,在30 min时所有剂量都表现出极显著镇痛效果,具有显著镇痛效果的时间区间为30~40 min,说明注射发菜EPS后,镇痛效果逐步发挥,30 min时药效最好。随着时间延长,发菜EPS在体内代谢,镇痛作用减弱。腹腔注射发菜EPS后,不同剂量的盐胁迫发菜胞外多糖溶液均可延长小鼠温浴甩尾的时间,20 min时所有剂量都表现出显著镇痛效果(P<0.05),镇痛效果发挥的主体时间为20~30 min。
2.3 发菜EPS的抗炎作用

图 6 发菜EPS对二甲苯致小鼠耳廓肿胀的影响(n =10)Fig. 6 Inhibitory effect of Nostoc flagelliforme extracellular polysaccharide on dimethylbenzene-induced mouse ear edema (n = 10)
如图6A所示,相较于空白对照组,无盐胁迫发菜胞外多糖组及盐胁迫发菜胞外多糖组均能极显著抑制二甲苯所致的小鼠耳廓肿胀(P<0.01),其中盐胁迫发菜胞外多糖肿胀抑制率(43.11%)高于无盐胁迫发菜胞外多糖的肿胀抑制率(32.88%),说明抑制二甲苯致小鼠耳廓肿胀方面,盐胁迫发菜胞外多糖优于无盐胁迫发菜胞外多糖。图6B表明低剂量组可以显著抑制二甲苯所致的小鼠耳廓肿胀(P<0.05),中剂量组与高剂量组均能极显著抑制二甲苯所致的小鼠耳廓肿胀(P<0.01),且盐胁迫发菜胞外多糖抗炎效果与剂量呈正相关,当盐胁迫发菜胞外多糖剂量为30 mg/kgmb时,肿胀抑制率最高为43.11%。
3 讨 论
发菜藻细胞在逆境胁迫条件下,形态、功能及抗逆活性物质等都会产生相应变化[21-23]。前期研究已经证实,盐胁迫发菜胞外多糖与无盐胁迫发菜胞外多糖相比,结构与理化性质发生了一定变化,进而可能导致功能活性发生改变,但具体发菜EPS的功能活性变化则有待进一步明确。
本实验采用体外自由基清除能力实验评价盐胁迫发菜胞外多糖的抗氧化性能,实验结果表明:相比于无盐胁迫发菜胞外多糖,盐胁迫发菜胞外多糖对羟自由基、·、DPPH自由基3 种不同类型自由基的清除能力均有所提高。自由基具有高氧化活性,化学性质非常活跃,被认为是导致机体各类损伤的根本原因。盐胁迫条件下发菜产生的EPS是一种应激性的代谢产物,合成受到逆境的影响,使得EPS的单糖组成发生改变。相较于无盐胁迫发菜胞外多糖,盐胁迫发菜胞外多糖中甘露糖、鼠李糖、葡萄糖醛酸及半乳糖的含量明显提高,无盐胁迫发菜胞外多糖的糖醛酸含量为6.37%,而盐胁迫发菜胞外多糖为7.39%[8],而糖醛酸被认为会增强酸性多糖的自由基清除活性,这一点在石斛多糖[24]、茶叶多糖[25]、金丝小枣多糖[26]及玉米须多糖[27]等多种多糖的体外抗氧化活性研究中都得到了证实。因此,盐胁迫发菜胞外多糖具有更为突出的自由基清除能力,可能与其糖醛酸结构含量上升相关。然而,根据文献报道,除单糖组成外,单糖联动位置、多糖的三维结构都可能与多糖的抗氧化性有关[28],因此,是否还有其他结构特征与盐胁迫发菜胞外多糖的抗氧化活性相关仍需进一步研究。
本实验通过温浴甩尾实验探讨发菜EPS的抗炎镇痛活性。镇痛实验结果显示,发菜EPS能明显延长温浴甩尾的时间,其中盐胁迫发菜胞外多糖镇痛效果优于无盐胁迫发菜胞外多糖,且腹腔注射(20 min)相较于皮下注射(30 min)起效速度快,镇痛效果更显著,产生上述差异的主要原因可能是两种发菜EPS注射方式的代谢动力学差异。腹腔注射主要为腹膜吸收,腹膜的面积大且密布血管和淋巴管,因此腹膜有很强的吸收能力,每小时可吸收动物体质量3%~8%的液体,而皮下注射是经皮下结缔组织间的毛细血管、淋巴管吸收进入血液循环[29],所以腹腔注射发菜EPS吸收速率和吸收量都优于皮下注射,这一结果与文献[29-30]报道的趋势一致。
二甲苯致小鼠耳廓肿胀实验结果显示,发菜EPS能明显抑制二甲苯所致的小鼠耳廓肿胀。相比于无盐胁迫发菜胞外多糖,盐胁迫发菜胞外多糖有更好的抗炎效果,且盐胁迫发菜胞外多糖的抗炎作用呈现出一定的量效关系。炎症是机体对损伤刺激所发生的防御反应,疼痛是机体受到伤害性刺激后所产生的一类保护性反应,疼痛与炎症常同时发生,两者都是临床中常见问题。同时,自由基损伤是炎症病理损伤的一个重要组成部分。本实验研究结果表明盐胁迫发菜胞外多糖具有良好的体外抗氧化活性,同时也具有体内镇痛抗炎活性,但几种活性之间的关联性及盐胁迫发菜胞外多糖在体内发挥活性的作用机理还有待深入研究。
本实验采用体外自由基清除能力实验评价盐胁迫发菜胞外多糖的抗氧化性能,并通过温浴甩尾和二甲苯致炎实验研究发菜EPS的抗炎镇痛活性,结果表明相较于无盐胁迫发菜胞外多糖,盐胁迫发菜胞外多糖具有更好的体外抗氧化与抗炎镇痛活性。为发菜EPS进一步作为功能性食品和多糖药品等高附加值产品的加工开发提供了数据支持和理论依据。

