不同临床分型新型冠状病毒肺炎患者临床特征及抗体、核酸检测结果分析
杨秀红,熊蓉,胡述立,范学朋,余芳
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2) 感 染引起的以肺部病变为主的新发传染病,目前全球疫情形势仍十分严峻,且无针对COVID-19的特效疗法,因此早期诊断、及时治疗COVID-19对降低患者病死率、有效控制疫情进展至关重要[1]。研究表明,SARS-CoV-2可刺激机体产生免疫应答并释放抗体,以IgM和IgG抗体为主,而血清特异性抗体是诊断感染的关键证据之一[2]。与核酸检测相比,抗体检测操作简单、便捷,对实验室环境及人员要求相对较低,且仅需采集血液标本,可在一定程度上降低医护人员在标本采集、检测过程中被感染的风险,是快速筛查和辅助诊断的重要手段[3]。《新型冠状病毒肺炎诊疗方案(试行第七版)》[4]指出,SARS-CoV-2特异性IgM抗体多在发病3~5 d后呈阳性,IgG抗体滴度恢复期较急性期增高4倍及以上。本研究回顾性分析不同临床分型COVID-19患者临床特征及抗体、核酸检测结果,以期提高临床医生对COVID-19的诊疗水平。
1 对象与方法
1.1 研究对象 选取2020-02-12至2020-03-07在武汉市第一医院确诊的COVID-19患者412例,其中男183例(占44.4%),女229例(占55.6%);平均年龄(60.2±14.2)岁。根据临床分型将所有患者分为普通型组111例、重型组254例及危重型组47例,其中少部分由普通型转为重型或危重型的重叠病例纳入重型组或危重型组。所有患者流行病学史、临床表现及实验室检查、肺部影像学检查资料完整。排除既往合并类风湿关节炎、系统性红斑狼疮等自身免疫性疾病、肿瘤等患者。本研究符合武汉市第一医院医学伦理委员会伦理规范要求(伦理批号:[2020]16号)。
1.2 COVID-19诊断标准及临床分型标准 COVID-19符合中华人民共和国国家卫生健康委员会颁布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[4]中的相关诊断标准,其中核酸检测阴性者需完善其他常见病原学检测(包括流感及呼吸道合胞病毒核酸检测、EB病毒DNA/抗体检测、巨细胞DNA/抗体检测、痰涂片、痰培养、血培养等),以排除其他感染,并结合肺部影像学特点及SARS-CoV-2抗体检测结果以明确诊断。临床分型参考以下标准,普通型:具有发热、呼吸道症状,影像学检查显示肺炎表现。成年人符合下列任意一项者判定为重型:(1)出现气促,呼吸频率≥30次/min;(2)静息状态下,指脉血氧饱和度≤93%;(3)动脉血氧分压(PaO2)/吸入氧浓度(FiO2)≤300 mm Hg(l mm Hg=0.133 kPa),高海拔(海拔>1 000 m)地区应校正PaO2/FiO2:PaO2/FiO2×〔大气压(mm Hg)/760〕。影像学检查显示24~48 h内肺部病灶明显进展>50%者按重型管理。符合以下任意一项者判定为危重型:(1)出现呼吸衰竭并需要机械通气治疗;(2)出现休克;(3)合并其他器官功能衰竭需在ICU监护治疗。
1.3 数据收集 通过院内电子病历系统收集患者人口学特征、既往病史、首发症状、实验室检查指标、发病至入院时间、核酸检测情况、抗体检测情况、临床治疗情况及预后等,并汇总于电子表格,由两位医师进行审查。人口学特征主要包括年龄、性别。普通型组为其入院48 h内首次实验室检查结果,重型组及危重型组为其确定为重型/危重型(入院、病情恶化或入住ICU 48 h内)首次实验室检查结果,主要包括血常规〔白细胞计数(WBC)、血小板计数(PLT)、中性粒细胞百分比(Neu%)、淋巴细胞百分比(Lym%)、中性粒细胞计数(Neu)及淋巴细胞计数(Lym)〕、白介素6(IL-6)、C反应蛋白(CRP)及降钙素原(PCT)。患者入院后立即安排进行SARS-CoV-2核酸检测,并根据患者病情变化、核酸检测结果等具体情况决定是否重复进行核酸检测,两次核酸检测采样间隔时间>24 h,本组患者核酸检测次数2~9次,核酸检测结果均为阴性者记为阴性,核酸检测结果至少有1次为阳性者记为阳性,核酸检测情况主要包括核酸检测时间及结果。抗体检测情况主要包括抗体检测时间及结果。临床治疗情况主要包括抗病毒药物、中药方剂、抗细菌药物、抗真菌药物、糖皮质激素、丙种球蛋白、白蛋白使用情况及肠内/肠外营养支持、氧疗措施、呼吸机支持方式等。预后包括好转/治愈出院、转往其他定点医院及死亡。
1.4 统计学方法 采用SPSS 22.0统计学软件进行数据处理。计数资料以相对数表示,多组间比较采用χ2检验,组间两两比较检验水准α′=α/3;符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 人口学特征、既往病史、首发症状 三组患者性别、心脑血管慢性疾病(除高血压外)发生率、呼吸系统慢性疾病发生率、消化系统慢性疾病发生率、泌尿系统慢性疾病发生率、有其他病史者所占比例及首发症状为发热、咳嗽、乏力、腹泻、食欲不振、鼻塞流涕、咽痛者所占比例比较,差异无统计学意义(P>0.05);三组患者年龄、高血压发生率、2型糖尿病发生率、无既往病史者所占比例及首发症状为胸闷、呼吸困难者所占比例比较,差异有统计学意义(P<0.05)。重型组和危重型组患者年龄大于普通型组,高血压、2型糖尿病发生率及首发症状为胸闷、呼吸困难者所占比例高于普通型组,差异有统计学意义(P<0.05,见表1)。

表1 三组患者人口学特征、既往病史、首发症状比较Table 1 Comparison of demographic characteristics,previous history and initial appearance in the three groups
2.2 实验室检查指标 三组患者WBC、PLT、Neu%、Lym%、Neu、Lym、IL-6、CRP及PCT比较,差异有统计学意义(P<0.05);危重型组患者WBC、Neu%、Neu、IL-6、CRP及PCT高于普通型组和重型组,Lym%及Lym低于普通型组和重型组,差异有统计学意义(P<0.05);重型组患者WBC、PLT、Neu%高于普通型组,Lym%低于普通型组,差异有统计学意义(P<0.05,见表2)。
2.3 发病至入院时间、核酸检测情况 本组患者入院前(门诊、社区/酒店隔离点、方舱医院等)核酸检测阳性但入院后核酸检测阴性者31例,住院期间平均核酸检测次数为2.8次。三组患者发病至入院时间、核酸检测次数及核酸检测结果比较,差异均无统计学意义(P>0.05,见表3)。
2.4 抗体检测情况 武汉市第一医院自2020-03-05开始进行抗体定性检测。普通型组患者发病至抗体检测时间为(30.7±10.2)d,重型组为(34.1±8.3)d,危重型组为(33.4±7.5)d;三组患者发病至抗体检测时间比较,差异无统计学意义(F=3.312,P=0.161)。3例(占0.7%)患者前后两次检测IgM、IgG抗体均为阴性,其余409例(占99.3%)患者IgM/IgG抗体阳性;IgM、IgG抗体双阳性者最多,为217例(52.7%),其次为IgM阴性、IgG阳性者,为160例(占38.8%),详见表4。
表2 三组患者实验室检查指标比较(±s)Table 2 Comparison of laboratory examination results in the three groups

表2 三组患者实验室检查指标比较(±s)Table 2 Comparison of laboratory examination results in the three groups
注:WBC=白细胞计数〔参考范围为(3.50~9.50)×109/L〕,PLT=血小板计数〔参考范围为(125~350)×109/L〕,Neu%=中性粒细胞百分比(参考范围为40.0%~75.0%),Lym%=淋巴细胞百分比(参考范围为20.0%~50.0%),Neu=中性粒细胞计数〔参考范围为(1.8~6.3)×109/L〕,Lym=淋巴细胞计数〔参考范围为(1.1~3.2)×109/L〕,IL-6=白介素6(参考范围为0~7.00 ng/L),CRP=C反应蛋白(参考范围为0~5.00 mg/L),PCT=降钙素原(参考范围为0~0.50 μg/L);与普通型组比较,aP<0.05;与重型组比较,bP<0.05
(×109/L)PLT(×109/L)Neu%(%)Lym%(%)Neu(×109/L)Lym(×109/L)IL-6(ng/L)CRP(mg/L)PCT(μg/L)普通型组 111 5.67±1.55 229±68 55.1±9.2 32.4±8.8 3.2±1.1 1.8±0.6 2.83±1.09 3.66±1.59 0.05±0.01重型组 254 6.40±2.42a 266±99a 61.0±11.8a 25.7±9.8a 4.0±2.1 1.6±0.6 4.35±1.92 11.89±2.37 0.07±0.01危重型组 47 8.17±3.05ab 238±108 74.8±12.9ab 15.5±9.6ab 6.7±3.1ab 1.1±0.5ab 96.42±11.34ab 63.16±25.78ab 0.79±0.05ab F值 14.096 4.992 36.263 38.732 36.301 15.444 12.517 60.189 32.956 P 值 <0.001 0.007 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001组别 例数 WBC

表3 三组患者发病至入院时间、核酸检测次数及核酸检测结果比较Table 3 Comparison of time from onset to admission,times and results of nucleic acid detection in the three groups

表4 三组患者核酸、特异性抗体检测情况(例)Table 4 Detection of nucleic acid and specific antibody in the three groups
2.5 临床治疗情况及预后 本组患者主要采用中药方剂(由武汉市第一医院中医专家组会诊后开具中药方剂)及抗病毒治疗,分别为412例(占100.0%)、403例(占97.8%),其次为抗细菌治疗243例(占59.0%)、糖皮质激素治疗73例(占17.7%);氧疗措施中以鼻导管/面罩吸氧为主,为243例(占59.0%)。截至2020-03-18,本组患者好转/治愈出院322例(78.2%)、转往其他定点医院83例(占20.1%)、死亡7例(占1.7%),见表5。
3 讨论
本组患者中重型/危重型COVID-19者共301例(占73.1%),分析其原因主要为普通型COVID-19患者多收治于方舱医院,因此入住武汉市第一医院的多为重型/危重型COVID-19患者。本研究结果显示,重型组和危重型组患者年龄大于普通型组,高血压、2型糖尿病发生率及首发症状为胸闷、呼吸困难者所占比例高于普通型组,提示高龄患者,尤其是合并高血压、2型糖尿病者更易进展为重型/危重型COVID-19,与既往研究结果相一致[5-7],且重型/危重型COVID-19患者首发症状为胸闷、呼吸困难的比例较高[8]。
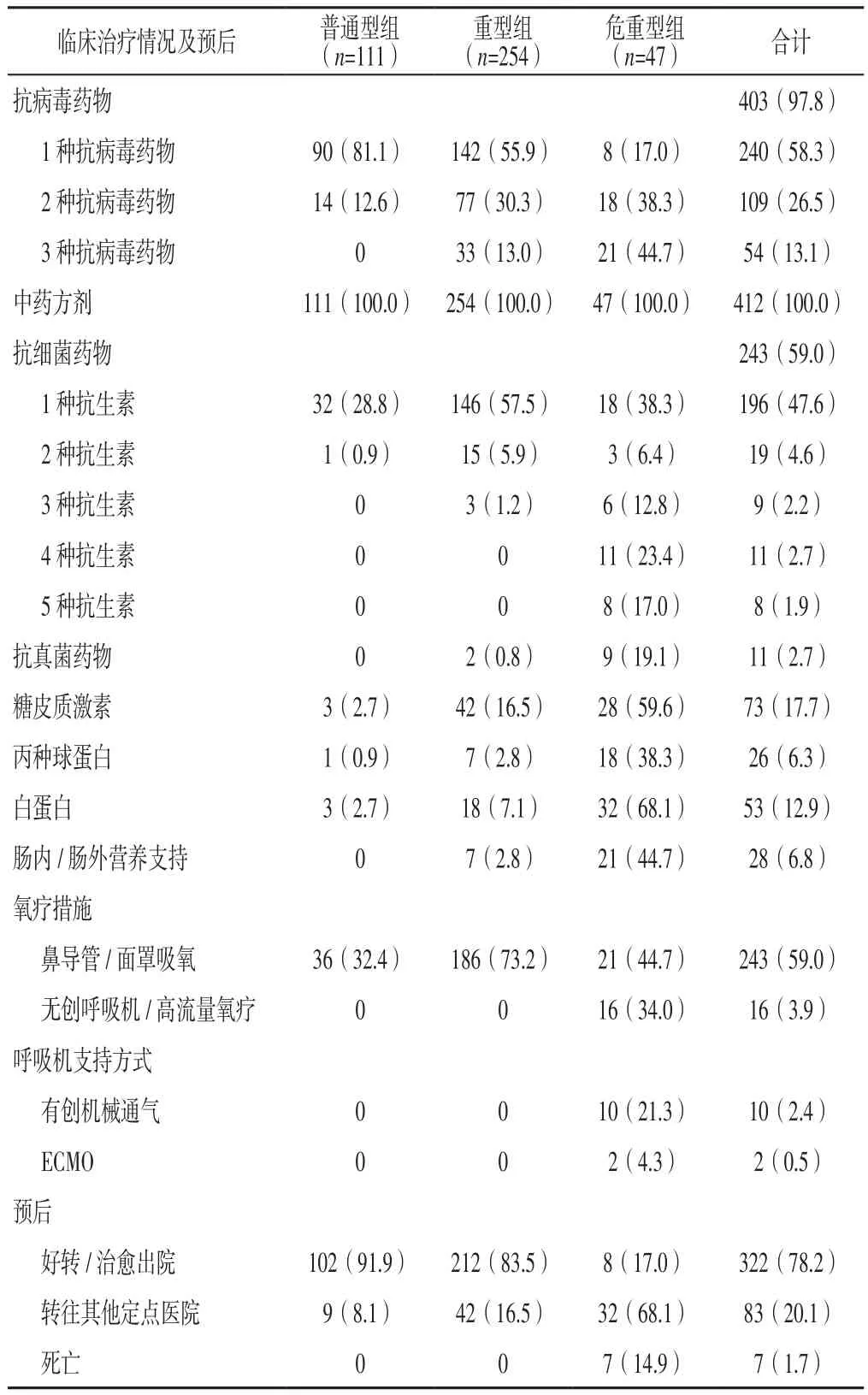
表5 412例患者临床治疗情况及预后〔n(%)〕Table 5 Clinical treatment and prognosis of 412 patients
本研究结果还显示,危重型组患者WBC、Neu%、Neu、IL-6、CRP及PCT高于普通型组和重型组,Lym%及Lym低于普通型组和重型组;重型组患者WBC、PLT、Neu%高于普通型组,Lym%低于普通型组,提示随着COVID-19病情加重,患者外周血WBC、Neu%逐渐升高,Lym%逐渐降低,且炎性反应程度加重,与既往研究结果一致[9-10],但其具体机制有待进一步研究阐明。
SARS-CoV-2是由RNA核酸和蛋白质等组成,蛋白衣壳将RNA包裹起来,加上一层由脂质和糖蛋白组成的包膜,从而使RNA不易被降解[11]。研究表明,SARS-CoV-2通过细胞表面的血管紧张素转换酶2(angiotensin converting enzymeⅡ,ACE2)受体入侵细胞而导致机体感染,并利用宿主细胞进行复制、增殖[12],因此临床上通过采集人体特定部位细胞标本并检测其是否含有病毒RNA核酸,就可以明确机体是否受到SARS-CoV-2感染。但在临床实际操作过程中,因采样部位、采集标本过程、试剂盒质量、核酸检测实验室质量等多方面原因,使得早期根据流行病学特征、临床症状、肺部影像学检查结果等证据高度疑似的COVID-19患者,多次SARS-CoV-2核酸检测均为阴性[13]。特异性抗体是机体感染病毒后免疫应答的产物,故检测特异性抗体可明确患者是否近期或既往感染过相应病毒,有助于核酸检测阴性但临床上疑似患者的确诊,且抗体检测对临床标本的留取、实验室操作要求相对较低。因此,SARS-CoV-2特异性抗体检测试剂盒的及时出现可作为核酸检测的有效补充。本研究412例患者中,SARS-CoV-2核酸检测阳性175例,阳性率为42.5%;IgM/IgG抗体阳性409例,阳性率为99.3%;另外3例患者IgM、IgG抗体均为阴性,但其核酸检测均为阳性,结合病史考虑患者检测抗体时可能不在感染“窗口期”,或可能存在其他未被发现的疾病而导致机体不能产生抗体,或抗体检测试剂盒质量等原因[14]。249例(60.4%)患者IgM抗体阳性,377例(91.5%)患者IgG抗体阳性,符合病毒感染后机体免疫抗体产生的一般规律,与既往研究结果一致[15]。但需要注意的是,抗体检测时血标本留取需要排除溶血情况,以免抗体检测出现“假阳性”结果[16]。总体而言,补充SARSCoV-2特异性抗体检测能提高COVID-19确诊率,且依据IgM和IgG抗体检测结果、临床表现及核酸检测结果可以判断患者病程处于感染潜伏期、窗口期、急性期或恢复期,有利于早期识别COVID-19患者并尽早隔离、治疗。但本组大部分患者开始进行SARS-CoV-2特异性抗体定性检测时,病程已有1个月或更长时间,因此无法分析COVID-19发病超早期抗体情况及发病过程中抗体动态演进过程。本研究结果显示,截至2020-03-18,本组患者好转/治愈出院322例(78.2%)、转往其他定点医院83例(占20.1%)、死亡7例(占1.7%)。该时期因全国各省市医疗队支援,医疗资源较前期相对充足,故患者能得到及时、有效的治疗,大部分危重型COVID-19患者能好转/治愈出院,病死率较前期亦有明显下降。
综上所述,高龄患者,尤其是合并高血压、2型糖尿病者更易进展为重型/危重型COVID-19;重型/危重型COVID-19患者Lym%及Lym明显降低,IL-6明显升高,故动态监测淋巴细胞及IL-6可预测患者病情严重程度;本组患者核酸检测阳性率为42.5%,而联合检测特异性抗体IgM/IgG可提高COVID-19确诊率。
作者贡献:杨秀红、范学朋进行文章的构思与设计;杨秀红、熊蓉、余芳进行研究的实施与可行性分析;杨秀红、熊蓉、胡述立进行数据收集、整理、分析;杨秀红、胡述立进行结果分析与解释;杨秀红负责撰写论文;范学朋进行论文的修订,负责文章的质量控制及审校;余芳对文章整体负责,监督管理。
本文无利益冲突。

