大肠杆菌与肠道沙门菌混合感染朗德鹅的诊断分析
兰仕梅,王方国,2,张晓亮,袁婷,3,陈胜利,储岳峰*
(1.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046;2.四川农业大学动物医学院,四川 成都 610000;3.石河子大学动物科技学院,新疆 石河子 832001)
朗德鹅,又名西南灰鹅,原产于法国西部,世界著名肥肝生产的优秀品种[1]。因该品种鹅的肥肝营养丰富,质地细腻,味道独特,被誉为“世界绿色食品之王”。尽管集约化养殖得到全面推广,但传染病仍是制约其发展的重大因素。大肠杆菌和肠道沙门菌是典型的人畜共患病原菌,是引起食源性疾病暴发的常见病原体,严重威胁着世界各国公共卫生安全,同时也是造成幼畜禽大批死亡,影响其健康生长和产品质量的重要细菌性传染病病原体[2-4]。因大肠杆菌和沙门菌血清型众多,针对性的疫苗研制和防控非常困难,往往采取药物防治方法,但目前严重的多重耐药性问题给养殖场造成了巨大的防控困难。本试验从暴发雏鹅急性死亡的朗德鹅养殖场中患有腹泻、精神萎靡等症状的发病朗德鹅幼雏组织上分离鉴定出1株肠道沙门菌和2株大肠杆菌,并进一步对分离株进行了小鼠致病性试验和药物敏感性试验,为兽医临床防控朗德鹅大肠杆菌和沙门菌引起的混合感染提供参考资料。
1 材料与方法
1.1 病料来源
2019年6月,兰州市某朗德鹅养殖场9日龄雏鹅大批出现腹泻、急性死亡等症状,3日内约40%雏鹅死亡,未死亡雏鹅主要表现为腹泻、呼吸急促、精神萎靡、不食、扎堆、被毛杂乱。该场将未死亡雏鹅(12日龄)送至实验室进行剖检观察,并采集心脏、肝脏、肾脏等组织进行病原分离鉴定。
1.2 主要试剂
胰蛋白胨大豆琼脂(TSA)培养基(青岛高科技工业园海博生物技术有限公司),营养肉汤(青岛高科技工业园海博生物技术有限公司),水解酪蛋白(MH)培养基(青岛高科技工业园海博生物技术有限公司),麦康凯培养基(青岛高科技工业园海博生物技术有限公司),伊红美蓝培养基(青岛高科技工业园海博生物技术有限公司),药敏纸片(杭州滨河微生物有限公司),细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司),EmeraldAmp®MAX PCR Master Mix(宝生物工程(大连)有限公司),DNA Marker DL2000(宝生物工程(大连)有限公司),琼脂糖(生工生物工程(上海)股份有限公司)。
1.3 实验动物
清洁级昆明小鼠12只,体重为(20 ± 2)g,由兰州兽医研究所实验动物中心提供。
1.4 剖检观察和细菌分离纯化
对病雏鹅进行剖检观察并记录,采集心脏、肝脏、肾脏等组织样划线接种于TSA培养基、麦康凯培养基、伊红美蓝培养基,37 ℃ 培养16~24 h,挑取单菌落进一步纯化培养,然后对纯化菌落进行革兰染色,镜检观察。
1.5 细菌16S rRNA扩增测序
取上述纯化菌落接种于营养肉汤中培养,按照细菌基因组DNA提取试剂盒说明书提取培养物基因组作为模板,以细菌16S rRNA基因通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′)扩增分离株 16S rRNA基因[5],引物由西安擎科泽西生物科技有限责任公司合成。
PCR反应体系:总反应体积为25 μL,PCR Master Mix 12.5 μL,上下游引物各1 μL,模板2 μL,ddH2O 8.5 μL。反应程序:94 ℃预变性 5 min;94 ℃变性 30 s,54 ℃退火30 s,72 ℃延伸45 s,共 35个循环;72 ℃最后延伸 10 min,4 ℃保存。反应结束后,将PCR扩增产物进行1%琼脂糖凝胶电泳,并按照DNA胶回收试剂盒说明书进行切胶回收,送西安擎科泽西生物科技有限责任公司进行测序。
1.6 16S rRNA基因同源性分析和系统发育树的构建
将分离菌的16S rRNA基因测序结果提交至NCBI,进行BLAST比对,下载GenBank中相关序列,利用MEGA 7软件进行系统发育树的构建。
1.7 小鼠致病性试验
将纯化的分离菌接种到营养肉汤中培养16~24 h,采用紫外分光光度计测定菌液OD600值并调整至1,此时菌液浓度约为1~1.5×108CFU/mL,将12只小鼠随机分成4组,每组3只,试验组(Ⅰ~Ⅲ组)腹腔注射3株不同菌液各0.25 mL,对照组腹腔注射等量生理盐水,观察小鼠临床症状、死亡情况和病理变化并记录。
1.8 抗菌药物敏感性试验
参照文献[6]的抗菌药物敏感性试验纸片法执行标准以及文献[7-8]进行结果评判。从TSA琼脂培养基中挑取纯化培养物3~5个菌落接种到营养肉汤中培养2~6 h,采用紫外分光光度计测定菌液OD600值并调整至1,此时菌液浓度约为1~1.5×108CFU/mL,采用无菌棉签均匀涂布至MH平板上,取药敏纸片放置在平板上,37 ℃ 培养16~24 h后测定抑菌圈直径。
2 结果与分析
2.1 病理观察
剖检雏鹅可见心包、肝表面、肋骨以及后肢大腿肌肉上均附着大量纤维素性渗出液,心包浑浊,有积液,呈现纤维素性心包炎,胆囊肿大,肝表面覆盖着一层灰白色纤维素膜状物。
2.2 细菌分离培养和形态学观察
分离菌在伊红美兰培养基上呈现2种菌落,一种黑色带金属光泽,另外一种为透明无色菌落;在麦康凯培养基上生长分别为粉红色不透明和无色半透明菌落;在TSA培养基上生长均为半透明灰白色菌落。革兰染色结果显示所有菌株为阴性杆菌,无芽胞。
2.3 16S rRNA测序结果和系统进化树构建
将16S rRNA测序结果上传NCBI,经BLAST分析后,结果1株为肠道沙门菌,命名为19129株;2株为大肠杆菌,分别命名为T19130株和T19131株。从基于16S rRNA 序列所构建的NJ系统发育树可知,以3株大肠杆菌标准菌株的16S rRNA序列作为外类群可将进化树分为3个组群,其中本次分离19129株与肠道沙门菌双相亚利桑那亚种聚为簇2,表明可能为肠道沙门菌双相亚利桑那亚种,与猪源肠道沙门菌JQ975904菌株表现出较高的同源性(图1)。图2以肺炎克雷伯菌(Klebsiellapneumoniae)作为外类群可将进化树分为2个组群,其中本次分离株T19130和T19131与大肠杆菌聚为簇1,表明分离株为大肠杆菌。其中T19131与人源菌株CP008697同源性较高,而T19130则表现出与鸭源菌株JX267124具有较高的同源性。
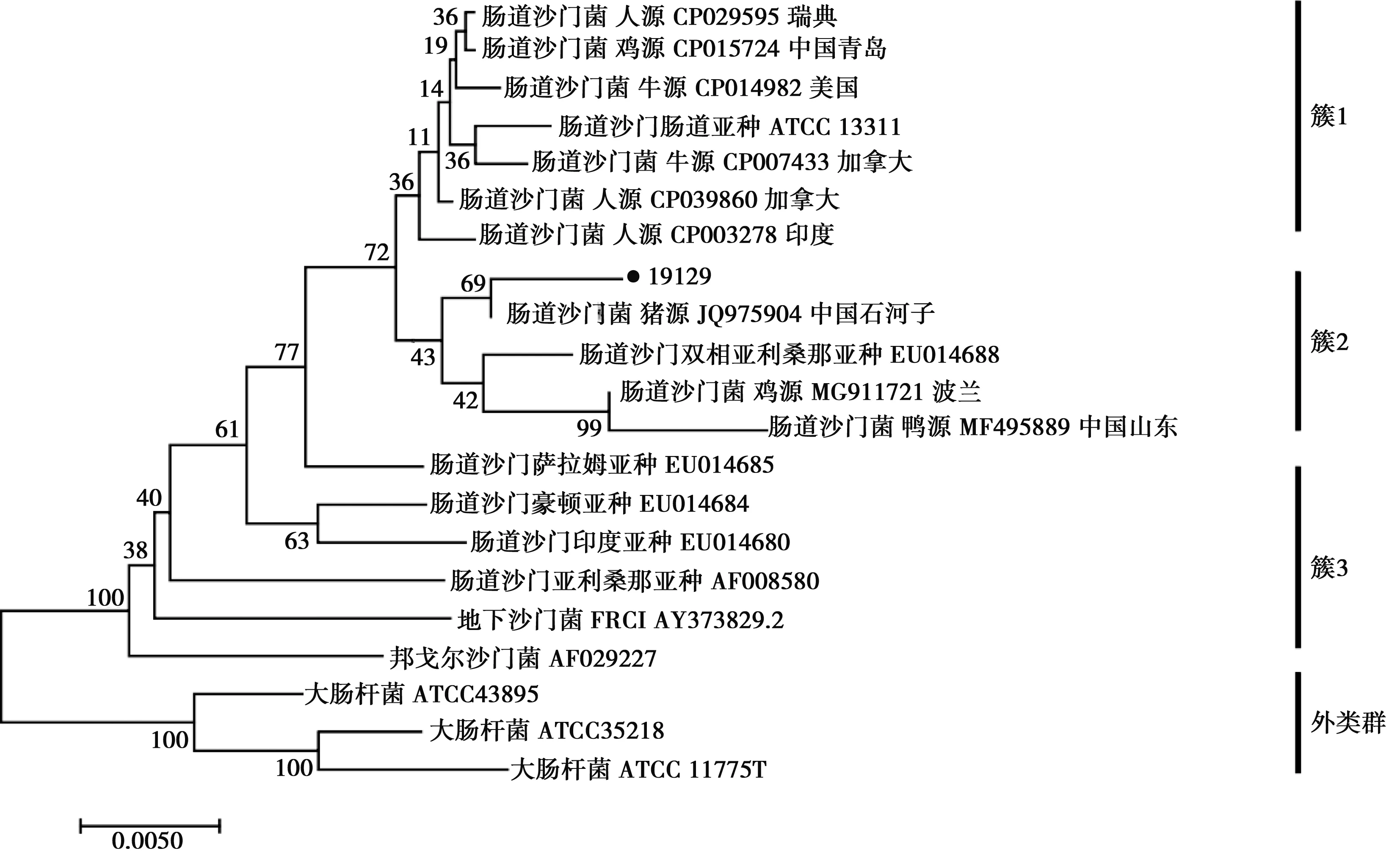
•本试验分离菌株

•本试验分离菌株
2.4 致病性试验
接种细菌12 h后,菌株19129、T19130和T19131攻毒小鼠皆表现为精神沉郁、蜷缩在一角,目光呆滞,不采食,16 h后开始出现死亡,1周内死亡数量分别为2、2和1只,死亡率分别为66.7%、66.7%和33.3%。剖检小鼠,急性死亡小鼠未见明显病理变化,其余发病和死亡小鼠心包、肝表面附着有大量纤维素性渗出液,取肝脏和心脏等组织可分离出病原菌。对照组小鼠表现正常。
2.5 药敏试验
由表1可知,从雏鹅病变组织上分离出的3株细菌对诺氟沙星、阿莫西林、氨苄西林、环丙沙星、强力霉素等耐药;3株分离菌对呋喃唑酮、复方新诺明、多黏菌素B敏感;除此之外,T19130和T19131菌株对美罗培南、大观霉素药物敏感。
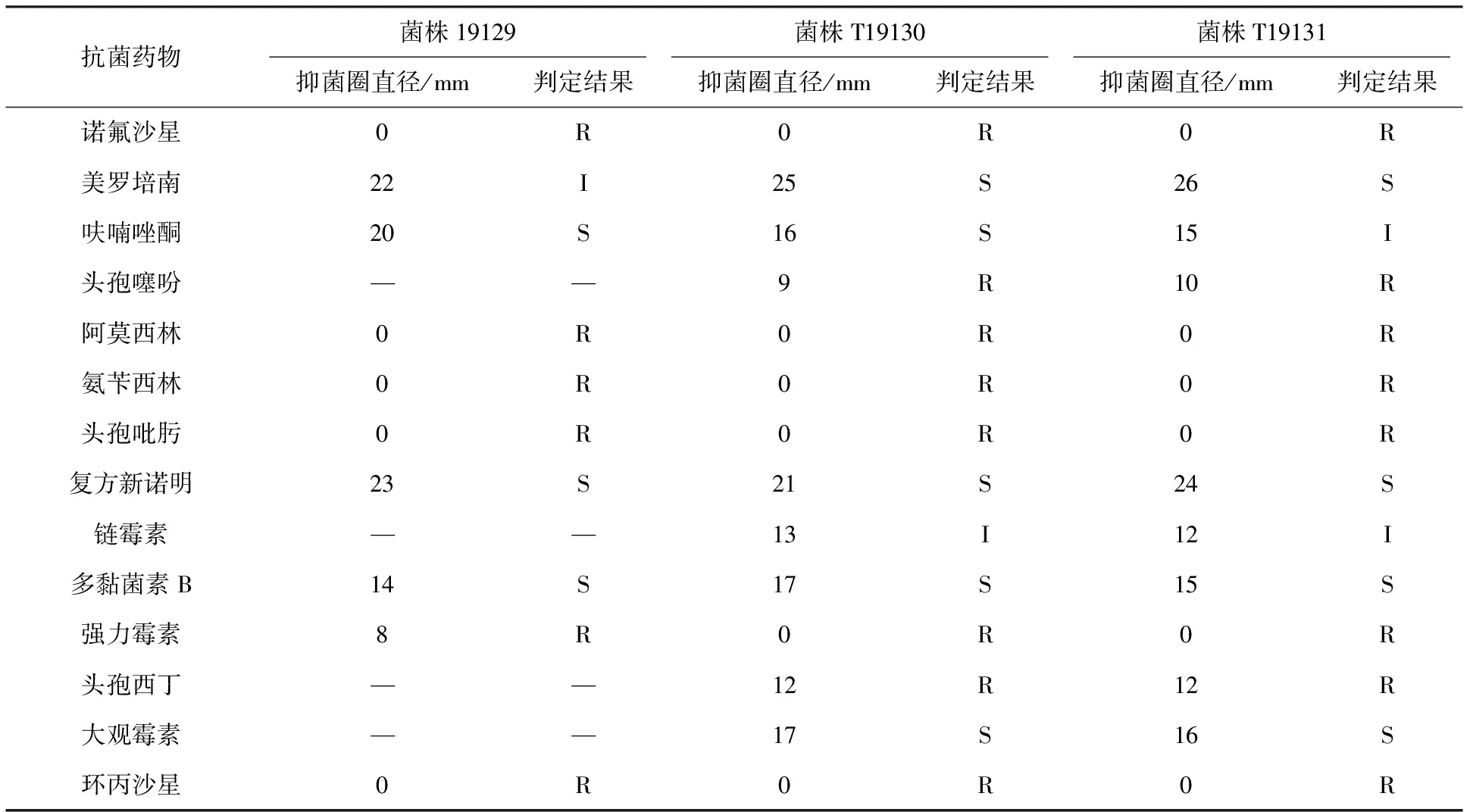
表1 分离菌药物敏感性试验结果
3 讨论
家禽养殖发展一直以来就极易受到各种传染病的制约,其中大肠杆菌和沙门菌是危害养禽业最主要的细菌性病原[9],往往造成大批家禽死亡,或是造成弱雏影响生产效益,而目前难以解决的耐药性问题使得禽大肠杆菌病和沙门菌病难以防控。
禽大肠杆菌病每年都会给全球养禽业造成重大的经济损失[10],其病原为禽致病性大肠杆菌(avian pathogenicE.coli,APEC),是人源肠外致病性大肠杆菌毒力基因的潜在贮存宿主。沙门菌中包括鸡白痢沙门菌、鸡伤寒沙门菌以及其他有鞭毛能运动的沙门菌是禽沙门菌病的三大病原菌[11],其中引起禽副伤寒的沙门菌包括肠道沙门菌等能感染其他动物并能通过受感染的产品传播给人类,引起人沙门菌感染和食物中毒,因此具有重要的公共卫生意义[12-14]。本试验从该场患病朗德鹅上分离出1株肠道沙门菌和2株大肠杆菌,接种小鼠出现了明显的临床症状和死亡,并从发病或死亡小鼠心脏和肝脏等组织中分离到病原菌,证实了分离株的毒力,这表明本次鹅场暴发的致死性雏鹅疫病是由大肠杆菌和肠道沙门菌混合感染所致。另外,通过对分离株16S rRNA序列进化分析表明,分离株可能存在着感染猪和人的潜在公共卫生风险。
大肠杆菌和沙门菌混合感染畜禽比较普遍,混合感染加重病情并升高了死亡率,也导致临床诊断和防治的困难。从药敏试验结果可知分离菌株存在严重的多重耐药性问题,李琳等[15]报道了130株鸡源大肠杆菌中有90.8%的菌株是多重耐药菌株;陈春林等[16]对重庆地区养鸡场大肠杆菌、沙门菌的耐药情况进行了试验,结果发现110株大肠杆菌中80.0%为多重耐药株,8株沙门菌中100%为多重耐药株。彭峻烽等[17]对成都鸭屠宰生产污染沙门菌耐药状况调查,发现99株沙门菌中多重耐药率达47.47%。尽管当前防治细菌性传染病,抗菌药物仍然是首选工具之一,但多地报告的禽源大肠杆菌和沙门菌耐药情况,已显示出当前我国养禽业利用抗菌药物来防控禽大肠杆菌病和沙门菌病的状况十分不乐观。实际上,细菌可通过天然克隆与表达系统,即整合子-基因盒将耐药基因传递或捕获外源耐药基因,造成细菌耐药性的传播,食源性途径是耐药菌株(包括其耐药基因)由动物到人的主要传播途径,这将对动物疾病的防控以及公共卫生安全形成潜在威胁[18-20]。
为应对细菌耐药性这样的全球性公共卫生问题,目前国家已经出台了《全国遏制动物源细菌耐药行动计划(2017—2020)年》[21],其目的就是为了有效应对动物源细菌耐药挑战,提高兽用抗菌药物科学管理水平,保障养殖业生产安全、食品安全、公共卫生安全和生态安全,保障人民群众身体健康。从此次朗德鹅大肠杆菌和沙门菌混合感染及病原多重耐药可以看到,细菌性传染病的防治仍任重道远,科学饲养管理、合理用药以及“减抗”技术如细菌疫苗研制仍需继续加强。

