利用代谢组技术研究南林895杨响应盐胁迫的生理代谢机制
廖杨文科 崔荣荣 魏子涵 陈 颖
(南京林业大学南方现代林业协同创新中心/南京林业大学生物与环境学院,江苏 南京 210037)
盐渍土含高浓度可溶性盐(主要是NaCl),导致生长在其中的植物水分补给障碍,成为限制全世界农业生产的一大难题[1]。为提高农业生产效率和土壤利用率,研究植物的耐盐机制以及广泛种植耐盐品种,对于农林业十分有必要。
植物在与盐胁迫环境的长期互作中,进化出一套包含多种方式和不同层次的响应机制。盐渍土会引发植物细胞离子失衡、吸水障碍,使植物细胞能快速合成小分子渗透调节物质,如糖类(蔗糖、棉子糖、水苏糖、甘露糖等)、氨基酸(脯氨酸、甘氨酸等)及其衍生物(甜菜碱等)[2-3],以维持低水势和水分平衡。盐胁迫造成的活性氧堆积,激发植物细胞抗氧化系统,包括抗氧化酶系统(超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶等)[4-5]和非酶系统(还原型谷胱甘肽、抗坏血酸、类黄酮、类胡萝卜素等)[6-7]。前人研究证实盐胁迫下植物呼吸作用各阶段相互整合协作,在碳代谢、产能、组织生长、离子外排、渗透调节物质合成、清除活性氧等方面的胁迫响应中有重要作用[8]。而植物激素,如脱落酸[9]、乙烯[10]、多胺[11]、油菜素甾醇类[12]等,通过信号转导途径(如受体激活、抑制子降解、转录因子调控等)互作参与调控植物耐盐性。此外还有一些参与植物耐盐响应多条途径的信号物质,如NO[13]、褪黑素[14]、H2S[15]等。然而,物种间耐盐机制的差异,不同耐盐响应信号的互作方式,目前尚不清楚。
近年来,杨树(PopulusL.)作为一种拥有高生物量的速生树种,因其遗传多样性、分布广泛性以及分子生物学手段的可适性,被确立为树木研究的模式植物[16-17]。大部分关于杨树耐盐机制的研究集中在起源于我国西北盐渍区的具有极强耐盐性的胡杨(Populus euphratica)上[18]。美洲黑杨(P. deltoids)及其杂交后代是我国长江中下游主要造林树种,尤其是江苏和湖北两省。但江苏北部沿海土壤盐渍化成为限制南方杨树栽培发展的重要问题[19]。因此,美洲黑杨及其后代的耐盐性及盐胁迫响应机制应得到足够重视。
代谢组学是一项颇具前景的新兴方法学[20]。代谢产物是细胞调控过程的终产物,其水平可被视作机体对遗传或环境变化的最终响应结果[21]。该方法能反映机体与环境的互作情况,且能检测到更多代谢水平的直接变化。目前已有大量研究涉及到众多物种对盐胁迫的代谢响应,包括大麦 (Hordeum spontaneum)[22-23]、大 豆(Glycine soja)[24-25]、棉花(Gossypium hirsutum)[26],以及杨属(Populus)的个别种[27]。代谢组学研究的分析手段包括核磁共振谱(nuclear paramagnetic resonance,NMR)、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)和液相色谱-质谱 (liquid chromatography-mass spectrography,LC-MS)等技术。其中,超高效液相色谱-四极杆-飞行时间质谱(ultra performance liquid chromatography coupled with tandemquadrupole time-offlight mass spectrometry,UHPLC-QTOF-MS)技术具有时间短、高分辨率、高灵敏度等优势,常用于分析研究代谢物变化。
本研究基于UHPLC-QTOF-MS 技术的植物代谢组学方法,对盐胁迫(100 mmol·L-1NaCl)下具有中等耐盐性的美洲黑杨无性系后代南林895 杨[P. deltoidesBart.CV. xPopulus euramericana(Dode) Guineir CV]叶片的整体代谢物变化进行分析,并采用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术对差异代谢通路关键基因表达进行检测,旨在深入了解木本植物适应盐胁迫的机理。
1 材料与方法
1.1 试验材料
南林895 杨无菌苗,由南林895 杨无性系苗木茎段快繁所得。
1.2 试验方法
供试材料的培养及处理参考陈颖等[28]的方法并略作改进。取南林895 杨无菌苗1 cm 茎段于MS 固体培养基{含6-苄氨基嘌呤[N-(phenylmethyl)-9Hpurin - 6-amine,6-BA] 0.2 mg·L-1、萘乙酸(1-naphthylacetic acid,NAA) 0.02 mg·L-1、噻苯隆(thidiazuron,TDZ)0.002 mg·L-1和蔗糖25 g·L-1}进行丛生芽诱导培养。培养条件: 光照强度 55 μmol·m-2s-1、光周期16 h 光照/8 h 黑暗、相对湿度60%和温度周期23℃/23℃。每个茎段可获得15 ~16个芽,待丛生芽长至2 cm 以上,剪取单芽转入1/2 MS半固体培养基(含6-BA 0.2 mg·L-1、NAA 0.02 mg·L-1、TDZ 0.002 mg·L-1和蔗糖25 g·L-1、0.4%琼脂,pH 值5.8)生长成苗,期间继代1 次。待苗高达5~6 cm 时,进行盐胁迫处理。
将100 mmol·L-1NaCl 加入1/2 MS 半固体培养基,然后120℃高压灭菌20 min 备用。选择生长良好、长势一致的苗插入含上述培养基的组培瓶中,每瓶2棵苗,每处理10 棵苗。盐处理后16 d,测定杨树株高、根长(主根最长处),并对其中部成熟叶及根系进行随机取样,用于生理指标测定、RNA 提取和代谢组分析。代谢组分析为6 个生物学重复,其他检测为4 个生物学重复。
1.3 膜脂过氧化程度检测
以丙二醛(malondialdehyde,MDA)含量作为指标,测定方法参考文献[29]。称取0.3 g 叶片或根冻样,用冰浴过的3 mL 0.1%(w/v)三氯乙酸(trichloroacetic acid,TCA)研磨,12 000×g离心20 min,保留上清液。采用硫代巴比妥酸(thiobarbituric acid,TBA)反应测定MDA 含量:取1 mL 20%(w/v)TCA 反应液[含0.5%(w/v)TBA],加入1 mL 上述上清液中,沸水浴30 min后迅速冰浴终止反应,然后12 000×g离心10 min,保留上清液并于450、532、600 nm 波长处测定其吸光度值。按照公式计算MDA 含量:
MDA 含量(μmol·L-1·g-1FW)=[6.45×(A532-A600)-0.56×A450]×3/0.3
1.4 UHPLC-QTOF-MS 分析的样品制备及测定条件
1.4.1 样品制备 将0.2 g 叶片冻样置于2 mL 离心管中,加入1 000 μL 提取液(甲醇∶乙腈∶水=2∶2∶1)和20 μL 核糖醇,涡旋后研磨4 min,45 Hz 超声提取15 min,-20℃静置1 h,然后于4℃、13 000 r·min-1条件下离心15 min,保留上清液。取0.4 mL 上述上清液,经真空干燥后加入1 000 μL 提取液(乙腈∶水=1∶1,v∶v)复溶,再于4℃、12 000 r·min-1条件下离心15 min,所得上清液稀释10 倍后取60 μL,备检。
1.4.2 色谱条件 UHPLC 方法参考文献[30]。色谱柱为Kinetex C18(100 mm×2.1 mm,1.7 μm),乙腈-水(50∶50,v∶v 含0.1%甲酸,A)-乙腈∶水(2∶98,v∶v 0.1%甲酸,B)为流动相,以体积流量0.4 mL·min-1进行梯度洗脱:0~2 min,88%B;2~4 min,88%→75%B;4~10 min,75%→70%B;10 ~15 min,70%→64%B;15 ~20 min,64%→0%B,检测波长326 nm,柱温40℃,进样量3.0 μL。
1.4.3 质谱条件 LC-MS 方法参考文献[30]并加以改进。以氮气作为雾化、锥孔气;电喷雾电离:正离子模式&负离子模式(ESI+& ESI-);飞行管检测模式W型;毛细管电压3.6 kV;锥孔电压30 V;萃取锥孔4 V;源温120℃;脱溶剂气温度300℃;反向锥孔气流100 L·h-1; 脱溶剂气流600 L·h-1;扫描时间1 s;扫描时间间隔0.015 s;质荷比范围m/z 80~1 200 Da;数据采集形式centroid;灵敏性normal;动态范围extended。UHPLC-QTOF-MS 平台的电离源为电喷雾电离,有正离子模式(positive ion mode,POS) 和负离子模式(negative ion mode,NEG)2 种电离方式,检测代谢组时结合使用提高使代谢物覆盖率,检测效果更好,后续对2 种模式的数据分别进行分析。
1.4.4 数据处理 数据处理方法参考文献[30]并加以改进。数据预处理采用UHPLC-QTOF-MS 系统操作软件MassLynx V4.1 中的MarkerLynx 软件包,该软件包能够自动完成谱峰识别、滤噪等前处理程序,处理参数设置如下:时间范围0 ~21 min;质量范围80 ~1 200 Da;质量偏差0.01;最小强度1%;质量窗0.02 Da;保留时间窗口0.20 min;消除噪音水平6;变化峰强度阈值300。最后输出由保留时间、精确质荷比和峰面积组成的三维矩阵。
多元统计分析采用SIMCA(v14.1,MKS Data Analytics Solutions,Umea,Sweden)软件,先进行主成分分析(principal component analysis,PCA)识别数据模式,以及判定数据轮廓各组间的分离情况[31-32]。使用正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)过滤代谢物中与分类变量不相关的正交变量,并分别分析非正交变量和正交变量[33]。然后,进行OPLS-DA 置换检测(评估模型统计显著性的重要步骤):随机改变分类变量Y排列的顺序、多次建立对应的OPLS-DA 模型以得到R2和Q2值[34]。再将差异代谢物在KEGG pathway 数据库中进行映射,取KEGG compound ID 进行后续分析,整理出差异代谢物映射的所有通路;综合分析差异代谢物所在通路(包括拓扑和富集分析),进一步筛选并找到与代谢物差异相关性最高的通路,结果以气泡图展示[34]。最后,将受盐胁迫影响显著的差异代谢途径中的关键差异代谢物进行映射作图。
1.5 RNA 提取和反转录及RT-qPCR
总RNA 提取采用Trizol[天根生化科技(北京)有限公司] 试剂盒。总RNA 逆转录为cDNA(日本TOYOBO 公司试剂盒)后,检测基因表达量。杨树基因序列从Populus trichocarpaV 3.0 获得(https:/ /phytozome.jgi.doe.gov/pz/portal.html#! info? alias =Org_Ptrichocarpa),引物设计如表1所示。RT-qPCR 扩增使用ABI Step One 实时定量PCR 系统以及南京诺唯赞生物科技有限公司的SYBR Green PCR Master Mix试剂盒,以18S 核糖体DNA(rDNA)为内参基因,基因相对表达量计算参照文献[35]。
1.6 数据统计分析
统计数据为均值±标准偏差,并采用SPSS 19.0 软件进行方差分析,两组间比较采用t检测,P<0.05 为差异显著。
2 结果与分析
2.1 南林895 杨生长情况和叶片MDA 含量
与对照相比,盐胁迫16 d 后的植株叶片轻微变黄(图1),株高和根长分别下降18.7%和54.7%(图2-A)。但未显著改变杨树叶片和根系中MDA 含量(图2-B),说明南林895 杨具有一定的耐盐能力。

图1 盐处理16 d 对南林895 杨生长表型的影响Fig.1 Effect of 16-day salt stress on the growth performance of Nanlin 895
2.2 南林895 杨响应盐胁迫的差异代谢物和基因表达谱分析
采用UHPLC-QTOF-MS 分析盐处理与对照组的叶片样品,正、负离子模式下的主成分分析(principal component analysis,PCA)均显示对照组与盐胁迫组在主成分(principal component,PC)[1]方向区分明显,表明两者的化学组成存在显著差异,该分析技术能将不同处理区分开(图3-A、B)。本研究使用SIMACA(V14.1,MKS Data Analytics Solutions,Umea,Sweden)软件对数据进行对数转换加UV 格式化(Unit Variance Scaling)处理,结果显示,正、负离子模式下,盐处理和对照组样本都可以明显区分开。R2和Q2在正离子模式下分别为0.89 和0.83(图3-D),负离子模式下则分别为0.87 和0.86(图3-C),R2接近1,说明模型符合样本数据真实情况。同时随着置换保留度逐渐降低,置换的Y 变量比例增大,随机模型的R2和Q2下降,说明原模型不存在过拟合现象,模式稳健性良好(过拟合的R2和Q2基本保持不变)[31-32]。本研究主要依据OPLS-DA 模式分析的第一主成分变量投影重要度(VIP>1),结合t检测的P值(P<0.05)以及碎片匹配度[取值于(0,1),similarity>0.6]筛选差异代谢物。正、负离子模式下共鉴定出115 种差异代谢物,如表2所示(仅列出差异部分重要代谢物,共67 个)。

表1 RT-qPCR 测试引物Table1 Primers used in this study for RT-qPCR tests
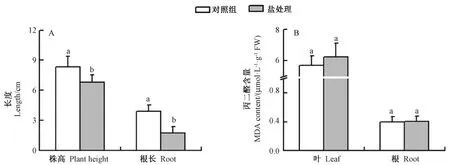
图2 盐处理16 d 对南林895 杨株高、根长和丙二醛含量的影响Fig.2 Effect of 16-day salt stress on the plant height,root length,and MDA content of Nanlin 895
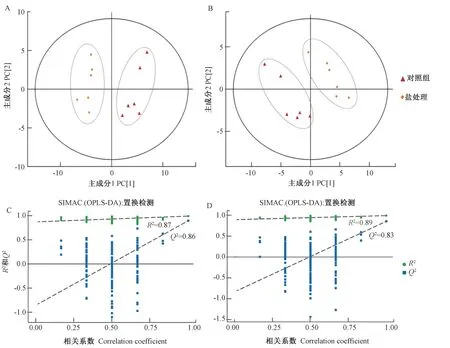
图3 盐处理下南林895 杨树叶片化学轮廓PCA 得分图和OPLS-DA 置换检测图Fig.3 PCA and orthogonal projections to latent structures-discriminate analysis (OPLS-DA) in Nanlin 895 undr salt stress
基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)Pathway 数据库(http:/ /www.kegg.jp/kegg/pathway.html)和小分子有机物活性(PubChem)数据库(https:/ /pubchem.ncbi.nlm.nih.gov/)进行差异代谢物分析、筛选、富集与映射。首先标记出显著差异代谢物,整理出对应物种Populus trichocarpa(black cottonwood)差异代谢物映射的所有通路,并富集到KEGG pathway 数据库。然后综合分析差异代谢物所在通路(包括拓扑和富集分析),进一步筛选与代谢物相关性最高的通路。将差异代谢物映射至KEGG pathway 和PubChem 数据库获得匹配的代谢物信息,并搜索拟南芥(Arabidopsis thaliana)(thale cress)的通路数据库进行分析,结果以气泡图展示(图4)。每个气泡代表一个代谢通路,气泡所在横坐标和大小与该通路的影响因子大小呈正比;所在纵坐标和颜色表示P值(取负自然对数,即-lnPvalue),颜色越深P值越小,富集程度越显著[23]。正、负离子模式下,以P<0.001 为标准,筛出5 条受盐胁迫强烈影响的代谢通路,分别是半乳糖代谢,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸和脯氨酸代谢,嘧啶代谢,以及黄酮和黄酮醇代谢(图4-A、B)。
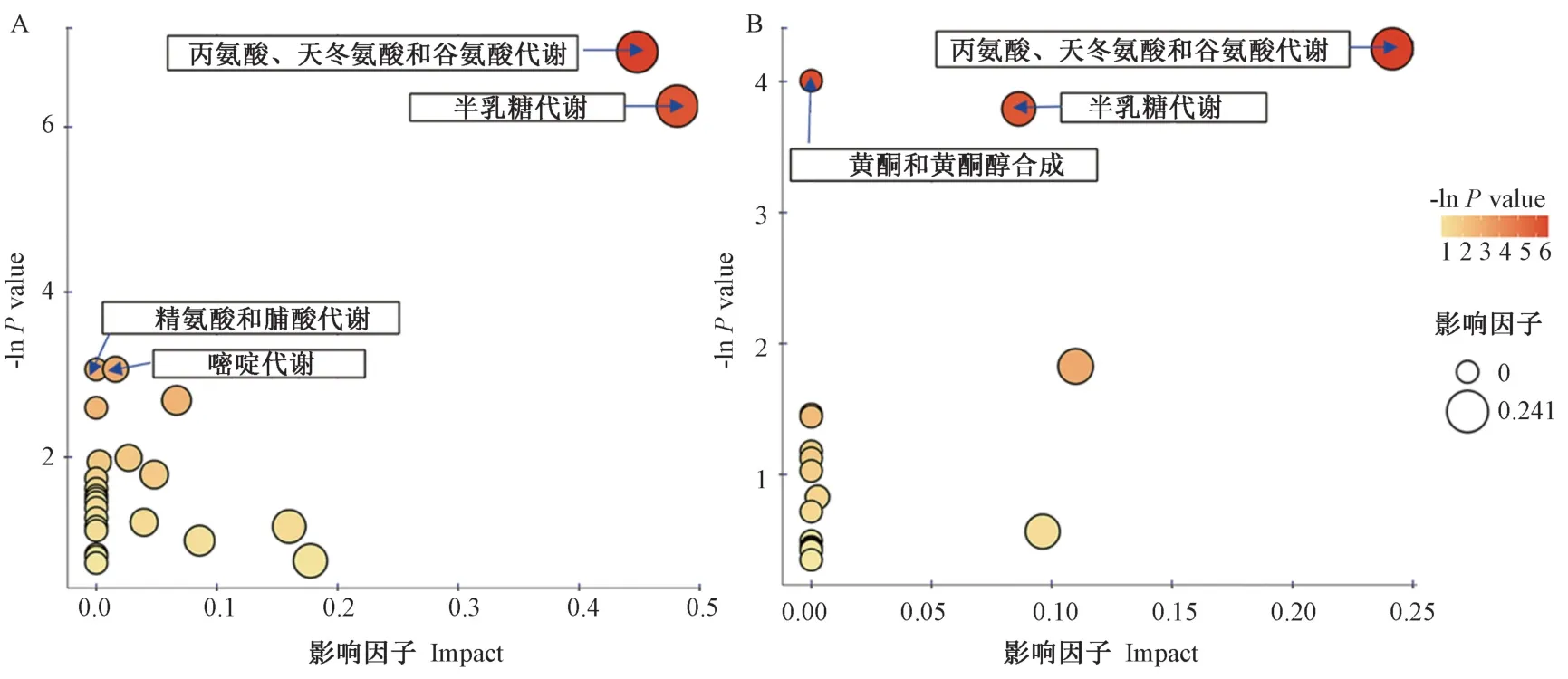
图4 盐处理下南林895 杨叶片中差异代谢通路拓扑分析气泡图Fig.4 Bubble plot of the metabolic pathway topology analysis of Nalin 895 leaves salt stress
基于图4和表2的结果,将部分盐胁迫调控的关键差异代谢物映射于筛选出的差异代谢途径中,呈现于图5。代谢物下方方框内正值表示代谢物含量受盐胁迫上调,负值则表示下调;方框内数值表示差异代谢强度[计算公式: log2(salt/control)],符号为正即上调表达,反之则为下调表达。直线箭头代表无中间代谢步骤,虚线箭头表示有未标出的中间代谢产物。结果表明,三羧酸循环(tricarboxylic acid cycle,TCA)中的关键中间产物α-酮戊二酸被上调至0.86,而苹果酸和延胡索酸分别下调至-0.31 和-0.40,表明TCA 循环受盐胁迫影响明显(图5和表2)。半乳糖代谢相关代谢产物显著累积,如肌醇半乳糖苷(1.51)、棉子糖(1.82)、水苏糖(2.35)以及蔗糖(1.04),暗示该代谢通路因盐胁迫而增强。相反地,海藻糖(-0.32)和甘露糖(-0.51)则因盐胁迫而下降。其他糖类代谢也受盐胁迫影响,其中显著上调的包括支链淀粉(1.57)、麦芽糖(1.01)、异麦芽糖(1.54)、麦芽五糖(1.53)、1-磷酸果糖(0.69)、景天庚酮糖(0.64)以及麦芽三糖(1.36),显著下调的包括葡糖酸盐(-0.75)、来苏糖(-0.62)以及苏糖酸盐(-0.43)(图4、图5和表2)。
由图5和表2可知,杨树的脂类代谢受盐胁迫显著影响。其中,磷脂酰胆碱[phosphatidylcholine,PC(16∶0/16∶0)](0.84)积累,而3-羟基丁酸(-0.91)、顺式-9-棕榈油酸(-0.80)、亚油酸(-0.50)、甘油酸盐(-0.84)以及甘油酸(-1.91)含量减少。天冬氨酸和谷氨酸代谢被盐胁迫明显抑制,体现在部分代谢物水平显著下降,如天冬氨酸(-0.75)、天冬酰胺(-1.20)、谷氨酸(-1.28)、γ-氨基丁酸(aminobutyric acid,GABA)(-1.00)、焦谷氨酸(-0.70)、N-乙酰-L-谷氨酸(N-acetyl-L-glatamate,NAG)(-1.32)以及鸟氨酸(-1.85)(图4、图5和表2)。然而,核酸代谢受盐胁迫抑制,体现在部分关键代谢物水平下降,如腺苷(-1.71)、鸟苷(-0.32)、尿苷(-0.49)、脱氧胞苷(-0.82)、3-甲基尿苷(-0.83)、2′-脱氧-D-核糖(-0.93) 以及烟酰胺腺嘌呤二核苷酸(nicotinamideadenine dinucleotide,NAD)(-0.60)(图4)。此外,与细胞生长相关代谢物细胞色素B(-0.48)含量受盐胁迫下调。N8-乙酰亚精胺(1.75)是胁迫诱导产生亚精胺的衍生物,在盐处理后表现为水平上升(表2)。
南林895 杨在盐胁迫处理的叶片基因相对表达量在图5中以椭圆图标映射于相关代谢途径中,椭圆内为基因名。无黑点表示上调,有黑点表示下调,灰色诱明度与基因表达变化倍数呈反比。结果显示,TCA 循环相关基因kGDH E2、SDH1、FUM1 和MDH1(α-酮戊二酸脱氢酶E2 亚基、琥珀酸脱氢酶、延胡索酸脱氢酶和苹果酸脱氢酶),半乳糖代谢相关基因α-GAL1、RFS和STS(α-半乳糖苷酶,棉子糖合酶和水苏糖合酶),以及果糖代谢相关基因FRUCT和HXK(β-呋喃果糖苷酶和己糖激酶)均受盐胁迫强烈上调。同时,谷氨酸合成相关基因GOGAT和GS2(谷氨酸合酶和谷氨酰胺合酶)盐处理后表达显著增强,而海藻糖激酶基因FUK和谷氨酸脱氢酶基因GDH表达均受盐胁迫抑制。
2.3 南林895 杨响应盐胁迫下酚类差异代谢和相关基因表达分析
由图6可知,受盐胁迫影响含量变化的代谢物中,有三分之二为减少;如甲酰2-氨基苯甲酸(-1.84)、黄芪苷(-0.93)、芹菜素(-0.88)、牡丹酚苷(-0.63)、4-甲氧基肉桂酸(-0.47)、黄酮烷7-O-β-D-葡糖苷(-0.44)、4-羟基肉桂酸(-0.30)以及香叶木苷(地奥斯明)(-0.21);余下三分之一差异代谢酚类(或酚类衍生物)受盐胁迫影响上调,包括儿茶酸(1.55)、异阿魏酸(0.40)、原花青素B4 (0.95)以及间香豆酸(0.97)。此外,酚类合成关键基因EPSPS和PAL1(分别编码5-烯醇丙酮莽草酸-3-磷酸合酶和苯丙氨酸解氨酶)在盐胁迫下第16 天时的相对表达量分别下降95%和85%。

表2 盐处理相比对照组差异代谢物的变化幅度Table2 The fold changes of metabolites in shoots of poplar seedlings under control and salt stress
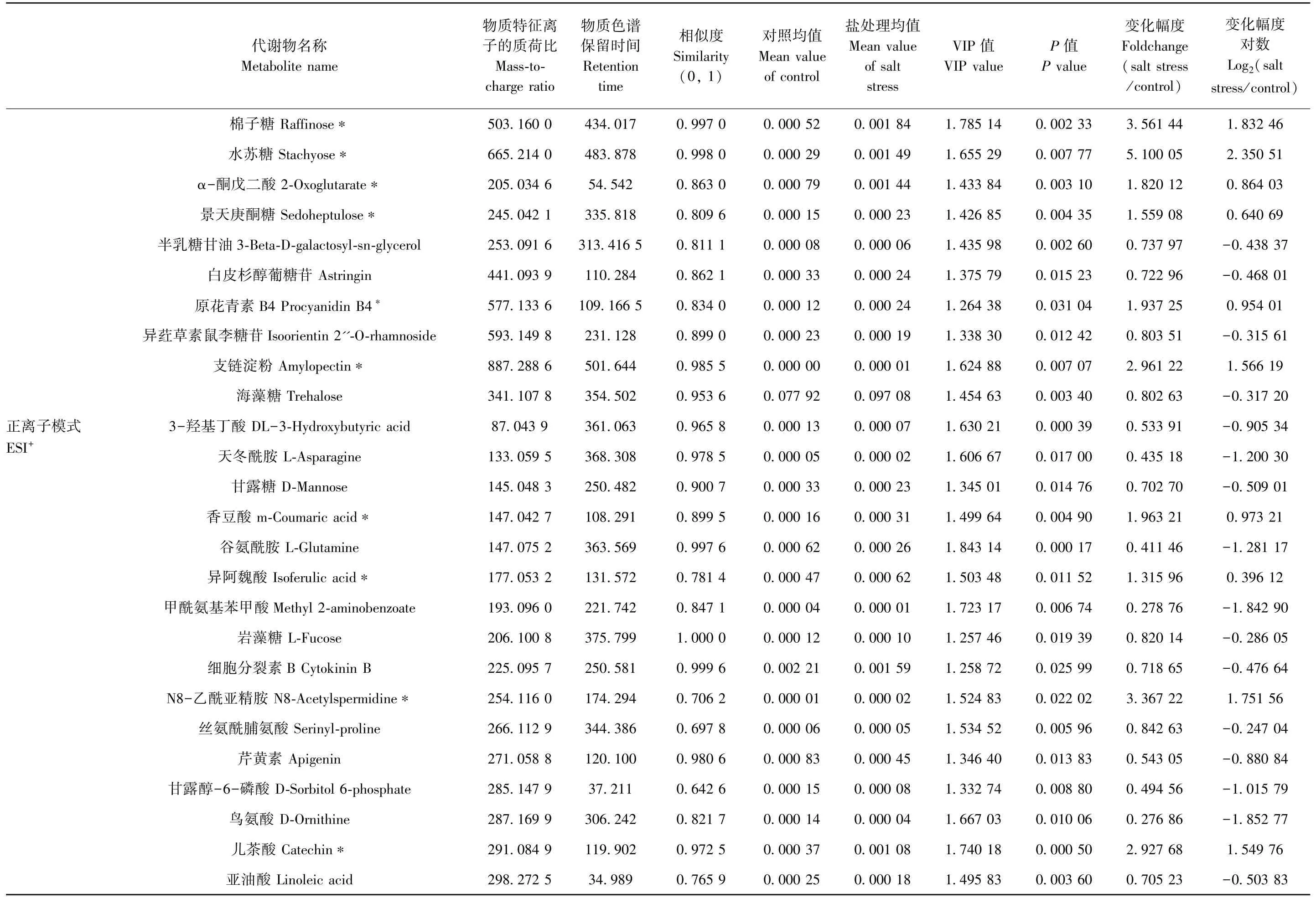
表2 (续)

表2 (续)

图5 盐处理后南林895 杨叶片内差异代谢通路中关键代谢物映射图Fig.5 Changes in metabolites mapped to the metabolic pathways in Nanlin 895 leaves under salt stress
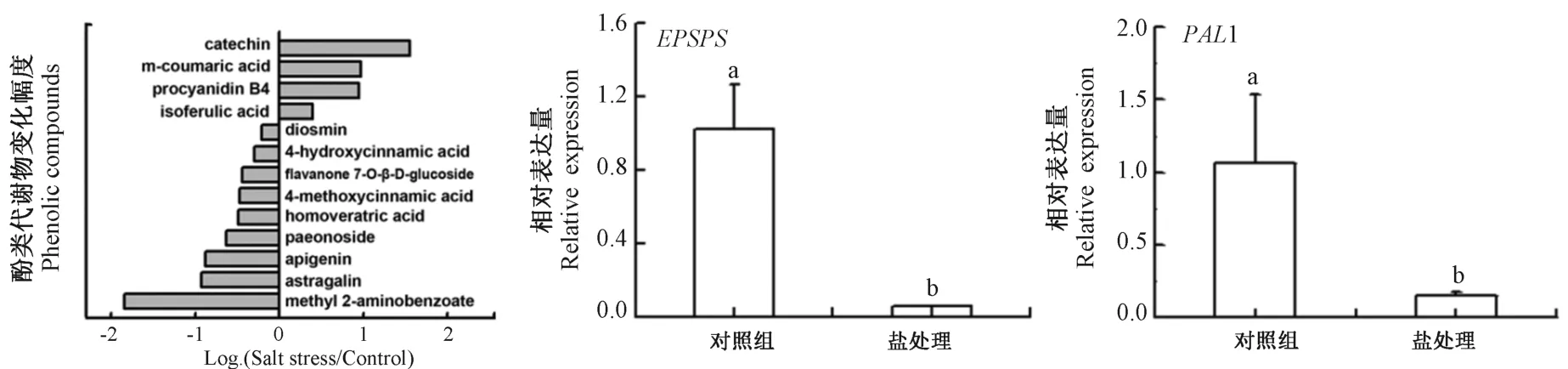
图6 盐处理对南林895 杨叶片中差异代谢酚类含量及酚类合成关键酶基因表达的影响Fig.6 Fold changes of phenolic compounds and changes in expression of phenolic biosynthesis-related genes in Nanlin 895 leaves under salt stress
3 讨论
植物在盐胁迫下会遭受离子毒害和渗透压胁迫,并产生一系列严重危害植物生长发育的次生效应[3,36]。本研究在单芽生长40 d(继代1 次)、根系和叶片均健康的植株培养基中加入100 mmol·L-1NaCl进行盐胁迫处理,发现南林895 杨株高和根长均下降且叶色轻微发黄(图1和图2),植株生长受到明显抑制,但叶片和根系中的MDA 含量未显著增加(图2)。相比根系,叶片作为经济器官在杨树造林和产业化中具有更重要的地位,因此本研究通过代谢组学分析盐胁迫下南林895 杨叶片代谢通路的变化,在正、负离子模式下共得到115 个差异代谢物,筛选出5 条受盐胁迫强烈影响的关键代谢通路,将关键代谢物映射至代谢通路中,检测到所筛选的代谢通路部分相关基因表达量受盐胁迫影响显著。南林895 杨植株可通过调控体内代谢建立耐盐机制,降低膜脂过氧化水平,达到抵御盐胁迫的目的。
3.1 南林895 杨叶片呼吸作用及核酸代谢对盐胁迫的响应
植物对盐胁迫适应性是一个复杂的生理生化过程。目前对植物耐盐机制的理解,包括渗透压调节、离子运输和平衡、能量转换、碳氮代谢及抗氧化等,但具体细节仍不清楚。本研究中,盐胁迫导致南林895 杨叶片TCA 循环中关键基因SDH1、FUM1、和MDH1 均有显著上调表达,重要中间产物苹果酸和延胡索酸含量下降(图5和表2),这与前人在部分耐盐能力弱的大豆品种中的研究结果类似[24-25]。而南林895 杨具有一定耐盐能力,这种不一致可能归因于草本植物和木本植物的差异,或植物年龄、研究对象的环境条件,甚至其他因素(如盐胁迫浓度、取样时间等)。基于MDH1 表达增加和苹果酸含量减少(图5和表2),推测草酰乙酸迅速再生,促进TCA 循环加快和柠檬酸氧化脱羧,导致代谢向积累α-酮戊二酸的方向进行。相应地,α-酮戊二酸含量增加、α-酮戊二酸脱氢酶E2亚基的编码基因kGDHE2 表达增强,可能是同化物消耗加剧的信号。Jacoby 等[8]强调线粒体为植物新组织和器官生长发育提供足量的ATP,在植物耐盐中有重要作用。但本研究中盐胁迫下南林895 杨叶片植株生长却减缓,推测TCA 循环加快导致同化物氧化分解,可能并未将产生的ATP 提供给新组织和器官,导致植株生长受抑制[37]。与此同时,本研究还观察到核酸代谢明显减慢、细胞分裂素B 含量增加(图5和表2),这与前人报道的结果一致[38]。转运RNA 是细胞分裂素合成前体[39],因此细胞分裂素水平的降低可能归因于衰退的核酸代谢强度[40],这也可能是杨树植株生长速率减缓的原因[41]。本研究结果表明,盐胁迫抑制南林895 杨生长,很可能与TCA 循环加速和同化物分解加快,以及生长相关的核酸和植物激素等含量减少有关。
3.2 南林895 杨叶片脂类和半乳糖代谢对盐胁迫的响应
盐胁迫会导致细胞膜脂过氧化[42],常以MDA 作为检测指标[43]。本研究中,盐胁迫并未显著增加南林895 杨叶片和根系的MDA 含量(图2),暗示盐胁迫未对杨树细胞质膜造成严重伤害,这与前人在耐盐型埃及大麦中的报道一致[44]。磷脂酰胆碱(phosphatidyl cholines,PC)不仅是生物膜的结构单元,而且在生物膜适应胁迫中扮演着重要角色[45]。代谢组分析结果显示,盐胁迫导致杨树叶片PC 显著积累(图5和表2)。在玉米根系遭受铝胁迫后,PC 含量增加3 倍左右,但脂类总量减少49%[46]。极性胆碱构成的PC 头部对胁迫条件下维持生物膜的稳定性至关重要[47]。因此,盐胁迫下PC 含量增加可能是植物细胞响应逆境、限制MDA 堆积的适应性反应。此外,研究发现盐害和冷害导致拟南芥的PC 含量增加,推测PC 还可能参与细胞膜介导的信号转导机制[48-49]。
本研究差异代谢物拓扑分析显示,半乳糖代谢在南林895 杨耐盐响应机制中有重要作用(图4)。半乳糖基化的蔗糖分子称为棉子糖族寡糖(raffinose family oligosaccharides,RFOs)。本研究中,盐胁迫下杨树叶片中RFOs(包括棉子糖、水苏糖和肌醇半乳糖苷)含量增加,与前人研究结果相似[50-52]。相应的,RFOs 代谢关键基因RFS、STS和α-GAL1 也被盐胁迫强烈上调表达(图5)。这些结果表示盐处理导致RFOs 代谢强度爆发。RFO 能参与渗透调节和清除氧自由基[51,53-55]帮助植物抵御环境胁迫造成的伤害。因此,盐胁迫诱导半乳糖合酶催化RFOs 合成与堆积[56-57],提高杨树细胞的渗透压适应性和抗氧化能力,从而限制MDA 含量的上升[50,54,57]。盐处理导致叶片中蔗糖增加可能为RFOs 合成提供原料[58]。同时,本研究中其他渗透调节物质(海藻糖、来苏糖、甘露糖)含量减少,且FUK基因下调表达(图5),这些结果表明南林895 杨可能主要通过积累RFOs 进行渗透调节和抗氧化,以响应盐胁迫。此外,本研究中盐处理导致叶片中麦芽糖、异麦芽糖、麦芽三糖和麦芽五糖含量增加的同时,伴随果糖代谢相关基因FRUCT和HXK表达上调,可能与胁迫引起总糖含量上升有关[59-60]。
3.3 南林895 杨叶片氨基酸代谢对盐胁迫的响应
游离氨基酸不仅是蛋白质合成单元,而且在植物抵抗环境胁迫中发挥重要作用[61]。大部分氨基酸相关代谢物均受盐胁迫影响含量下降(图5和表2),与前人研究相似[25]。此外,差异代谢物拓扑分析显示天冬氨酸和谷氨酸代谢在南林895 杨耐盐机制中有重要作用(图4)。谷氨酸合成主要基因GOGAT和GS2 受盐处理诱导表达显著上调,而催化谷氨酸合成支路的GDH被盐胁迫抑制表达,谷氨酸、焦谷氨酸、N-乙酰-L-谷氨酸和GABA 等含量均下降。同时,鸟氨酸、天冬氨酸和天冬酰胺含量也减少(图5)。研究表明,棘孢曲霉侵染黑麦草,能导致植物体内丙氨酸、脯氨酸、GABA 以及天冬氨酸含量减少,进而耐盐能力增强[62],与本研究结果相似。谷氨酸代谢削弱会切断脯氨酸和GABA 的合成来源。包括亚精胺在内的多胺能通过减少Na+吸收、改善营养平衡、抵抗氧化胁迫,以及甲基乙二醛解毒等多种方式提高植物对抗盐胁迫的能力[11]。而多胺与脯氨酸在合成上竞争前体鸟氨酸[63]。本研究中,盐胁迫导致杨树叶片中多胺衍生物N8-乙酰亚精胺堆积(图5),可能通过消耗大量鸟氨酸限制了脯氨酸合成。综上,推测南林895 杨可能整合各种氨基酸代谢、形成一套较为复杂的保护机制,如降低丙氨酸、脯氨酸和GABA 合成代谢,以及刺激亚精胺相关抗性途径增强等,以提高其耐盐能力。
3.4 南林895 杨叶片酚类代谢对盐胁迫的响应
根据差异代谢物拓扑分析(图4),酚类中的黄酮和黄酮醇合成受盐处理影响剧烈。酚类作为植物体内次生代谢产物,在植物遭受逆境能清除活性氧(reactive oxygen species,ROS)[64]。然而,本研究发现南林895 杨叶片中酚类合成关键基因EPSPS和PAL1表达均受盐胁迫影响显著下调,且三分之二的差异代谢酚类含量下降(图6和表2)。前人研究发现,发源于盐渍地区的胡杨具有高水平的酚类合成代谢以加强抗氧化系统,是其具有极强耐盐能力的原因之一[27]。南林895 杨作为美洲黑杨无性系后代,是一种广泛适生型速生杨,其耐盐机制可能与胡杨不同。南林895杨减少酚类合成,以便将节约下来的能量供给其他代谢途径,如PC、RFOs 或多胺等的合成来缓解盐害导致的氧化胁迫(图5和表2)。酚类代谢物在南林895 杨盐胁迫响应中的作用仍需进一步深入研究。
4 结论
本研究结果表明,在盐胁迫下,南林895 杨无菌培养植株的TCA 循环速率增强,PC、RFOs 和氨基酸合成和抗氧化系统等生理响应会导致植株生长速率减缓。本研究结果为从代谢组水平揭示中等耐盐的美洲黑杨无性系后代南林895 杨响应盐胁迫的分子机制提供了证据。

