超高效液相色谱-串联质谱法测定动物尿液中5种镇静剂类药物残留
徐 迪 马 康 单吉浩 李建勋
(1中国农业科学院农产品加工研究所,北京 100193;2中国计量科学研究院,北京 100029)
镇静剂类药物是一类通过抑制中枢神经系统减弱其生理机能而达到缓和激动、消除躁动、恢复安静情绪的药物[1-2]。近年来,有些不法畜牧业主为了追求经济利益最大化,在畜禽饲料中违法添加镇静剂类药物,以达到降低动物运动量和增重催肥的目的[3]。此外,在动物运输过程中也常常使用此类药物来减少动物体重下降以及防止肉品质降低[4-5]。非法使用镇静剂类药物会导致药物残留在各种动物源食品中,食用此类食品会对人体神经系统产生较大的危害[6]。目前,国际食品法典委员会(codex alimentarius commission,CAC)、欧盟、澳大利亚等国家或组织均对畜肉中镇静剂的最高限量值做出了相关规定[7]。我国则将镇静剂类药物列为禁用药物,规定动物源食品中不得检出此类药物[8-9]。
目前,镇静剂类药物残留检测方法主要有酶联免疫(enzyme-linked immuno sorbent assay,ELISA)法[10]、高效液相色谱(high performance liquid chromatography,HPLC) 法[11-14]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometery,GC-MS/MS)法[15-18]和超高液相色谱- 串联质谱(ultra-high performance liquid chromatogram-tandem mass spectrometry,UPLC-MS/MS)法[19-25]。其中ELISA 法检测结果易出现假阳性结果;HPLC 法灵敏度低,且色谱峰易受到各种基质成分的干扰,易造成定量不准确;GCMS/MS 法需对样品进行衍生化,导致检测周期长;而UPLC-MS/MS 法可以弥补前几种方法的缺陷,该技术无需衍生化处理,且其选择性高、灵敏度高、特异性强。已有针对动物源性食品和血液中镇静剂类药物检测的文献报道[26-27],然而对动物尿液中镇静剂类药物残留检测方法的报道较少。因此,本试验采用UPLC-MS/MS技术,以期建立猪、牛、羊尿液中5 种常见镇静剂类药物异丙嗪亚砜、异丙嗪、氯丙嗪、安眠酮和地西泮残留的测定方法,为我国相关监管部门提供技术支持。
1 材料与方法
1.1 试验材料与试剂
猪尿、牛尿、羊尿取自于河北、天津、海南三省的生猪、生牛和生羊屠宰场。
异丙嗪亚砜、异丙嗪、氯丙嗪、安眠酮和地西泮标准品,天津阿尔塔科技有限公司;甲醇、乙腈(质谱纯),美国Fisher 公司;甲酸、乙酸(色谱级),美国Sigma 公司。
1.2 仪器与设备
Triple Quad 6495 三重四级杆质谱仪,美国Agilent公司;3K15 离心机,美国Sigma 公司;Vortex-genie 2 涡旋混合器,德国IKA 公司;AG245 分析天平,瑞士Metler Toledo 公司;DSY-Ⅲ水浴型氮吹仪,北京东方精华苑科技有限公司;Oasis MCX 固相萃取柱(3 mL,60 mg),美国Waters 公司;Milli-Q 纯水仪,美国Millipore公司。
1.3 试验方法
1.3.1 混合标准工作溶液配制 分别准确称取10.0 mg 氯丙嗪、异丙嗪、安眠酮、异丙嗪亚砜和地西泮标准品,用甲醇溶解、定容、混匀,配制成1.0 g·L-1的标准储备溶液。精密量取各标准储备溶液于容量瓶中,甲醇定容,配制成10.0 mg·L-1的混合标准中间溶液,再用甲醇将其稀释成不同浓度的标准工作溶液。以上标准溶液均避光-18℃保存。
1.3.2 样品前处理 准确量取2.0±0.05 mL 尿液(猪尿、牛尿、羊尿)于50 mL 具塞离心管中,8 000 r·min-1离心5 min,上清液用5%乙酸水溶液调pH 值至3.0,然后过Oasis MCX 柱净化:首先依次用3 mL甲醇和3 mL 水对MCX 柱进行预处理,然后将上清液加载在MCX 小柱上,再依次用3 mL 水和3 mL 40%甲醇水溶液洗柱,弃去淋洗液,真空抽干MCX 小柱1 min,取3 mL 5%氨化甲醇进行洗脱,洗脱液在45℃条件下氮气流吹干,加入2 mL 0.1%甲酸溶液/乙腈(v/v,8/2)溶解复溶,过0.22 μm 滤膜,供UPLC-MS/MS检测。
1.3.3 色谱条件 色谱柱:Agilent Poroshell 120ECC18 柱(50 mm×2.1 mm,2.7 μm);流动相A:0.1%甲酸水溶液;流动相B:乙腈;梯度洗脱条件:0~1.0 min,90% A;5.0 min,25% A;5.5 ~6.0 min,15% A;7.0 ~8.0 min,1% A;9.0 ~10.0 min,90%A;柱温:45℃;流动相流速:0.4 mL·min-1;进样量:10 μL。
1.3.4 质谱条件 离子源:电喷雾电离源(ESI);扫描方式:正离子扫描;检测方式:多重反应监测(multiple reaction monitoring,MRM);毛细管电压:2.5 kV;喷嘴电压:2.0 kV;干燥气温度:200℃;锥孔反吹气流速:50 L·h-1;脱溶剂气温度和流量分别为380℃和660 L·h-1;定性离子对、定量离子对、锥孔电压和碰撞能量见表1。
1.3.5 方法学考察及基质效应评价 取不含待测药物的猪尿、牛尿、羊尿的空白基质,添加浓度分别为0.6、2.5 和9.0 μg·L-1的镇静剂类药物,按1.3.2 方法处理后,按1.3.3 色谱条件进行样品分析,每个浓度重复5 次,考察回收率与精密度;分别以3 倍、10 倍信噪比(signal-noise ratio,S/N)计算检出限和定量限:5 种镇静剂类药物在猪尿、牛尿和羊尿中受到的基质效应根据其在浓度为2.5 μg·L-1的基质匹配标准溶液和同等浓度的溶剂标准溶液中的响应比值来计算,即基质效应(matrix effect,ME)=(基质匹配标准溶液在仪器上的响应值-溶剂标准溶液在仪器上的响应值)/溶剂标准溶液在仪器上的响应值×100%[28]。根据ME 值可将其分为三类:ME<-20%定义为基质抑制效应;-20%≤ME≤20%定义为弱基质效应;ME>20%定义为基质增强效应。
1.4 数据分析
采用SPSS 22.0 以及Excel 2010 软件进行数据处理及分析,采用Origin 8.6 软件绘制图表。
2 结果与分析
2.1 质谱条件的优化
欧盟规定对于禁用兽药残留定性确证的要求,至少需要4 个确证点。本试验选择每个兽药的母离子和对应的两个响应较高的子离子进行定性,一个母离子和一个子离子分别为1 个和1.5 个确证点,共4 个确证点,满足定性要求。两个子离子中丰度高的最为定量离子,并通过一系列碰撞能量条件优化,确定5 种镇静剂类兽药串联质谱分析的最佳碰撞能量。5 种镇静剂类兽药的定性和定量离子对以及碰撞能量等参数见表1。
2.2 基质效应评价
基质效应可分为对分析物信号响应的增强效应、弱基质效应和抑制效应,最终会影响定量结果的准确性[29]。由表2可知,5 种镇静剂类药物在3 种尿样均显示出弱基质效应,更多地显示出弱基质抑制效应。这可能是由于尿液中杂质成分与目标分析物竞争性进入离子源被检测,导致弱基质抑制效应。综上,基质效应不显著,对定量结果的影响较小,因此可直接采用溶剂标准溶液代替基质匹配标准溶液对目标物进行定量分析,从而降低实验周期,提高检测效率。
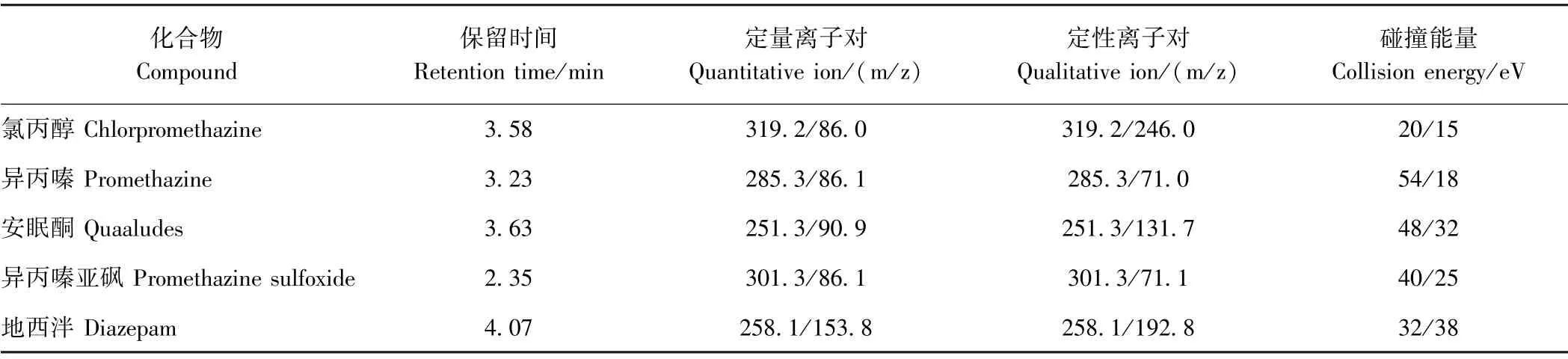
表1 5 种镇静剂的定性、定量离子对和最佳碰撞能量Table1 Quantitative and qualitative ions,and optimized collision energies for the five sedatives
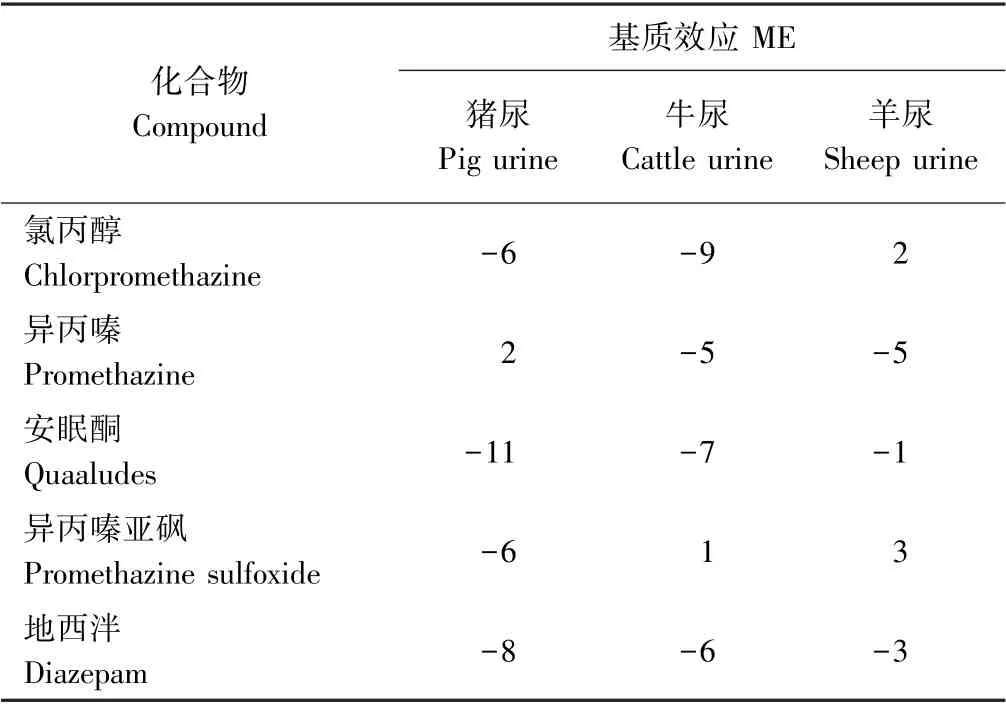
表2 不同尿样中5 种镇静剂药物的基质效应Table2 ME for the five sedatives in different urine samples/%
2.3 方法学考察
2.3.1 线形范围、检出限和定量限 用甲醇稀释混合标准中间溶液配制成0.1、0.2、0.5、1.0、5.0、10.0 和20.0 μg·L-1系列标准工作液。以目标物的质量浓度为横坐标(x,μg·L-1),其定量离子色谱峰面积(y)为纵坐标,绘制标准曲线,结果见表3。5 种镇静剂在0.6~20.0 μg·L-1内呈现良好的线性关系,相关系数(R2) 均大于0.993。5 种镇静剂类药物检出限均为0.1 μg·L-1,定量限均为0.6 μg·L-1,证实该方法灵敏度高,可满足日常检测需要。
2.3.2 方法的准确度与精密度 本试验通过猪尿、牛尿和羊尿加标回收试验对方法准确度和精密度进行评价,各药物的回收率和精密度见表4。结果表明,5 种镇静剂药物的平均回收率为64.6%~110.2%,相对标准偏 差(relative standard deviation,RSD) 均小于6.0%,证实本方法具有很好的准确度和精密度。
2.4 实际样品检测
随机抽取屠宰场中猪、牛、羊尿各15 份,采用本试验建立的方法和中国检验检疫行业标准方法[27]分别对其进行检测,均未检测出5 种镇静剂药物残留,证实该方法是准确、可靠的。
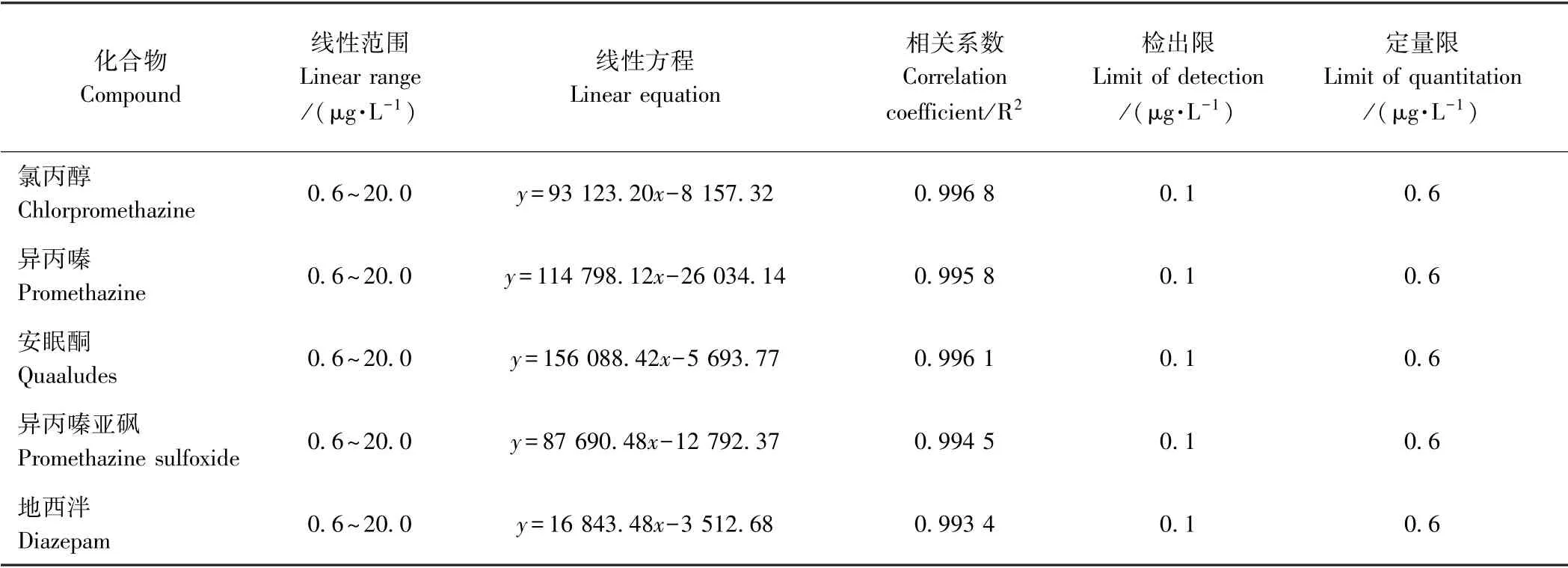
表3 5 种镇静剂类药物的线性范围、检出限与定量限Table3 Linear ranges,limit of detection and limit of quantitation of five sedatives
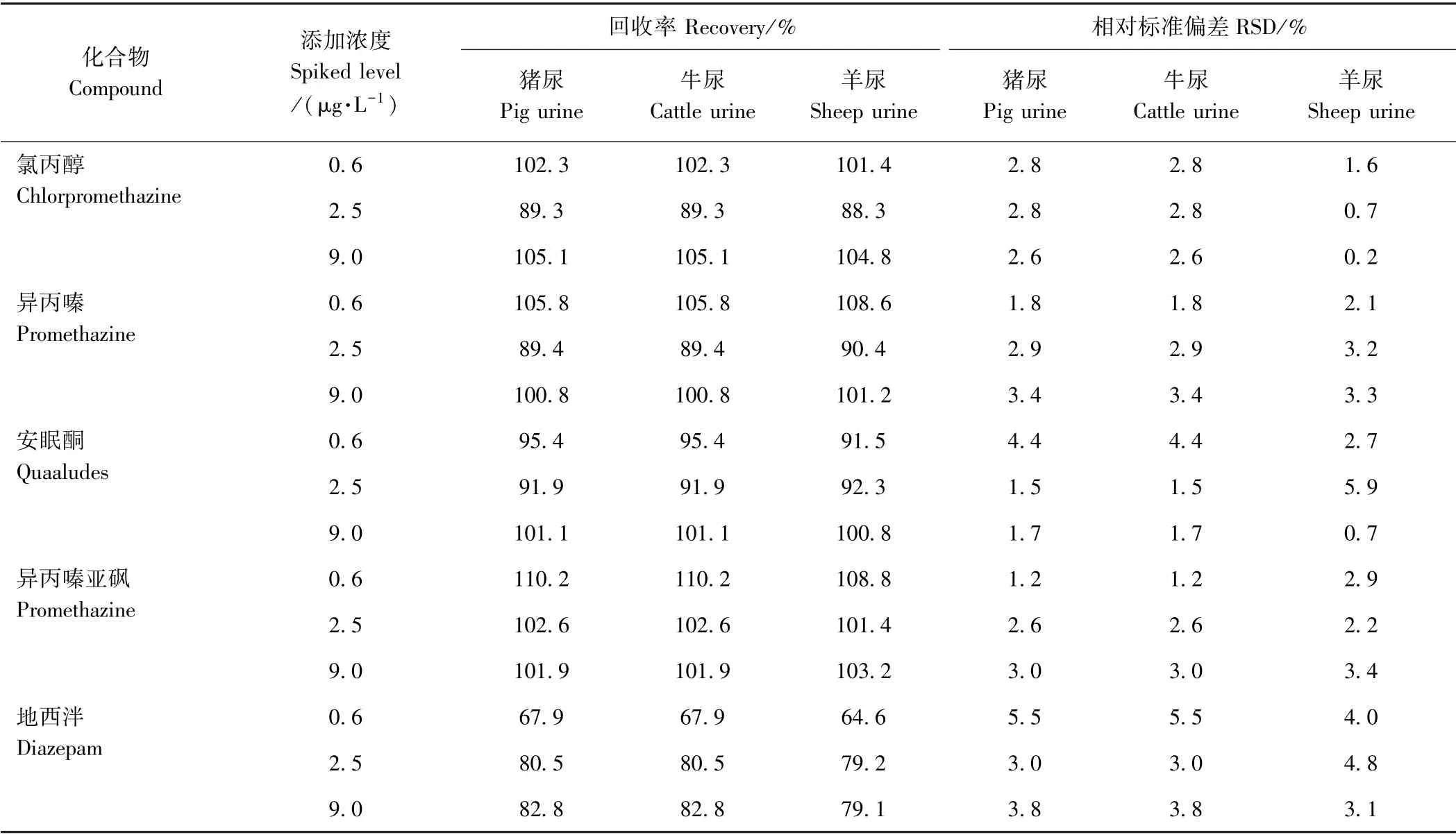
表4 猪尿、牛尿和羊尿中5 种镇静剂药物准确度和精密度试验结果(n=5)Table4 Average recoveries and relative standard deviations (RSDs) of the five sedatives in pig urine,cow urine and sheep urine (n=5)
3 讨论
本研究采用UPLC-MS/MS 法测定5 种镇静剂类药物残留,省略了采用气相色谱法检测所必需的衍生化过程,很大程度缩短了试验周期。已有研究表明,采用UPLC-MS/MS 法能够有效测定动物源食品的镇静剂类药物[6],但针对不同样品的基质、净化和提取条件差异较大。朱群英等[1]在检测猪肉样品中镇静剂类药物时,以乙酸乙酯为提取剂,经Oasis HLB 固相萃取柱净化后,镇静剂类药物回收率为88.5% ~115.0%。刘家阳等[7]选取盐酸溶液提取畜肉中的镇静剂类药物,经MCX 固相萃取净化后,镇静剂类药物回收率为71.6%~112.0%;本研究利用Oasis MCX 固相萃取小柱净化,UPLC-MS/MS 分析测定猪、牛、羊尿中5 种镇静剂类药物残留含量,其回收率为64.6%~110.2%,符合残留检测要求。但与孟蕾等[2]的研究结果相比,本研究测定的镇静剂类药物回收率范围较大,其原因可能是本试验测定不同动物源尿液样品中含有的物质有一定差异性,同一种固相萃取小柱对不同尿液净化能力不同,导致回收率范围较宽。因此,在今后的工作中,可针对不同动物尿液自身的特性,对多种不同的提取溶剂和净化小柱进行考察,开展多样的提取和净化条件筛选工作。
本研究利用乙腈对动物尿液中镇静剂类药物进行提取,采用固相萃取柱去除尿液中杂质对检测结果的影响,步骤操作简单,且针对动物尿液这类相对比较简单的基质,通过基质效应考察发现,基质效应并不明显,故可以直接采用溶剂标准溶液对目标物进行定量分析,从而省略了每批样品配置基质匹配标准溶液的繁杂步骤,整个前处理过程在10 min 内即可完成,实现了动物尿液中镇静剂类兽药残留的快速检测。国标方法[30]是在碱性条件下利用特丁基甲醚对基质中镇静剂类药物进行提取,前处理过程涉及水浴和多次提取的步骤,前处理过程约2.5 h,仪器检测时间长达1 h,是该方法仪器检测时长的6 倍。因此,本研究的分析方法具有速度快、灵敏度高和重现性好的特点,可适用于大批量的不同动物尿液中镇静剂类药物残留的快速检测。
4 结论
本研究采用固相萃取柱净化方式,建立了UPLCMS/MS 法测定动物尿样中5 种镇静剂类兽药残留的检测方法,基质效应不明显,因此采用溶剂标准工作曲线定量。采用该方法对猪、牛、羊尿中的5 种镇静剂兽药残留检测显示出良好的萃取效果,加标回收率在64.6%~110.2%之间,RSD 均小于6.0%,定量限为0.6 μg·L-1,该方法准确度高,稳定性好,灵敏度高,各项指标均能满足猪、牛、羊尿中镇静剂类兽药残留检测分析的要求,可为不同动物尿液中镇静剂类药物的常规检测提供有力帮助。

