湖泊富营养化治理: 集中控磷, 或氮磷皆控?
王洪铸 王海军 李 艳 马硕楠,2 于 清,2
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
水体富营养化是全球普遍存在的严重水环境问题。我国湖泊的富营养化问题尤为突出, 最典型的案例是2007年太湖蓝藻水华事件, 致使无锡市五百万人的饮用水和生活用水严重短缺。因此, 治理富营养化是中国和世界的重大需求。关于富营养化的治理, 有大量全湖实验和湖泊治理实践表明只控磷(P)就可使湖泊贫营养化[1—4], 但也有不少人认为需要氮(N)和P皆控[5—9]。由于N和P皆控成本高昂, 可达只控P的4—15倍[3,10], 故确定是否控N具有极为重要的现实意义。
Weber于1907年把eutrophic(富营养的)、mesotrophic(中营养的)和oligotrophic(贫营养的)的德文形式[nährstoffreichere (eutrophe) dan mittelreiche(mesotrophe) und zuletzt nährstoffarme (oligotrophe)]引入科学, 描述泥炭沼泽土壤的营养水平; 1919年,Naumann用这些词汇描述肉眼判定的水型, 试图反映营养物质和浮游藻类的多寡[11,12]。随后, 根据局域湖泊的地形、物理和化学特征以及从细菌到鱼类、水鸟的各种指示生物, 诸多学者尝试划分湖泊营养类型, 产生了许多复杂而难用的分类方法[11,13]。自20世纪70年代至今, 主要依据初级生产者的生物量和生产量划分营养类型, 而放弃过去认为的原因和后果指标[13,14]。所谓的富营养化(Eutrophication)是水体初级生产者(浮游藻类、着生藻类和大型水生植物)的生物量和生产量从低到高的演变过程,即从贫营养到富营养状态; 反之, 则为贫营养化(Oligotrophication)[13]。依据初级生产者类型, 富营养化分为藻型和草型(大型植物); 依据原因, 分为自然(Natural)和人为(Cultural)两类。严重的富营养化影响供水安全(如藻类水华、沼泽化、毒素和异味物质、缺氧、有害气体), 破坏生态系统(如生物多样性下降、鱼类死亡和食物网简化), 降低景观和休憩价值。因藻型富营养化最常见且危害较大, 本文只讨论该类灾害的控制问题。
何种营养增多导致富营养化?何种营养减少可控制富营养化?过去至现在的研究一般把这两个问题归为一个问题, 即限制性营养因子。Naumann猜测导致富营养化的主要因子是P和N[11,15]。通过对美国康涅狄格州及纽约49个湖泊数据的统计分析, Deevey[16]发现夏季浮游藻类叶绿素与冬季平均总磷(TP)的相关系数远高于前者与冬季硝态氮(-N)和重碳酸碱度的相关系数, 因而认为P是最重要限制因子; 随后不少学者提出了类似的观点[17]。同时, 实验室的生物测试显示微量元素(铁、硼、铜、钴和钼), 以及有机生长因子(维生素B12、B1和E、激素)和有机螯合剂等, 也可能是限制因子[17]。
人为富营养化伴随着人类文明, 沉积物分析显示古罗马时期湖泊就因人类活动而发生了水华。20世纪初期至中期, 富营养化问题在欧美等地日趋严重[4]。1966年, 经济合作与发展组织(OECD)委托瑞士学者Vollenweider收集研究富营养化相关文献,寻求系统的治理方略。两年后, Vollenweider[17]提交了里程碑式的综述报告, 首先指出P和N是导致富营养化最重要的营养因子, 且P的限制作用常更强, 然后分析了湖水TP与外源负荷的关系及其影响因子, 进而建立了湖泊流域管理的系统框架。该报告虽从未正式出版, 但被广泛引用, 并被成功应用于伊利湖(Lake Erie)等北美湖泊的富营养化治理。Vollenweider[17]给出了P的限制作用强于N的三个证据: (1)由贫营养至富营养的过程中, 浮游藻类优势种发生演替, 它们的最低需P量增加, 而需N量的变化无规律, 暗示P是限制因子; (2)初级生产力(冬季碱度-夏季碱度)与冬季TP的相关系数明显大于与冬季无机N的相关系数, 且TP超过阈值时高生产力的概率更大; (3)生物测试显示: 浮游藻类生产力由低、中至高的过程中, 限制因子分别是P和N。Hutchinson[12]给出了另一个重要证据: 根据岩石圈元素相对含量与植物体元素相对含量的比值, P的供给最稀缺, 故P是最可能的限制因子。
美国华盛顿湖(87.6 km2)治理案例说明降P即可逆转富营养化。自20世纪30年代, 大量污水排入该湖, 富营养化和蓝藻水华严重。1963—1968年入湖污水被完全截断。至1975年, 该湖得以恢复。根据几十年的数据, Edmondson推断治理成功的主因是减少了P输入, 因为浮游藻类叶绿素含量与P浓度明显正相关, 而与N和碳(C)浓度相关不明显[18—20]。
Vollenweider和Edmondson等[17—20]学者的工作已较清楚地说明P是浮游藻类的主要限制因子。这个结论意味着要限制含P洗涤剂的生产, 因而受到了相关利益集团的反对。受有关厂商的资助, 有些学者根据小尺度的营养添加实验声称导致藻类水华的因子是C而不是P, 认为过量外源有机质分解产生二氧化碳, 从而促进藻类生长[14,21,22]。这个观点受到鼓吹, 引发了关于限制营养的激烈争论[23]。
为解决上述争论, Schindler领导的团队于1969年在加拿大实验湖区的227号湖开展全湖营养添加实验。该湖溶解性无机C的含量很低, 但在添加P和N后迅速富营养化, 因为二氧化碳能通过水气界面得到补充[24—26]。该实验彻底否定了C限制观点。随后, 该团队在226号湖和其他湖泊继续开展系列全湖实验, 证明: 单添加P能导致湖泊富营养化, 而单添加N则不能; 添加N和P后停止添加P即可使湖泊实现贫营养化(详见后文3.2)。因此, 北美和欧洲的许多湖泊采取了控P措施, 并取得了成功(详见后文3.2)。
根据小尺度的营养添加实验和氮磷比假说, 有些学者认为N也是藻类的重要限制因子, 同样需要控制[27,28]。然而, Hutchinson[12]和Schindler[29]等早就认为控N可诱发固N蓝藻大量生长。为了证实这一假说, Schindler团队在227号湖通过减少和停止添加N继续开展实验(1969—2009)[1,30]。结果表明:减少N的输入可大大促进固N蓝藻的生长; 只要P充足且时间足够, 固N作用就可使藻类总量达到较高水平, 从而使湖泊保持高度富营养状态。这充分说明: 就藻类总量控制而言, 富营养化治理无需控N,只需控P。
过去关于富营养化的全湖实验和治理实践大多集中在高纬度地区。为此, 我们自2010年起在长江中游实验池塘开展了系列实验, 结果证实富营养化治理只需控P的结论同样适用于亚热带等低纬度地区[31](详见后文3.2)。中外研究已充分证明: 在数月至数年的尺度上, 消减N负荷不能控制浮游藻类的总量, 只有控P才能长期有效地治理富营养化及蓝藻水华[2]。空气中存在大量的氮气, 水体可以通过生物固N和闪电固N补充N的不足, 迄今全球自然固N量仍占总量(包括N肥生产)的50%以上, 富营养湖泊藻类固N量占全部N输入的28%(6%—82%)[32]。但是P没有类似的补充途径, 且其化合物溶解性较差, 故P成为限制藻类生长的最重要因素。
考虑到某些N形态的生态毒性等负面效应, 我们提出应放宽控N, 集中控P[2]。进而, 系统研究了高N的生态效应, 初一步确定了放宽控N的限度(详见后文5)。
对于富营养化治理应放宽控N的观点, 至今有不少人反对。虽然他们所说各种理由均不充分(详见后文4), 但是仍然有很大的迷惑性。为从根本上驳倒严格控N观点, 本文首先系统回顾了富营养化及限制性营养的研究历史; 然后辨析限制因子概念的本质, 介绍减控因子新概念, 指出限制因子并不一定是减控因子; 继而, 系统整理P为富营养化减控因子的系列证据; 逐一反驳控N观点的各种理由;阐述高N的生态效应, 给出放宽控N的限度; 最后,提出湖泊富营养化的系统管理对策。
1 限制因子概念及其发展
最小因子法则实质上最早由德国农学家和化学家Sprengel于1828年阐述。他指出: 植物发育需要12种物质(盐); 若任一种缺失, 植物将无法生长;若某一种的可利用量不能满足植物特性的需求, 植物将生长不好。1840年, 德国化学家Liebig在专著《有机化学及其在农业和生理学中的应用》中转述了这一规律, 但是没有标明出处; 1862年, 第七版正式提出最小因子法则。由于Liebig的巨大影响,该法则长期被冠以他的名字。德国史学家建议: 该法则应被称为Sprengel-Liebig Law of the Minimum[33]。
最初, 最小因子法则只涉及营养盐, 此后扩展到温度、光照、二氧化碳和水分等多种环境因子[34],适用对象从植物扩展到所有生物, 从个体扩展到种群和群落。1913年, 美国生态学家Shelford在最小因子法则上又提出了耐受性法则, 即每种生物对任一必需的环境(生态)因子有耐受的上限和下限及适宜区[35]。当一种环境(生态)因子接近或超过生物的耐受限, 为最难以获得的因子, 或为控制生物过程的最慢因子, 即成为限制因子(Limiting factor), 决定生物的生存、生长、繁衍和分布范围[35,36]。由于分布区环境的时空异质性, 特定时空点的限制因子可随之变化, 任何必需的环境因子均可成为限制因子[37, 38]。
限制因子的直接判定依据(即操作定义)是因子改变实验, 即当改变某个环境因子(常自耐受限向适宜区改变, 如添加生物可利用营养物质)时, 若生物过程的速率(如初级生产量)或生态系统组分的大小(如生物量)发生显著的相应变化, 则称该因子为限制因子[39]。20世纪60—70年代以前, 一般认为特定时空点的限制因子只有一个。后来, 中小尺度的实验显示存在多种资源限制(Multiple resource limitation)现象[39—41], 即分别改变多个因子时生物或生态系统均显著变化, 或同时改变多个因子时显著变化, 而单独改变时无显著变化。多种资源限制现象有三种机制[39]: (1)资源供给平衡改变导致植物发生生理和形态(如根茎比例)变化, 以便分配更多物质和能量去获取最稀缺的资源[42—44]。这种现象在通过截然不同途径获得的资源(如光、二氧化碳、水和营养)分别改变时表现得最为明显[43]。(2)资源供给的正相互作用。例如, 在陆地[45,46]和水体[1,31]生态系统中, 添加P导致固N速率上升, 从而使N的总量最终达到与P供给量相匹配的水平。反之, 添加N可促进陆地生物产生更多胞外磷酸酶来分解土壤有机P[47—49], 水体也有类似的现象[50—52]。然而, P和N供给的相互作用并不对称, P供给量决定系统N的总量, 而N供给量只影响P循环速率, 却不影响总量。N和P供给的正作用是中小尺度实验中不少陆地、淡水和海洋系统表现为N和P共同限制的重要原因[41]。(3)在群落水平, 不同种类的资源需求不同[53]。例如, 由于不同种类细菌对C/P的需求不同, 导致在一定的C/P范围内培养细菌群落的生物量保持不变,同时添加C和P生物量则变化[54]。
限制因子可以分为近期限制因子(Proximate limiting factor)和终极限制因子(Ultimate limiting factor)[55,56]。近期限制因子的改变在中小时空尺度上直接导致生物过程或生物库变化, 而终极限制因子的改变在大尺度上导致生态系统完全变化, 一般不仅改变生物过程的速率, 而且持久显著地改变生态系统的结构和种类组成[39]。尺度大小是相对所研究生态过程的时空尺度而言的。例如, 由于人为富营养化过程发生的时间尺度为数年至百年, 空间尺度为单个水体(如湖泊)、流域水系或区域水体,在数天至数月的封闭瓶至围隔实验得出的限制因子为近期限制因子, 而数年至数十年的全湖施肥实验得出的限制因子为终极限制因子。陆生植物的生命周期较长, 研究尺度应该更大。由于生态系统是开放的复杂的适应系统, 近期限制因子不一定能指示终极限制因子, 两者间常存在明显不同(参见后文4.1)。生态系统管理更应关注终极限制因子,但过去的研究集中于易分析的近期限制因子; 这种现象必须改变。
2 新概念: 减控因子
限制因子的定义和判定清楚地显示, 其目的是确定促进生物生长的因子(图 1A)。反之, 应是抑制过度生长的因子。为此, 我们提出了一个新概念即减控因子(Abating factor)(图 1B), 其定义是: 在生态系统管理中, 能够抑制生物个体、种群和群落过度繁盛的必需环境因子(间接减控因子), 或直接减灭生物本身的物理(机械)、化学和生物因子(直接减控因子), 且成本效益最大; 生物必需(或致命)、管理尺度可控、实际应用可行和比较成本最低是减控因子的四个充分必要条件[57]。
确定减控因子的步骤如下: (1) 必需性分析: 确定必需的环境因子(植物: 光、温度、二氧化碳、水和必需营养元素等; 动物: 光、温度、氧气、水、食物和住所等)及直接减少、杀灭生物的途径。(2) 可控性分析: 分析在实际管理中必需因子能否被长期有效控制, 或者减灭方法是否长期有效,进而选定若干备选减控因子。(3) 可行性分析: 分析备选减控因子的负面效应及其与管理边界条件的相容性, 进一步筛选减控因子。(4) 成本分析: 比较上述减控方法的显性和隐性成本, 初步确定成本最低的为减控因子。(5) 开展大尺度实验和应用验证, 最终确定减控因子。
在我们的实验湖沼学基地, 有些营养添加实验池塘周边生长了不少湿生和挺水植物, 吸收了添加的营养, 严重干扰了实验。下面以我们对这些植物的成功控制经验为例说明减控因子的确定步骤(图 2):
(1)可控性分析: 由于面积不大, 可用石棉瓦等材料有效遮光。二氧化碳、温度和水难以控制。N、P和钾(K)等必需元素可能是限制因子, 因P易沉积、好控制, 选择P, 可通过控源和基底P钝化等方法控制。收割和除草剂法有效, 但需多次使用。尚无有效的生物控制法(寄生和牧食等)。
(2)可行性分析: 除草剂污染池塘, 影响实验, 不可行。
(3)成本分析: 用石棉瓦覆盖控光仅一次投入,成本低, 而控P和收割需持续进行, 成本高。
(4)应用验证: 2013年覆盖石棉瓦, 池塘边植物一直得到有效控制。
这个例子说明, 非限制因子也可成为减控因子,而限制因子不一定是减控因子。P很可能是湿生和陆生植物的限制因子甚至是终极限制因子[39], 但是几乎不可能通过降P抑制杂草和入侵种, 而是要使用机械、化学和生物控制手段[58,59]。
3 富营养化减控因子的分析与验证
3.1 减控因子分析
图3显示了湖泊富营养化减控因子的分析过程与结果。说明如下:
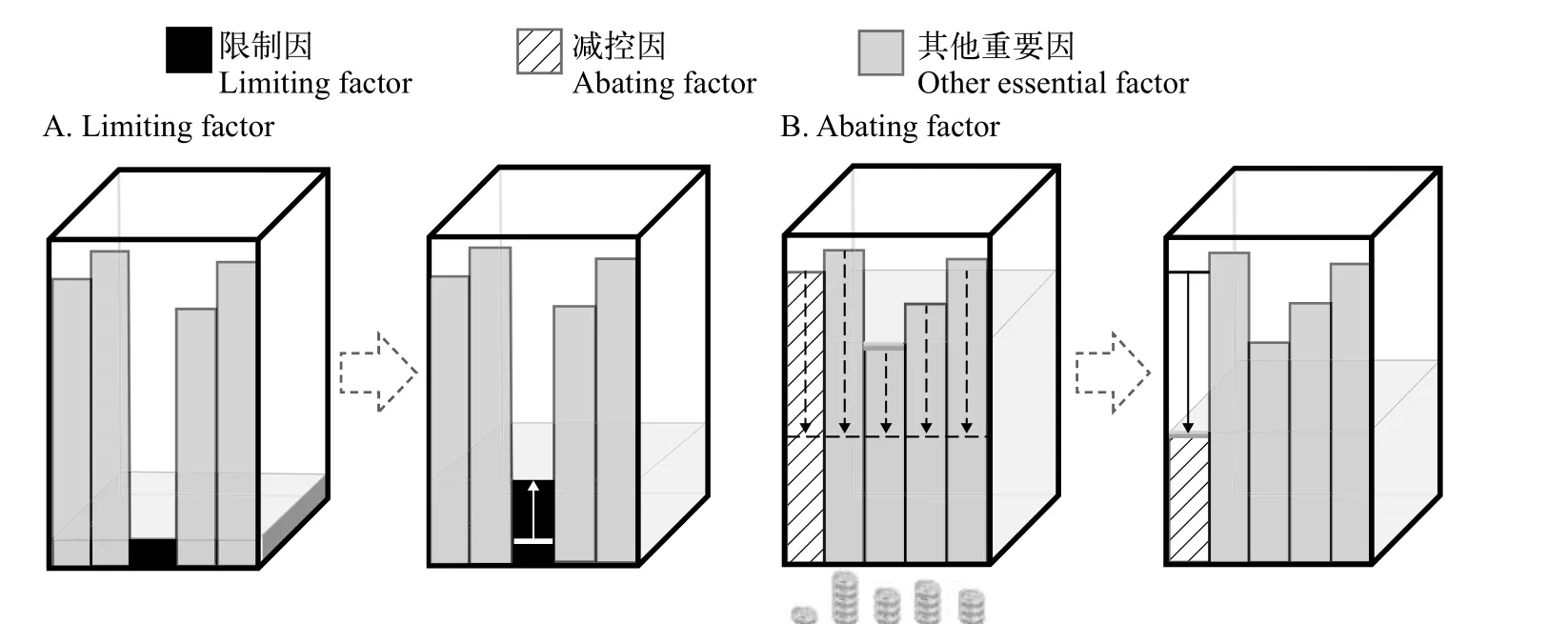
图1 限制因子(A)和减控因子(B)概念示意图(以具多板闸门的水箱说明)Fig. 1 Diagrams of limiting factor (A) and abating factor (B) concepts, each using a water box with a multi-boards gate
(1)必需性分析: 藻类有20种必需营养元素(大量元素C、氢(H)、氧(O)、N、P和硫(S); 微量元素钙(Ca)、镁(Mg)、钠(Na)、氯(Cl)、K、硅(Si)、铁(Fe)、锰(Mn)、钼(Mo)、铜(Cu)、钴(Co)、锌(Zn)、硼(B)和钒(V)[60]。直接减灭法详见后文6.4和6.5。
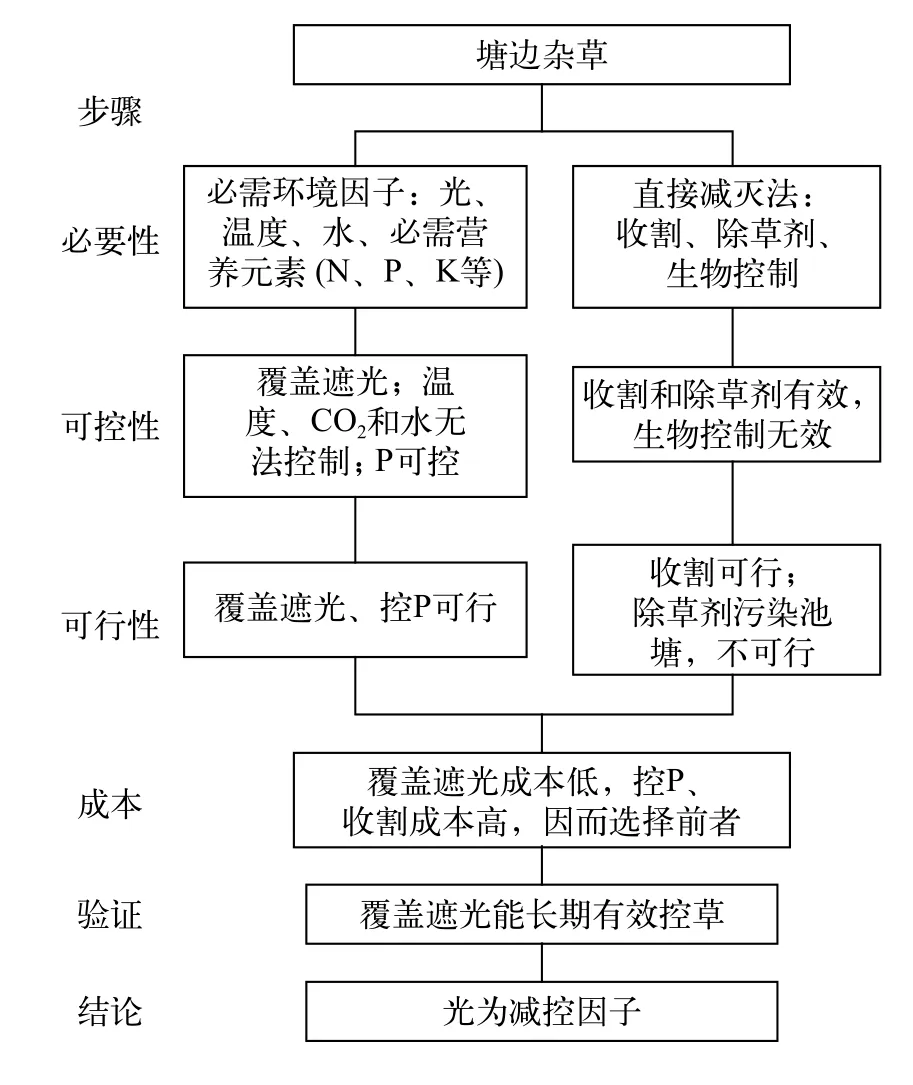
图2 池塘边杂草减控因子的确定步骤Fig. 2 Procedure to determine the abating factor of pondside weeds
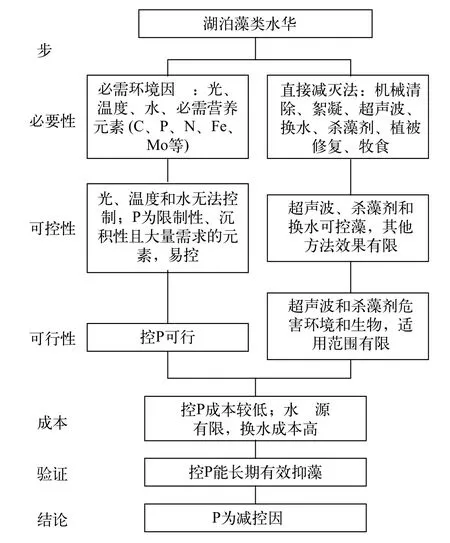
图3 湖泊藻类水华减控因子确定步骤[57]Fig. 3 Procedure to determine the abating factor of algal blooms in lakes[57]
(2)可控性分析: 显然, 在野外条件下, 光、温度和水无法控制。筛选易控的必需营养元素可通过三个步骤: (A)选择可能的限制性元素, 因为其含量一旦降低就可抑制藻类, 控制量较小。限制元素的候选者包括: (i) 在环境背景(如岩石圈)中相对含量与在生物体中相对含量比值最小的元素, 如P和Mo[12]; (ii) 水中含量接近或低于生物最小需求量的元素, 如P和N[61]; (iii) 生产量、生物量与环境营养含量紧密相关的元素, 如P和N[17]; (iv) 小尺度营养添加实验显示的限制元素, 如C、P、N、Fe和Mo[14,17,62,63]。(B) 选择沉积型循环元素(P、Fe和Mo), 因为易沉积, 可能易控制, 而气体型循环元素(C和N)可以从空气补充, 难以控制。(C) 选择大量元素(P), 因为微量元素需要量低, 控制它们至极低水平非常难。根据以上分析, 确定P为易控元素。在直接减灭法中, 机械清除只能清除表面水华, 对混匀的藻细胞无效; 絮凝沉降不适用于风浪大的湖泊, 对有些藻类无效, 且影响其他生物; 沉水植被修复只在低中营养水平的浅水湖泊有效; 动物牧食(经典生物操纵、滤食性鱼类等)只适用于低营养水平湖泊, 效果不稳定。
(3)可行性分析: 超声波和杀藻剂对环境和其他生物有较大的负面影响, 且需反复施用, 只能用于景观小水体等。
(4)成本分析: 换水所需净水的量很大, 成本高,且水资源有限, 在绝大多数湖泊不可能实施。
(5)实验和应用验证: 控P效果良好, 如下述。
3.2 全生态系统实验和湖泊治理验证
关于仅控磷就可控制富营养化的实验20世纪70—80年代, 加拿大实验湖区(49°N)开展了3个全湖实验, 证明仅控P就可控制富营养化。(1) 304号湖(3.62 ha)实验, 施肥期为1971—1976年。施肥前(1969—1970) 浮游藻类叶绿素a(Chl.a)为6.0—7.0 μg/L。1971—1972年, 每年添加0.40 g/m2的P, 5.2 g/m2的N(氯化铵)和5.5 g/m2的C(蔗糖), 随后[6个月后(夏季)]发生藻类水华, Chl.a达到23.5—25.0 μg/L。1973—1974年, 停止添加P, 只添加N和C, Chl.a降低至未施肥前的水平(4.5—8.0 μg/L)。1975—1976年再次添加P和N(硝酸钠), Chl.a再次上升, 至11.7—22.5 μg/L[3,64]。在停止施肥后, 水体总磷(TP)、总氮(TN)和Chl.a又迅速降低。(2) 226号湖(16.1 ha)实验, 施肥期为1973—1980年。该湖呈“8”字形, 被塑料隔板分隔为基本相同的西南和东北两个区。西南区每年添加1.92 g/m2的N(硝酸钠)和3.67 g/m2的C(蔗糖), 1973—1975年间浮游藻类总量基本不变, 浮游藻类生物量(BPhyt)为2.7(0.7—4.9) mg/L, Chl.a为7.0(6.5—8.1) μg/L, 但在1976—1980年, 由于隔板破损, P由东北区流入,TP由0.009(0.008—0.011) mg/L升至0.01(0.008—0.015) mg/L,BPhyt增加至3.4(1.2—7.6) mg/L, Chl.a增加至8.0(5.4—10.5) μg/L。在东北区, C和N添加率始终与南区相同; 每年添加0.34 g/m2的P(磷酸),蓝藻水华持续发生,BPhyt为6.1(1.2—15.8) mg/L,Chl.a为11.7(3.1—19.9) μg/L。在停止加P后, 藻类水华很快(1981年)停止,BPhyt降至2.0(1.8—2.3) mg/L, Chl.a降至4.0(3.1—5.5) μg/L[65—67]。(3) 302号湖(23.7 ha)实验, 施肥期为1982—1986年。该湖被分隔为南北两个区, 北区每年添加约4.2 g/m2的N(硝酸), 南区每年添加硫酸, 南、北区均不添加P。结果显示两区Chl.a和BPhyt均未增加, 只是由于pH的降低, 藻类组成发生了改变: 在南区, 当水体pH低于5.6时, 甲藻代替金藻成为优势类群, 当pH继续降低至低于5.3时, 硅藻和蓝藻消失; 在北区, 当水体pH低于6.0时, 藻类从金藻占优势转变为绿藻和腰鞭毛虫占优势。在北区停止施肥后, TN和-N迅速降低[3,68,69]。
我们在长江中游的湖北保安湖实验站开展了两个较长时间的实验, 进一步证明仅控P就可控制富营养化。(1)中宇宙实验, 实验为期9个月, 在体积约800 L的聚乙烯桶内开展。实验共设4个处理,即+N+P、-N+P、+N-P和-N-P (+为添加; -为不添加) , 其中+N-P处理中TN的目标浓度为2 mg/L,-N+P处理中TP的目标浓度为0.2 mg/L。结果显示:+N-P处理的Chl.a为4.17(0.68—13.42) μg/L,BPhyt为0.13(0.03—0.24) mg/L, 与-N-P处理的无明显差别,分别是+N+P处理的25.5%和13.1%。(2)全系统实验, 实验为期18个月, 在水域面积约500 m2的池塘中开展, 和上述实验设置了相同的4个处理, 其中+N-P处理中TN的目标浓度为2 mg/L, -N+P处理中TP的目标浓度为0.2 mg/L(自2011年7月TP目标浓度提高至0.3 mg/L)。结果显示: +N-P处理的Chl.a为23.6(1.6—58.0) μg/L,BPhyt为4.08(0.02—24.25) mg/L, 与-N-P处理的无显著差别, 其均值分别为+N+P处理的59.5%和47.6%[31](图 4)。

图4 长江中游池塘施肥实验(2010.12—2012.6)[57]Fig. 4 The fertilization experiment in the ponds in the middle Yangtze Basin (2010.12—2012.6)[57]
关于减氮不能控制浮游藻类总量的验证加拿大实验湖区(49°N)开展了两个全湖实验, 证明减N不能控制浮游藻类总量。(1)261号湖(5.6 ha), 施肥期为1973—1976年, 每年添加0.246 g/m2的P(磷酸)。Chl.a在施肥前的5年为1.9(0.1—3.4) μg/L, 施肥的4年间为6.4(4.3—8.9) μg/L; TN在施肥前为2.4(1.5—2.9) mg/L, 施肥后第3—4年明显上升, 至3.7—5.6 mg/L。夏季睡莲上附着鱼腥藻(Anabaenasp.)的固N量较高[3,70]。(2)227号湖(5.0 ha), 施肥期为1969—2014年。P的施肥量保持不变, 每年添加0.48 g/m2的P(1969年使用磷酸钠, 此后使用磷酸);N的施肥量逐步降低, 1969—1974年每年添加6.29 g/m2的N(硝酸钠), 1975—1989年添加2.4 g/m2的N,1990—2014年不添加; 施肥N/P由约12降至约5, 然后降至0。三个阶段浮游藻类总量均较高, Chl.a分别为32.2(15.5—59.0)、26.8(10.5—54.5)和23.9(12.0—35.0) μg/L。固N蓝藻自第二阶段前几周开始出现, 在20世纪80年代早期成为夏季优势种类,在第三阶段其生物量超过总量的50%。固N量也相应地从0增至0.64 g/(m2·y)(第二阶段), 至1.21 g/(m2·y)(第三阶段)。2011年的测算显示: 水华期固N量占湖上层外源N输入的69%—86%。减N前后TN变化不大, 三个阶段分别为0.77(0.46—0.95)、1.09(0.79—1.47)和 0.81(0.55—1.10) mg/L[1,30,70—72]。国外还有两个类似的实验, 一是英国的Seathwaite Tarn水库(54°N, 26.7 ha), 1992—1993年每年仅添加0.23 g/m3的P, Chl.a上升[73]; 二是加拿大的Far Lake(63°N, 3.7 ha), 1979—1981年每年仅添加0.1 g/m2的P(磷酸), 固N的附着生物和浮游藻类出现, 但可能由于施肥时间较短, 浮游藻类生物量和生产量增加不明显[3,74]。
我们开展的两个较长时间的实验进一步证明减N不能控制浮游藻类总量。(1)就中宇宙实验来说, -N+P处理的Chl.a为9.72(0.10—33.49) μg/L,BPhyt为0.49(0.01—2.26) mg/L, 和+N+P处理的相差不多, 分别是+N-P和-N-P处理的2.3—2.4倍和2.7—3.8倍。-N+P处理的TN虽然未能超过+N+P和+N-P处理, 但在整个实验的大部分时段都高于-N-P处理。实验结束时的N收支计算显示,-N+P处理的净自然N输入量是+N+P的1.4倍,-N-P的是+N-P的2倍[75](图 5), 说明减N导致净自然N输入量增加。(2)就全系统实验来说, -N+P处理的Chl.a为42.95(9.79—100.70) μg/L,BPhyt为10.83(0.16—75.66) mg/L, 与+N+P处理的相近, 其均值分别为两个未加P处理的1.6—1.8倍和2.7—3.6倍;-N+P处理的DPhyt是其他三个处理的2.1—3.0倍。-N+P处理的固N异形胞密度是+N+P的4.5倍, 异形胞较多时TN: TP为10—25; -N+P处理的TN逐步上升, 在实验的第4个月即与+N+P处理的TN相当, 随后甚至超过后者[31]。
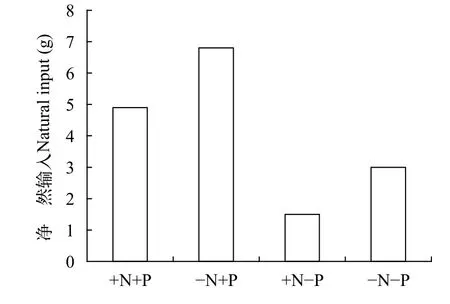
图5 长江中游中宇宙施肥实验的净自然氮输入(固氮量-反硝化量, 2010.12—2011.9)[75]Fig. 5 Net nitrogen inputs(fixed-denitrified N) in the fertilization experiment in the mesocosms in the middle Yangtze Basin(2010.12—2011.9)[75]
在我们的池塘实验中, -N+P处理的TN和异形胞数量均在数月内达到了较高水平[31]。在加拿大实验湖区, 261号湖在添加P肥的第3年TN才开始出现明显上升[65]; 在 227号湖, 减N后第5年异形胞数量才达到较高水平[1]。这说明亚热带水体的固N速率比温带高, 其原因应归于两个区域间的温度差异。本实验所在区域(30°N)的年均气温约19℃, 湖水表面一般不结冰, 而加拿大实验湖区(49°N)的年平均气温约3℃, 每年仅5—10月为无冰期。研究表明, 固N酶活性在5—15℃随温度上升缓慢升高,15—30℃快速上升, 随后下降[76—78]; 温度较高时湖泊固N速率比较低时高出数倍[70,79]。
湖泊治理验证在高纬度地区(42—59°N),已有不少集中控P即可遏制湖泊富营养化的成功案例[3,80], 如Lake Washington[2,18—20]、Lake Erie[81]和Lake Zürich[82]。下面简述4个代表者:
(1) Lake Mälaren(59°N, Sweden)[83,84], 该湖包括许多湖区, 总面积达1120 km2, 包括3个区: Galten区(61 km2)、Björkfjärden区(340 km2)和Ekoln区(30 km2)。20世纪60年代时, 该湖已严重富营养化,每年6—9月蓝藻水华持续发生。在1966—1973年间, Galten区的TP为0.067 mg/L, TN为1.3 mg/L,BPhyt为6.3 mg/L; Björkfjärden区的TP为0.03 mg/L,TN为0.7 mg/L,BPhyt为0.9 mg/L; Ekoln 区的TP为0.093 mg/L, TN为1.4 mg/L,BPhyt为3.1 mg/L。自1975年开始控制P和其他工业废水的排放, TP开始下降, TN仅在Galten区有所下降, 但各湖区藻类总量都开始下降, 蓝藻水华仅在每年夏末短时间出现。1985—1995年, Galten区的TP为0.05 mg/L, TN(1980—1983)为0.9 mg/L,BPhyt为3.9 mg/L; Björkfjärden区的TP为0.022 mg/L, TN(1980—1983)为0.7 mg/L,BPhyt为0.6 mg/L; Ekoln区的TP为0.055 mg/L,TN(1980—1983)为1.8 mg/L,BPhyt为1.3 mg/L。
(2) Lake Constance(49°N, Germany)[85,86], 该湖面积达473 km2。在20世纪30年代, 该湖为贫营养状态, TP小于0.002 mg/L。1951—1981年, 大量城市和工业污水排入湖中, 1979年时TP达0.087 mg/L,Chl.a约6 μg/L, 以隐藻和硅藻为主的水华频发。从1959年开始实施控制外源P输入的治理工程, TP开始下降, 自2000年后富营养化基本得到控制。至2007年时TP降至0.076 mg/L, Chl.a降至约2 μg/L, 水华现象不再发生。达213 km2。从20世纪60年代开始,由于受农业和
(3)LakeMaggiore(46°N,Sweden)[87],该湖面积工业污染影响, 湖泊面临富营养化问题, 至1976年TP为0.013 mg/L,-N(该湖TN的主要成分)为0.76 mg/L, 1981年(首次检测)Chl.a为5.51 μg/L。从1976年开始以控P为主的治理工程, 到1990年湖泊恢复到污染前水平。此时,-N较治理前没有明显变化, 为0.78 mg/L, TP降至0.008 mg/L, Chl.a降至4 μg/L。
(4) Moses Lake(47°N, 美国华盛顿州)[88]。该湖面积29 km2, 平均水深5.6 m。20世纪70年代前高度富营养化, 1969—1970年湖水TP为0.15 mg/L, TN为1.2 mg/L, Chl.a为52 μg/L。1977—2001年大量引水至入湖溪流, 加上流域治理, 使入流TP和TN分别从约0.15和1.2 mg/L(1969—1970)下降至0.03和0.4 mg/L(2001)。虽然引水中TN/TP较高, 但固N蓝藻束丝藻(Aphanizomenon)仍长期占优势直至内源P释放停止。2001年, 湖水TP、TN和Chl.a降至0.01 mg/L、0.13 mg/L和17 μg/L。
美欧用化学药品钝化湖内活性P, 有不少成功案例。例如美国北方湖泊用铝盐钝化沉积物P的效果表明: 在6个浅水湖泊(无温跃层), 施用铝盐5—11年后, TP和Chl.a分别下降了48%和40%; 在7个深水湖泊(有温跃层), 5—18年后 TP和Chl.a均下降了42%[89]。又如: 荷兰的Lake Rauwbraken(51.5°N,4 ha)使用聚合氯化铝和锁P剂对水柱和沉积物P沉降钝化, 5年内湖水平均TP下降了92%(0.169—0.014 mg/L), Chl.a下降了81%(19.5—3.7 μg/L)[90]。这些湖内P钝化实践是很好的全湖实验, 再次证明只控P就可控制富营养化。
在亚热带地区, 也有一些类似的案例。(1) 杭州西湖(30°N), 自1986—2011年以来, 以引水和削减外源为主的综合治理使湖水TP均值下降了58%—76%(0.12—0.04 mg/L), TN只下降了7%—9%(2.5—2.3 mg/L), 而Chl.a降低了69%—94%(160—30 μg/L, 图 6)[91—101]; 斯皮尔曼相关分析显示全湖Chl.a的变幅与TP的变幅显著正相关(r=0.68,P=0.004,n=14), 而与TN的变幅无关(r=-0.4,P=0.13,n=14); 引水后蓝藻密度占比有所下降, 绿藻占比有所增加, 且藻类种类数有所增加[102]。(2)美国的Lake Apopka(28°N), 1994—2004年的外源削减使TP下降了54%(0.23—0.11 mg/L), 而TN只下降了26%(5.3—3.9 mg/L), 结果Chl.a还是下降了37%(94—60 mg/L); 回归显示Chl.a与TP关系较强[103]。
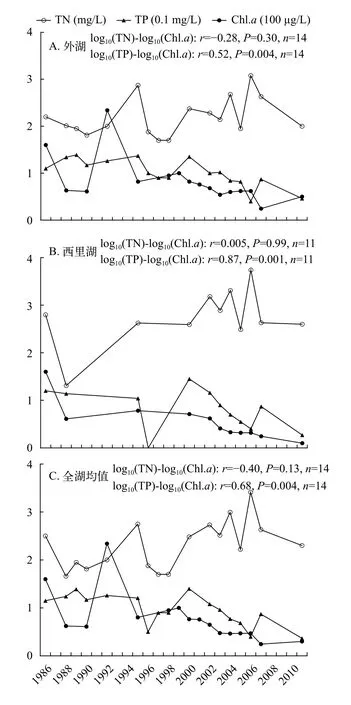
图6 1986—2011年西湖的外湖(A)、西里湖(B)和全湖(C)的总氮(mg/L)、总磷(×10-1 mg/L)和叶绿素a(×102 μg/L)的变化Fig. 6 Changes in total nitrogen (TN, mg/L), total phosphorus(TP, ×10-1 mg/L) and phytoplankton chlorophyll a (Chl.a, ×102 μg/L) in the two subareas, Waihu (A) and Xilihu (B), and the whole lake (C) of Lake Xihu (1986—2011)
海洋和陆地生态系统的佐证根据中小尺度的营养添加实验, 以及较高盐度(>10‰—12‰)水域浮游异形胞固N蓝藻少或无的现象, 不少学者认为N是河口和海洋浮游藻类的限制因子, 因而应采用N、P皆控策略控制富营养化[5,6,41,104—106]。但是这个观点缺乏足够的证据。首先, 限制营养并不一定是减控因子。其次, 实验尺度太小, 最大的是仅13.1 m3中宇宙, 持续时间9周[107]。第三, 近期研究表明: 海洋非异形胞丝状蓝藻(如束毛藻Trichodesmium)和单细胞蓝藻(如黏球藻Gloeocapsa)的固N贡献相当可观, 少数种类在有氧条件下也能固N[108—111]。近海(包括高盐度水)沉积物异养微生物固N率远高于过去的估算, 可达反硝化率的8倍, 使沉积物从N汇变为N源[112—114]。事实上, 在低盐度的斯德哥尔摩河口区, 已通过集中控P成功地控制了富营养化[1]。
Cole和Heil[115]提出了N与P平衡假说, 即: 若时间足够长, 任何生态系统中生物活性N的水平将与生物活性P的供给相平衡。该假说在水生态系统上已得到了证实(如上述), 在陆地生态系统上也得到相当多证据: (1)土壤母质的P含量及风化程度(后者关乎P的可利用性)决定土壤的N(和有机碳)含量[116,117],土壤P含量对N含量有很高的预测能力[118]; (2)仅施用P肥可增加土壤N含量, 如新西兰某天然草地施用过磷酸钙25年, 添加1 kg的P平均增加5.7 kg的N[116]。(3)添加P可显著增加根瘤数量和含N量[119]、豆科植物的含N量[120]。(4)火烧后草原的可利用P增加, 固N蓝藻生物量和固N酶活性随之增加, 美国大草原估算的固N量为21 kg/(ha·y)[45]。(5)蓝藻型地衣的固N量相当可观[121]。(6)在生物可利用P较缺乏的土壤发育早期和晚期, 森林落叶中添加P可显著增加异养固N菌的酶活[122]。不过, 由于陆地生态系统的初级生产者寿命长, 且N和P的生物可利用性较难量化, 目前还没有类似于淡水的全系系统实验证据。
4 控氮观点的逻辑和实验错误
4.1 用不恰当的方法确定限制因子, 进而错误地推定减控因子
营养添加实验的原水来自于富营养化水体中小尺度的营养添加实验的原水一般来自于研究水体, 而有些水体已经富营养化。例如, Xu等[122]和Paerl等[124]的原位挂瓶实验所用太湖超富营养化的原水, TP、TN和Chl.a分别达0.09—0.21 mg/L、2.0—4.9 mg/L和28—110 μg/L。又如, Kolzau等[125]室内培养实验从4个德国湖泊所采原水的TP、TN和Chl.a分别达0.03—0.10 mg/L、0.6—1.5 mg/L和15—61 μg/L。这样的实验设计显然不符合逻辑。实验目的是查明导致水体浮游藻类过度繁殖的营养因子, 故实验应基于富营养化前的状态, 至少实验原水应采自接近富营养化前状态的水体。基于富营养化原水的营养添加实验至多只能预测营养负荷继续增加时富营养化水体的反应。这些实验结果一般显示为N限制或N和P限制[122,125], 因为TN/TP随营养水平(TP和Chl.a)增加而下降[126—128]。系列研究发现: 无论外源输入的TN/TP如何, 伴随富营养化的低氧至无氧状态加剧反硝化作用, 使脱N量达TN输入的42%—64%(湿地和湖泊均值), 却促进内源P释放, 从而降低水柱的TN/TP[129—133]。
用小尺度的营养添加实验判定限制因子大部分营养添加实验的时空尺度较小, 可分为瓶生物测试和围隔实验两类。实际上, 这类实验只能判定近期限制营养, 更不能判定减控因子。
瓶生物测试是在盛有藻类培养或水体原水的封闭瓶中进行, 实验时间为几个小时至几天。这种实验系统过度简化, 且时间太短, 不能模拟与空气的气体交换、固N等长期过程。20世纪60—70年代有研究者用瓶生物测试(以及小型中宇宙实验)显示C是限制因子, 认为需要控C, 而不是P, 但仅加C和N的全湖实验显示藻类总量没有变化, 而仅加P的全湖实验表明从水气界面输入的二氧化碳能够较快弥补C的不足, 从而使藻类总量达到与P相当的水平[1,3,29,71]。同样, 瓶生物测试常常显示N限制[122],进而认为需要控N, 但是仅加N的全系统实验显示藻类总量没有增加, 而仅加P的全系统实验显示生物固N以及大气沉降、地表径流、N再生利用和反硝化速率降低等过程能够弥补N的不足[3]。
中宇宙实验包括原位围隔实验和异位模拟实验, 实验时间常为几天至几周。这种实验有难以克服的缺点, 如: 空间尺度小, 不能容纳各类生物, 特别是捕食者和夜间活动动物; 时间尺度小(着生物过多、渗漏等原因), 不能准确评价对慢反应生物和生物地化过程的影响; 切断了沿岸带-浮游区和流域-水体等重要相互作用。因此, 中宇宙实验的结果多难以外推到真实水体[134]。若实验设计能恰当模拟小尺度的生态过程, 中宇宙实验也可得到有价值的结果, 但仍需全系统实验和野外观测的最终验证。就营养添加实验而言, 虽然可通过水气界面向水体补充N, 但由于时间太短, 难以完全弥补N的不足[134], 导致实验显示P限制, 如加拿大实验湖区和丹麦湖泊的原位围隔实验[135,136]。因此, 中宇宙实验显示的依然是近期限制营养因子。
用氮磷比假说推断限制因子通过对N和P与Chl.a关系以偏概全的归纳, Sakamoto最早提出氮磷比假说, 认为N/P较大时藻类受P限制,TN/TP较小时受N限制, TN/TP中等时受二者共同限制。随后不少学者效仿, 试图通过比较不同TN/TP下Chl.a/TP和Chl.a/TN的大小以及N和P对Chl.a变异的解释率来分析藻类营养限制类型, 但这些研究均缺乏严格的统计检验。依据在长江流域40多个不同类型湖泊的多年调查结果, 我们系统深入地分析了TN、TP与Chl.a的关系。首先, 依据Sakamoto提出的TN/TP阈值将湖泊分为三个组, 比较lg(TN)、lg(TP)与lg(Chl.a)的回归关系, 发现各组TP对Chl.a变异的解释率(R2)和预测能力(百分误差率)均高于TN。然后, 进一步比较全部TN/TP范围内TP和TN对Chl.a变异的解释率, 发现两者之差与TN/TP无关, 且在70%的数据组中TP对Chl.a的解释率高于TN。最后, 分析lg(Chl.a/TP)与lg(TN/TP)、lg(Chl.a/TN)与lg(TP/TN)的回归关系, 发现在给定TP时Chl.a变化不受TN的影响, 即Chl.a/TP趋向于一个定值, 而在给定TN时Chl.a随TP浓度的上升而迅速增加。因此, 我们的研究彻底否定了以TN/TP为指数来判别藻类营养限制类型的传统观点。
想当然地把限制因子当作减控因子基于小尺度营养添加实验以及被否定的氮磷比假说, 研究者发现有些水体存在N限制和P限制季节性交替出现的现象, 或者N和P共同限制。虽然至多只能判定近期限制营养, 但研究者多据此推定终极限制因子和减控因子, 认为需要控N[5—9,106,122,137]。显然,这是错误的。
4.2 依据短时间尺度的证据, 认为固氮不能弥补N的不足
有些学者认为, 有些湖泊的浮游异形胞藻类年固N量低, 反硝化作用较强, 固N不能弥补N的不足[8,106,137,138]。这种观点缺乏生态系统尺度的长期实验证据[139]。只要每年的N净增量大于零, 在足够长的时间内就一定能够弥补N的不足。除浮游异形胞藻类固N外, N的输入项还有着生异形胞藻类、浮游无异形胞藻类和异养细菌固N[109,110,140]、闪电固N以及地表径流输入等; 除渔业产品和出水外,N的输出项主要是反硝化, 其速率随N输入量减少而减少[129]。因此, 湖泊可通过固N和减少脱N弥补N的不足。尽管高纬度湖泊的固N酶活性较低[31],但在加拿大实验湖泊的227湖, 在减N和停N的40年间(1975—2014年), TN和Chl.a一直维持在与P相当的水平[1,30,72]。在低纬度湖泊, 弥补N不足则较快。在我们仅加P的池塘中, TN和Chl.a在数月内就达到了与P相当的水平。值得一提的是, 在中宇宙实验中, 虽然仅加P处理没有异形胞固N藻类, 但所获得自然N补给(自然输入-反硝化)是其他三个处理的1.4—4.5倍, 这只可能归因于脱N量降低和其他生物固N。同样, 关于河口和近海固N不能弥补N不足的观点也没有足够的证据(详见前文)。
4.3 认为重污染湖泊内源负荷P难以控制, 因而需要控N。
有些学者以湖泊内源P负荷难以控制为由反对集中控P[5,8,106]。内源P消减确实是一个缓慢的过程, 外源控制10—15年后才停止释放[141]。但是, 这并不能成为控N的理由, 因为若不能有效控制内源P释放, 在水力滞留时间较长的湖泊中控N的努力将被生物固N和减少脱N所抵消。这已为我们和加拿大仅加P的实验所证明, 只是P源不同而已。
若湖水滞留时间较短, N的累积滞留量较小, 则大幅度减N可在一定程度上降低重富营养湖泊的藻类总量, 但根治富营养化仍需控P。例如, 德国柏林的Lake Müggelsee, 面积7.3 km2, 平均水深4.9 m, 水力的滞留时间只有6—8周; 与1979—1990年相比,1997—2003年的外源P、N负荷分别减少52%[5.9—2.8 g/(m2·a)]、67%[138—45 g/(m2·a)], 但夏季TP和TN分别只减少20%(231—185 μg/L)、42%(1880—1090 μg/L), 因为夏季内源P释放降低了TN/TP(<7.2),进而诱导固N蓝藻水华(Aphanizomenon flos-aquae);夏季浮游藻类生物量减少了55%(15.9—7.2 mm3/L),与夏季TN和春季TP显著相关, 与夏季TP不显著相关, 春季生物量与TP显著相关; 因此, 若不进一步控P, 该湖仍将处于富营养状态[142]。
5 高氮的生态效应及放宽控氮的限度
5.1 高氮的生态效应
对水华类型的影响在高N、P负荷比和高无机N浓度等条件下, 富营养湖泊易发产毒的微囊藻等非固N蓝藻水华[143,144]; 在低N、P负荷比条件下, 春季常发生固N蓝藻水华(有的产毒), N累积后的夏季也常发生非固N藻类水华[1,31,145]; 因而放宽控N或可延长非固N蓝藻水华的持续时间。由于浮游藻类和水华蓝藻总量取决于TP[146—148], 且各类水华均有较大危害, 故只有控P才能根治水华。当然,若不考虑成本, N、P皆控或有助于控制非固N蓝藻水华。
对水生动物的影响对无脊椎动物和鱼类的小尺度实验表明, 氨和亚硝酸根()存在一定的毒性, 而硝酸根()的毒性较弱[149—152]。氨的有毒形态是游离的分子态氨(NH3), 而离子态铵()无毒或微毒[153]。NH3可破坏水生动物的鳃黏膜, 影响动物的输氧、ATP产生、渗透调节和免疫等生理活动等[152]。除可使鱼类等动物体内组织缺氧而导致死亡外, 还可引起动物体内电解质失衡、膜电位变化,影响骨骼肌收缩和心脏功能等[154—157]。天然水体中的浓度一般很低,实际毒性很小。自身无毒, 只是在生物体内转化为后才有毒[152]。
鉴于氨对水生动物的潜在毒性效应, 美国环保署给出了很严格的地表水氨氮浓度基准[158], 急性暴露和慢性暴露的总氨(TAN)限值分别为17 mg·TAN/L和1.9 mg·TAN/L(以N计的标准化总氨浓度,pH=7, 水温=20℃)。然而, 该基准所依据的实验均在室内纯水条件下开展, 持续数天或数周。这种实验在方法的标准化和结果的可比性等方面很有优势, 但难以反映自然条件下氨对水生动物的真实效应。为此, 我们在池塘中以鲢、鳙和鲫为对象开展了为期1周年的全生态系统实验[159]。10个池塘中TN的梯度为0.8—41.2 mg/L, TAN的梯度为2.6—113.8 mg/L, NH3为0.01—0.54 mg/L, 高N实验池的浓度达到甚至超过了这几种鱼的半致死浓度(TAN: 22.3—120.3 mg/L; NH3: 0.33—0.73 mg/L)。然而, 在高N池塘未见鱼死亡, 且生长速率明显高于低N池塘。 从这三种鱼的生长和存活来看, TN、TAN和NH3的无观察效应浓度分别约为41、114和0.5 mg/L。湖库河流的氨浓度一般远低于高N池塘的, 因此野外条件下氨对鱼的存活和生长一般没有负面影响。
对水生植物的影响关于对沉水植物影响,小尺度实验显示有胁迫作用, 而大尺度实验和野外调查显示水下光照充足时高N和高均没有明确的负面效应。急慢性实验显示: 当-N>1 mg/L时, 铵对沉水植物有生理胁迫效应, 包括降低光合速率、影响C、N代谢和加速体内抗氧化反应等[160—165], 但植物具有解毒机制, 即可利用碳水化合物将组织富集的转化为游离氨基酸等物质[166,167];对植物无负面影响[168,169]。5个月的中宇宙(1 m深, TP≈0.024 mg/L)实验表明,-N和-N分别为10mg/L的处理对苦草生长和繁殖均无影响[169]。丹麦的湖泊调查[170,171]显示,若TP>0.1—0.2mg/L,TN为1—2mg/L的水体无沉水植物, 但若TP<0.1 mg/L,植物与N的关系不明显;有报道[172,173]称高N可降低沉水植物物种多样性, 其实应归因于高P。通过3—18个月的全生态系统实验(池塘TP:0.02[0.005—0.059 mg/L, 中值(范围)], 我们发现: 莲座型的苦草在TN和-N分别达到12和6 mg/L时仍能良好生长, 且快速生长季对高N的耐受性更高; 冠层型的菹草较苦草具有更高的高N耐受性;在所有处理池塘(TN: 1.5—23.7 mg/L,-N: 0.7—10.5 mg/L), 苦草种群均呈扩增趋势; 狐尾藻种群在次高浓度组(TN:16.7mg/L,-N: 5.0 mg/L)及其以下扩增, 但在最高浓度组未扩增[174—176]。以上研究说明, 在天然水体中, 若TP较低(TP<0.1 mg/L), 高TN(12—17 mg/L)和-N(5—6 mg/L)对沉水植物没有明显的负面效应,因为水下光照充足,植物可通过合成充足的碳水化合物来解除NH+4的毒性。富营养水体沉水植物衰退的主因是高P导致藻类增多, 进而对植物产生弱光胁迫; 所见N与植物的负相关性只是间接反映了N与P的相关性。
据报道, 在英国泥炭湖泊[SRP(溶解反应性磷)高达0.22(0.04—0.53 mg/L)], 高N(NO3-N>6—12 mg/L)可降低芦苇(Phragmites australis)根茎比,导致植物倒伏[177]。除特高的P和N氮浓度外, 倒伏很可能还与该类湖泊基底松软有关。在巢湖西部的蓝藻水华堆积区, 在黏土上种植的芦苇等挺水植物生长良好, 形成的种群已延续多年。迄今, 尚无我国富营养水体挺水植物倒伏的报道。
对内源磷释放的影响和对内源P释放的影响有所不同, 前者超过阈值后有促进作用, 后者则主要是抑制作用。我们2个月的中宇宙添加实验表明: TN<5.3 [0.3—12.8 mg/L, 中值(范围)]、-N<3.2(1.6—7.2) mg/L时, 内源P释放不明显; 当TN>10.9(4.9—29.3) mg/L、-N>7.4(4.3—15.6) mg/L时, 内源P释放明显[52]; 一年的池塘添加实验发现: TN<7.1(0.3—26.6) mg/L、-N<0.7(0.1—8.2) mg/L时, 内源P释放不明显, TN>12.8(1.0—59.3) mg/L、-N>0.8(0.1—8.4) mg/L时, 内源P释放明显(作者未发表数据)。N/P增高导致碱性磷酸酶活性增加是高N促进内源P释放的主要机制[52]。国外研究表明-N浓度超过1—5mg/L时抑制内源P释放,其机制是升高氧化还原电位从而增强滞留P的能力[178—182]。我们3个月的中宇宙-N添加实验发现: TN≥5.8(0.9—8.4) mg/L、-N≥3.4(0.1—7.8) mg/L时,内源P释放被阻止; 但停止添加后, 随着的消耗殆尽, 高N处理组(TN≥10 mg/L)的内源P显著释放(作者未发表数据)。综上可知, 使内源P不释放的TN阈值为5—10 mg/L。
对大气和陆地的影响过多的活性N有增多温室气体(氮氧化物和氨气)、参与雾霾形成、导致陆地土壤酸化和生物多样性下降等副作用[4,183]。有报道指出过量的N肥释放氨气, 是我国华北雾霾形成的重要原因之一[75]。因此, 需要减少N肥的使用量。这与本文放宽控N的观点并不矛盾。我们主张放宽的是已进入废水和地表水的N化合物, 其在污水处理系统和自然水体中均需经过挥发、硝化和反硝化等过程, 最终产物基本一致。并且, 全球污染河湖的N量只占人工固N总量(221 Tg/y, 包括化石燃料燃烧)的百分之几[4]。因此, 水体放宽控N不会影响大气和陆地生态系统。
对人体健康的影响过量的离子可导致蓝婴综合征等疾病。但是,-N的安全浓度很高, 达10—20 mg/L。地表水的-N一般远低于安全值, 某些农业区地下水的可能超过[183]。
5.2 放宽控氮的限度
如上所述, 我们的全生态系统实验表明, TN、TAN和NH3对鱼的无观察效应浓度分别约为41、114和0.5 mg/L。沉水植物对TN的无观察效应浓度为12—17 mg/L,-N的为5—6 mg/L; 沉积物P释放对TN的无观察效应浓度为5 mg/L。因此, TN和-N的安全浓度均初步定为5 mg/L, 其适用范围有待在更多的地区和更大的水域进行验证。
按照我国的地表水环境质量标准(GB 3838-2002), Ⅰ—Ⅴ类水的TN标准限值分别为0.2、0.5、1.0、1.5和2.0 mg/L,-N的为0.15、0.5、1.0、1.5和2.0 mg/L。显然, 这个标准过于严格, 导致有些水体仅因为N超标就被判定为不达标。我们建议分两步放宽N的标准限值, 首先把所有水质标准的TN和-N均放宽至2 mg/L, 同时观测实际效果,然后逐步放宽至5 mg/L左右。
6 富营养化的系统治理对策
综上所述, 富营养化的实质是TP过高导致的藻类过度生长, 其影响因素不仅包括营养输入, 也包括物理、水文和生物等因素。在浅水湖泊, 富营养化问题表现为从沉水植被占优势的清水稳态向浮游藻类占优势的浊水稳态转换。沉水植被具有减少沉积物再悬浮、吸储营养和为食藻浮游动物提供躲避鱼类摄食的避难所(后者仅适用于温带水体)等功能。在中等水深和中等面积的浅水湖泊中,TP低于0.04—0.06 mg/L为清水稳态, 高于0.08—0.12 μg/L时为浊水稳态, 中等P浓度时存在两种状态。水深影响TP阈值, 超过下限(3—4 m)时阈值明显下降, 低于上限(1—2 m)时阈值大幅度上升[184]。在深水湖泊, 底层缺氧导致内源P释放与否可使水体浊清两种备择稳态[185,186]。因此, 富营养化治理必需采取系统对策, 以修复物理、化学、水文和生物完整性。
6.1 湖盆物理完整性维护
由于围垦、房地产开发、道路建设和泥沙淤积等原因, 许多湖泊的面积和容积锐减, 湖滨带普遍堤岸华和硬质化。湖盆减小可导致环境容量降低、污染物浓度上升, 并可因调蓄能力下降导致水位波幅过大而破坏水生植被。湖滨带退化导致植被衰退, 从而丧失对污染物的拦截和消减能力。因此, 维护湖盆的物理完整性(大小和形态)是湖泊生态系统管理的前提。
6.2 污染源控制
相对于湖泊水柱而言, 污染源分为来自流域的外源污染以及来自沉积物的内源污染。
外源磷控制外源污染总量控制是当前国际上最受认可和最为有效的水环境管理技术。例如, 根据1972年修改的清洁水法, 美国开始实施TMDL计划。TMDL是最大日负荷总量(Total maximum daily load), 为水体持续达到水质标准允许的某种污染物的最大接纳量, 亦称负荷容量(Loading capacity), 时间单位可为日、月、季或年。计算公式为: TMDL = ΣWLA + ΣLA + MOS, 式中: WLA(Wasteload allocation)为某现存或未来点源污染负荷配额, LA(Load allocations)为现存或未来的非点源及环境背景配额, MOS(Margin of safety)为安全边际, 即为污染负荷与水质关系的不确定性而保留的负荷配额。TMDL须考虑季节变化, 以使水质全年达标。
TMDL的实施步骤包括: (1)确定导致水体受损的主要污染物(如P); (2)确定量化的水质指标(如Chl.a和TP)和水质目标; (3)分析污染源的类型、位置、通量及季节变化; (4)确定负荷容量。首先, 根据污染负荷及其生态效应的季节变化, 确定容量分析的时间尺度和时段划分。水交换较慢的湖泊等水体对负荷的短期变化不敏感, 可采用较长的尺度(如年), 而对溪流和河流等则应采用较短的尺度(如日)。然后, 建立污染负荷与水质响应的耦合模型。优先采用简单实用的稳定态的经验模型(如Vollenweider的P模型[187], 或根据历史数据建立); 若不能满足需要, 再考虑采用模拟模型等。最后, 根据水质目标计算全年及不同时段的负荷容量。(5)分配污染负荷。根据各类污染削减的边际成本, 确定最小成本分配方案。污染背景值可根据参照水体或历史数据确定。安全边际可通过隐性或显性法纳入, 前者对水质目标、污染负荷和削减效率等参数采用保守值, 后者则直接给定配额(如容量的10%)。(6)实施TMDL方案, 同时开展监测与评价,以及时调整方案[188]。
内源磷控制内源P负荷量分为毛负荷量和净负荷量(扣除沉积量)。测算方法大致有两种[189]:(1)直接测定法, 即通过测定不同区在缺氧等释放期的P释放速率计算, 所得结果为毛内源负荷; (2)间接测定法, 即通过P收支及P滞留率的经验模型计算内源P负荷。若缺乏两者所需系统数据, 可用TP的季节变化(如深水湖泊的夏季湖下层和秋季混合期)加以粗略估算。在计算水柱中内外源负荷总量时, 只能用净内源负荷与外源负荷相加, 否则就重复计算了沉积量, 这一点值得特别注意。
若从湖泊形成之初看, 几乎所有内源污染均来自外源污染。控制内源的根本措施是削减外源。据统计, 无论湖泊深浅, 控制外源10—15年后内源P释放停止[141]。若在预定的修复期内内源P负荷所占比重较大, 使修复目标难以实现, 则应采取控制措施。
沉积物P的赋存形态复杂多样, 有多种分级方法。Søndergaard等[190]将沉积物P分溶解态P以及颗粒态的铁P、铝P、钙P、黏土P和有机P。影响内源P释放的主要因子是P化合物的种类和含量及稳定性、P吸附剂的种类和含量及结合力、氧化还原电位、pH、温度; 在还原条件下, 铁P释放, 而铝/钙P稳定;pH过高或过低致铝/铁/钙P等释放;高温促进P释放[190—192]。-N、风浪导致的再悬浮、底栖动物扰动和沉水植物等因子对P释放存在抑制或促进两种可能[190]。高N/P等生态化学计量特征可诱导微生物及磷酸酶活化有机P和无机P, 导致P释放[52,193—195]。内源P湖内控制的关键是将P形态由弱稳定的转化为强稳定的。
若外源污染已得到有效控制, 则可采取措施控制内源P负荷。主要方法有四种: (1)钝化(Inactivation)。用固P剂沉淀固定水柱和沉积物中的P。传统的固P剂是铝、铁和钙的化合物[196]。美国和欧洲主要使用硫酸铝, 其水解形成聚合Al(OH)3, 吸附大量无机P; 效果不受无氧和低氧的影响; pH为6—8时效果最佳, 可用铝酸钠等调节; 铝盐施用剂量计算有三种方法, 分别依据碱度、净内源P负荷和活性P[197,198], 后者为: 铝的重量=沉积物活性无机P(弱结合态P(氯化铵提取)+铁P)×100[199]。虽然所用铝剂在酸性条件下会产生有害态铝[Al(OH)2+和Al3+], 但可通过在软水中适当施用缓冲物质加以控制, 大量实际应用已证实了该法的生态安全性[196]。对美欧114个湖泊(面积3—725 ha, 平均水深1.2—15.7 m)的统计显示, 铝法固P效果持续很长, 在多混合浅水湖泊平均为5.7年, 在分层深水湖泊为21年[199—201]。铁盐(氯化铁、硫酸铁等)固P的最佳pH为5—7, 且需处于氧化状态。钙化合物(碳酸钙、氢氧化钙)固P的最佳pH为>9。与铝法比, 铁、钙两法的效果更易受环境的影响, 有效时间短得多[196,200]。20世纪末, 澳大利亚推出了锁P剂(Phoslock), 主要成分为氧化镧和膨润土, 但商品价格很高[202,203]。(2)覆盖(Capping)。添加清洁的泥沙、碎石、矿物和固废等屏蔽沉积物, 吸附固化内源P[204—206]。由于导致容积变小, 该法难以应用于湖泊, 多用于海洋以屏蔽难降解污染物。(3)氧化。针对缺氧导致的内源P释放, 可采用充气和添加氧化剂两种方法[196,197]。Riplox法所用氧化剂是硝酸钙(被反硝化), 常配以氯化铁和氢氧化钙[207], 但至今应用不多, 尚需进一步研究。(4)清淤。主要有机械清淤(干挖、湿挖)和水力清淤(绞吸等)两种方式[196,197]。在我国, 内源污染控制主要采用清淤法。若淤积致水太浅、沉积物含难降解毒物, 则清淤是必需的。但若以移除P素为目的, 则成本比钝化等方法高出好多倍, 且堆场难寻。铝剂钝化法在美欧得到长期广泛应用, 应该作为内源P控制的首选方法。
6.3 水文调控
在流域层次上, 增加流域和环湖带的水力滞留时间能有效削减面源污染[208]。方法包括: 增加森林和草地、湿地和低洼地, 构建水滨缓冲带, 优化农业结构等。可根据面源负荷削减目标, 确定各类湿地和绿地的面积和宽度需求, 进而优化土地利用空间格局。
在湖泊层次上, 水文调控有2个目的, 一是降低P浓度和冲走藻类, 二是恢复水生植被。主要三种方法: (1)稀释与冲藻。前者引入低营养水以稀释P浓度, 后者引水将浮游藻类冲走。因藻类繁殖速度极快, 每天的换水率应到10%—15%。由于所需净水的量很大, 稀释与冲藻在大多数湖泊不可能实施, 但或可用于较小水体[196,197]。(2)选择性排水。在深水湖库, 选择恰当的时机排出低氧和高P的底层水, 以降低内源负荷。该法在欧美有一些应用实例, 取得良好效果[196,197]。(3)水位调控。周期性水位波动是水生植被正常发育必不可少的条件。春季应为低水位, 以促进植物萌发; 春夏应控制水位上涨速率, 以避免淹死植物[75]。我们已建立了一套方法, 可根据水生植被盖度修复目标计算水体的周年水位动态需求[209—210]。
6.4 生物调控
沉水植被修复对于沉水植被恢复, 最重要的是做好工程实施前的可恢复条件评估工作。近年来, 我国的沉水植被恢复普遍存在一个误区, 不管前期条件如何一律实施植物栽种。根据我们的研究, 在水深约1.5—3.5 m的条件下, 当湖水TP超过约0.1 mg/L时, 湖泊生态系统只可能处于浮游藻类占优势的浊水稳态; 当TP低于约0.05 mg/L时, 湖泊处于以沉水植被占优势的清水稳态; 当TP处于两者之间时, 湖泊可为浊水稳态, 也可为清水稳态[184]。显然, 只有待P降低后方可实施植物种植等生态工程。
生物操纵生物操纵即增强动物对浮游藻类的摄食。经典生物操纵是通过减少食浮游动物鱼类从而增加大型溞等大型浮游动物对藻类的摄食。该法适用于温带的TP水平不高的中小湖泊, 且需不断控鱼; 但是, 不适用于亚热带和热带湖泊, 因其缺乏大型浮游动物[184,197]。非经典生物操纵是用鲢鳙鱼控制表面水华[211]。该法同样只适用于TP水平不高的湖泊, 其作用是将较大的浮游藻类转化为较小者, 但不能减少藻类总量, 不能提高水体透明度[148]。关于双壳类滤食控藻, 有一些研究, 但尚无应用实例[212,213]。
底食性鱼类清除欧鳊、鲤和鲫等底食性鱼类搅动沉积物, 导致内源营养释放, 增加水中悬浮物, 故清除它们对沉水植物恢复和内源控制有一定作用[196]。由于这些鱼类能自然繁殖, 持续清除的工作量很大, 该法适用于小水体生态修复的初期。
微生物添加20世纪70年代即开始研究溶藻微生物(病毒、细菌、放线菌、真菌)控藻, 但至今仍停留在实验室阶段, 原因是生物相互作用和环境条件复杂多变, 效果难以稳定[196,214]。此外, 有研究采用非寄生微生物菌剂净水技术, 机理是营养竞争与循环等[215]; 同样, 该技术亦无规模应用。
大麦杆添加英国发现添加大麦杆可抑制蓝藻等藻类, 机理尚不太清楚, 或因化感物质及微生物抑藻。该法曾用于欧美的小水体, 但效果不稳定, 甚至促进藻类生长[196,216]。
6.5 其他理化方法
水华应急处理方法: (1)机械清除: 用机械设备将蓝藻等水华聚集、移出[217,218]。(2)絮凝沉降: 用铝、钙等化合物以及改性黏土絮凝除藻[196,219]。(3)杀藻剂: 最有效的是过去常用的硫酸铜等铜化合物, 亦用除草剂等, 如草多索(Endothal)和敌草快(Diquat)。由于释放藻毒素等有害物质、毒害其他生物和铜等毒物积聚诸多副作用, 杀藻剂的应用受到极大的限制[196]。
小水体控藻方法: (1)控光: 泼洒水溶性蓝色性染料, 多用于深水水体; 遮盖水面, 多用于处理后的水[196]。(2)超声波: 破坏藻细胞、气囊和毒素等[220,221]。
6.6 监测评价与适应性管理
湖泊富营养化治理是流域层次的复杂系统工程, 需要建立湖泊及其流域生态系统的监测评价体系, 包括湖盆、水文、污染源、理化水质和生物群落等, 以检验治理方案的科学性和合理性、各项措施的落实情况与实施效果, 从而及时调整方案和措施, 实行适应性管理。
7 总结
围绕湖泊富营养化治理是否必需既控P又控N这一重大而现实的科学问题, 本文对所有相关观点及其证据的科学性进行了系统辨析。首先, 对判定营养控制的主要依据——限制因子的概念发展及判定方法进行了全面回顾与分析, 明确指出该概念的目的是确定促进生物生长的因子。其次, 介绍了新概念——减控因子, 即抑制过度生物生长的因子, 其充要条件是生物必需(或致命)、管理尺度可控和实际应用可行和比较成本最低。第三, 基于减控因子分析, 指出湖泊富营养化的减控因子是P; 进而总结了加拿大和中国的全生态系统实验以及大量湖泊治理实践的系统证据。这些充分证明: 仅控P就可控制富营养化, 而减N无助于控制浮游藻类总量, 反而会诱导固N蓝藻大量生长。第四, 对控N观点的逻辑和实验依据逐一批驳。这些争论或将限制因子混同减控因子, 或缺乏大尺度的实验证据。因此, 仅就藻类总量控制而言, 富营养化治理无需控N, 只需控P。
由于N浓度过高时对水生植物等有一定的负面影响, 且可促进沉积物P的释放, 我们建议分两步放宽N的标准限值, 首先把所有水质标准的TN和-N均放宽至2 mg/L, 然后逐步放宽至5 mg/L左右。
湖泊富营养化治理应采用系统对策。在维护湖盆物理完整性的基础上, 最根本的措施是控制外源P负荷总量; 若内源P负荷较大, 则可采取钝化等方法。次之, 应开展水位调控, 以修复水生植被, 实现浊-清稳态转换。
综上所述, 湖泊富营养化治理均应采取“放宽控N、集中控P”的策略, 以大幅度降低治理成本。

