细胞核受体RXRα在2,2′,4,4′-四溴二苯醚神经毒性中的作用及其机制
许迎剑 ,张 航,张建清,
(1.山西医科大学公共卫生学院劳动卫生学系,山西 太原 030001;2.深圳市疾病预防控制中心,广东 深圳 518055)
多溴二苯醚(polybrominated diphenyl ethers,PBDEs)是一种用于多种工业产品的溴系阻燃剂,该类化合物的人体暴露负荷在全球范围内快速升高,婴幼儿比成人有更高的暴露水平[1]。由于其对人体具有内分泌干扰作用、生殖毒性、免疫毒性和神经发育毒性,五溴和八溴联苯醚已被《斯德哥尔摩公约》新增为需要消减和控制的持久性有机污染物黑名单[1]。目前的研究多集中于环境分布、污染特征及人体暴露等[2],尽管有流行病学和实验室研究表明,PBDEs 具有神经发育毒性,但机制仍不清楚。在其209 种同系物中,2,2′,4,4′-四溴二苯醚(tetra-brominated diphenyl ethers,BDE-47)是人体组织中最重要、丰度最高、生物毒性也最强的单体之一,常作为代表性多溴二苯醚化合物,用于生物毒性效应研究。
细胞核受体(nuclear receptor,NR)属于配体激活的转录调节因子,在人体有48个家族成员,包括视黄醛X 受体(retinoid X receptors,RXRs)、甲状腺激素受体(thyroid receptors,TRs)、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)等,在外源性化合物的生物毒性效应中发挥重要作用。特别是RXR作为细胞核内公共异源二聚体的核心受体,是其他核受体激活的必需因子,可以调节包括胆固醇、脂质和葡萄糖稳态等许多基因,目前其作为代谢综合征的药物靶点而受到广泛关注[3]。我们前期的研究也证明,BDE-47可以上调RXRα、TRs等细胞核受体的表达,但其相互作用机制不清。目前已有研究主要集中于单一核受体的表达变化所介导的甲状腺毒性、内分泌毒性效应[4-6],对多个核受体及其相互作用在神经细胞毒效应中的作用研究较少。
本研究通过构建人神经母细胞瘤细胞SK-N-SH的RXRα基因敲除细胞株及高表达细胞株,进而分析比较这3 种细胞在BDE-47 诱导的细胞增殖抑制效应的差异,分析以RXRα为核心的TRα、TRβ、PPARα、PPARγ共4 种相关核受体的表达水平与差异,以揭示RXRs为核心的多个核受体在BDE-47导致神经细胞毒性中的相互作用,进一步阐释受体介导的PBDEs的神经细胞毒性效应的分子机制。
1 材料与方法
1.1 材料
1.1.1细胞RXRα基因正常表达人神经母细胞瘤细胞(野生型SK-N-SH)购自中国科学院上海细胞库,人神经母细胞瘤细胞RXRα基因敲除细胞株(RXR/KOSK-N-SH)和人神经母细胞瘤细胞RXRα基因高表达细胞株(RXR/OE-SK-N-SH)在野生型SK-N-SH 基础上构建。
1.1.2主要试剂标准受试物BDE-47,纯度≥98%,购于Cambridge Isotope Laboratories,Inc公司;DMEM高糖培养基、青霉素-链霉素双抗、PBS缓冲液、胎牛血清(fetal bovine serum,FBS)和0.25%胰蛋白酶均购于美国Gibco 公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购于美国Sigma 公司;细胞增殖/毒性检测试剂盒CCK-8 购于东仁化学科技有限公司;鼠抗人RXRα抗体、鼠抗人TRα1/α2 抗体、鼠抗人TRβ1 抗体、鼠抗人PPARα抗体、鼠抗人PPARγ抗体、HPR标记的羊抗鼠二抗均购于美国Santa Cruz公司;Western blot及IP细胞裂解液和SDS-PAGE 蛋白上样缓冲液购于碧云天生物技术有限公司;分析级甲醇和分析级异丙醇购于广州化学试剂厂;RNeasy Mini Kit 购于德国Qiagen公司;Prime ScriptTMRT Master Mix (Perfect Real Time)、TB GreenTMPremix Ex TaqTM(Tli RNase H Plus)和 Micro Amp®Optical 96-Well Reaction Plate with Barcode 购于大连宝生物工程公司;PCR 引物由生工生物工程(上海)股份有限公司合成。
1.1.3实验仪器倒置生物显微镜,购于重庆光学仪器厂;生物安全柜和CO2培养箱购于上海力申科学仪器公司;全自动细胞计数仪购于美国伯乐公司;全自动酶标仪购于德国帝肯公司;微量核酸蛋白定量仪和普通PCR扩增仪购于美国Thermo公司;荧光定量PCR仪购于美国Stratagene 公司; 垂直电泳仪(Mini-PROTEAN Tetra)购于美国 BIO-RAD 公司;冷 CCD 成像系统购于美国GE公司。
1.2 试验方法
1.2.1人神经母细胞瘤细胞RXRα基因敲除细胞株和高表达细胞株的构建、培养和鉴定采用RNA干扰技术构建RXRα基因干扰慢病毒载体,包装慢病毒,转导至野生型SK-N-SH 细胞,建立RXR/KO-SK-N-SH细胞系;利用PCR 扩增法得到RXRα基因编码区域片段,酶切连接慢病毒载体,包装慢病毒,转导至野生型SK-N-SH 细胞,建立RXR/OE-SK-N-SH 细胞系。3种细胞,均传代培养4~5代,并定期提取3种细胞总蛋白与RNA 采用Western blot 与PCR 方法检测RXRα蛋白和mRNA 表达水平进行鉴定。待细胞增殖良好、RXRα基因表达稳定时,备用。
1.2.2 CCK-8法检测细胞增殖将受试细胞按1.0×105个/mL 的浓度均匀接种于 96 孔板,每孔 100 μL;设置空白组、溶剂对照组、BDE-47 处理组(浓度分别为1、5、10、20、50、100、150、200 μmol/L),每组均设置5个复孔,细胞于37 ℃、CO2体积分数为5%的培养箱中培养。当细胞生长处于对数期时,用BDE-47 按上述剂量浓度处理(DMSO 为0.2%);均分别继续培养 12、24、48、72 h 后,加入100 μL 新鲜培养基及10 μL CCK-8 共培养2 h,用全自动酶标仪测定450 nm 处吸光度D(450)值。试验重复3次,按公式计算细胞活性抑制率。

1.2.3实时荧光定量PCR检测细胞内RXRα、TRα、TRβ、PPARα、PPARγ的mRNA表达将受试细胞按照2.0×105个/mL 接种于6 孔板(每孔培养基总体积2 mL),当6孔板中的细胞生长良好且处于对数期时,设置溶剂对照组(不含BDE-47,DMSO 为0.2%),BDE-47 浓度分别为 5、10、20 μmol/L 处理细胞 24 h,之后用试剂盒提取细胞总RNA,微量核酸蛋白定量仪确定RNA浓度与质量,将RNA逆转录为cDNA,荧光定量PCR 仪扩增,扩增条件为:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸45 s,变性退火延伸进行40 个循环,得到CT值,实验重复3次。以管家基因GAPDH为内参基因,计算各实验组目的基因mRNA的相对表达水平2-ΔΔCT。
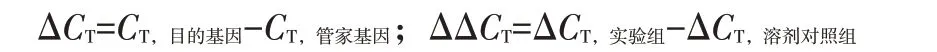
1.2.4 Western blot 法检测细胞内 RXRα、TRα、TRβ、PPARα、PPARγ的蛋白表达按照上述步骤接种细胞于6 孔板,当6 孔板中的细胞生长良好且处于对数期时,设置溶剂对照组(不含BDE-47,DMSO为0.2%),BDE-47浓度分别为5、10、20 μmol/L染毒细胞24 h, 提取细胞总蛋白, 二辛可宁酸(bicinchoninincacid,BCA)法进行蛋白定量。首先组装好玻璃板和支架,注入10%的SDS-PAGE 分离胶4 mL,并用异丙醇封面,待分离胶凝固后吸干胶面残留液体后注入5%的浓缩胶1 mL,插上梳子待凝固后拨出梳子,每孔等量上样20 μg后,恒定电压80 V电泳30 min 后调节电压至120 V 电泳55 min。然后将PVDF 膜用甲醇浸泡1 min,组装滤纸板、PVDF 膜、凝胶、滤纸板“三明治”,以200 mA 的电流湿转90 min。随后用5%的脱脂奶粉配制TBST 封闭液,PVDF膜浸入封闭液常温封闭1 h 或4 ℃过夜。RXRα、TRα、TRβ、PPARα、PPARγ、内参(GAPDH)抗体的稀释比例均为1∶1 000,在PVDF 膜上切取对应分子大小的条带浸入上述一抗稀释液,冰上摇床过夜,孵育结束后用TBST洗膜3次,每次10 min;将目的条带放入二抗稀释液(1∶5 000),室温摇床孵育1 h,TBST洗膜3 次,每次10 min。将化学发光剂A 液和B 液等量混合,每个条带消耗200 μL 发光液,将条带平铺在垫板上确保与垫板完全贴合没有气泡,将发光液均匀滴加在条带表面,放入冷CCD 成像系统中曝光。ImageJ 2.0软件分析目标条带光密度。实验分3批次提取细胞蛋白,每批次4个处理浓度并重复3次。
1.3 统计分析
数据采用SPSS 22.0 软件分析,多组间均数的比较采用单因素方差分析。均数间两两比较,当方差不齐性时,选用秩和检验;方差齐性时,选用Dunnett'st检验。检验水准为α=0.05(双侧)。
2 结 果
2.1 RXR/KO-SK-N-SH 和 RXR/OE-SK-N-SH 细胞株的构建
图 1 为 RXR/KO-SK-N-SH 和 RXR/OE-SK-N-SH细胞株的RXRα受体蛋白表达鉴定结果。RXR/KOSK-N-SH 细胞内RXRα的蛋白表达水平约为野生型SK-N-SH 细 胞 的 1/5; RXR/OE-SK-N-SH 细 胞 内RXRα的蛋白表达水平约为野生型SK-N-SH 细胞的2倍。表明 RXR/KO-SK-N-SH 和 RXR/OE-SK-N-SH 细胞构建成功。实验所用细胞均传代4~5 次,且每批次细胞均检测RXRα基因的表达水平,检测结果显示SKN-SH 细胞的RXRα敲除或者高表达细胞均稳定传代,以此确保所构建的细胞适用于后续研究。

图1 RXR/KO-SK-N-SH、野生型SK-N-SH 和RXR/OE-SK-NSH细胞内RXRα蛋白相对表达水平
2.2 RXR/KO-SK-N-SH 和 RXR/OE-SK-N-SH 细胞株对BDE-47增殖抑制毒性的敏感性比较
不同浓度BDE-47 分别处理上述3 种细胞12、24、48、72 h后细胞增殖结果见图2。BDE-47对3种细胞均有明显抑制作用,抑制率随染毒浓度和染毒时间的增加而增加。
BDE-47 处理3 种细胞12~72 h,显示细胞生长抑制率总体上随BDE-47 浓度的增加而增加。另外,还观察到3 种细胞的生长抑制率在BDE-47 处理24 h 后变化均不明显,均可达到半数抑制,故选24 h作为后续实验的处理时间。由Probit 回归模型统计分析得出,RXR/KO-SK-N-SH 细胞、野生型SK-N-SH 细胞和RXR/OE-SK-N-SH 细胞生长抑制率达到50%时BDE-47 的染毒浓度即IC50分别是27、55 和54 μmol/L。在BDE-47的浓度和染毒时间均相同时,3种细胞相比,BDE-47 对RXR/KO-SK-N-SH 细胞的IC50是野生型和RXR/OE-SK-N-SH 细胞1/2,说明RXR/KO-SK-N-SH细胞对BDE-47的增殖抑制作用更敏感。
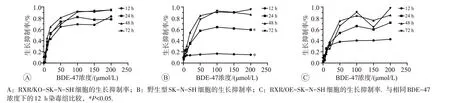
图2 BDE-47不同处理时间和浓度下的RXR状态不同的3种细胞生长抑制率
3 种细胞在上述不同浓度BDE-47 染毒24 h 时的生长抑制率变化拟合曲线方程见图3。最高染毒计量是野生型SK-N-SH 细胞生长抑制率为50%时浓度的1/3左右,以此确定后续实验高、中、低剂量处理组的BDE-47浓度分别为20、10、5 μmol/L。
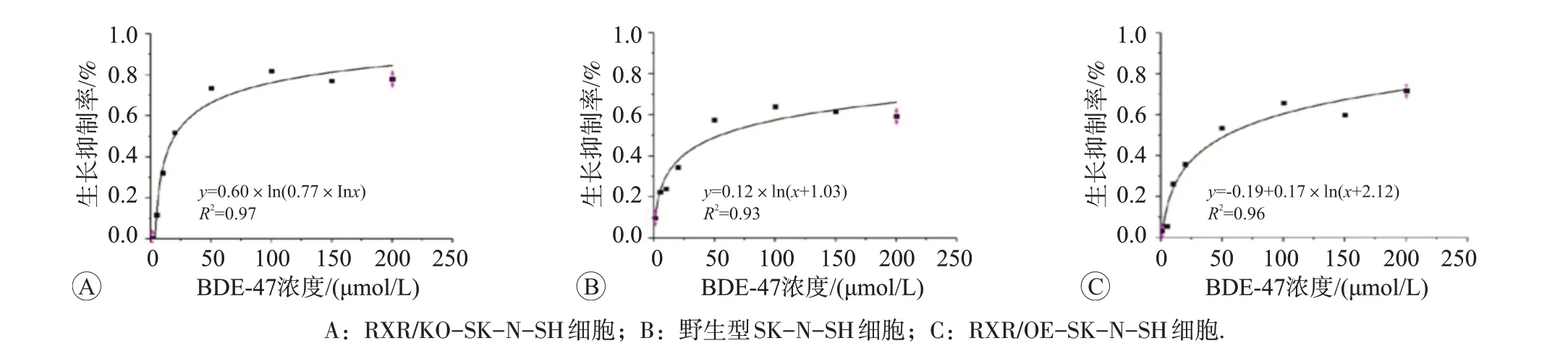
图3 不同浓度的BDE-47染毒24 h时RXR受体状态不同的3种细胞生长抑制率变化的拟合曲线
2.3 BDE-47 对细胞核受体 RXRα、TRα、TRβ、PPARα、PPARγ的mRNA和蛋白表达的影响
2.3.1 BDE-47对3种细胞内RXRα mRNA和蛋白表达的影响BDE-47 染毒3 种细胞后,RXRα的mRNA和蛋白表达水平见图4。BDE-47未处理细胞时,野生型 SK-N-SH 和 RXR/OE-SK-N-SH 细胞中 RXRα蛋白表达水平分别是RXR/KO-SK-N-SH 的7.75 倍和8.32倍,说明RXR/OE-SK-N-SH 细胞和RXR/KO-SK-NSH细胞构建成功。RXR/KO-SK-N-SH细胞内RXRα基因被敲除,RXRα mRNA 和蛋白几乎不表达。按照BDE-47 低、中、高剂量组的顺序,野生型SK-N-SH细胞和 RXR/OE-SK-N-SH 细胞内 RXRα mRNA 表达相对于对照组,差异无统计学意义。BDE-47 中剂量处理组,野生型SK-N-SH 细胞和RXR/OE-SK-N-SH细胞RXRα蛋白表达明显升高,分别是对照组的1.65和1.57倍,差异有统计学意义(P<0.05)。
2.3.2 BDE-47 对 3 种细胞内 TRα mRNA 和蛋白表达的影响BDE-47 处理3 种细胞后,TRα mRNA 和蛋白表达水平见图5。RXR/KO-SK-N-SH 细胞中,TRα mRNA表达水平在低、中剂量组增加,分别是其对照组的1.16 和1.09 倍;TRα蛋白表达水平明显降低。野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中,TRα mRNA表达水平无明显变化,蛋白表达水平在高剂量组明显升高,分别是其对照组的1.33 和1.25 倍,差异有统计学意义(P<0.05)。

图4 BDE-47对3种细胞内RXRα mRNA和蛋白表达的影响

图5 BDE-47对3种细胞内TRα mRNA和蛋白表达的影响
2.3.3 BDE-47 对 3 种细胞内 TRβ mRNA 和蛋白表达的影响BDE-47 处理3 种细胞后,TRβ mRNA 和蛋白表达水平见图6。BDE-47按照低、中、高剂量组的顺序,随着剂量增加,3 种细胞与各自对照组相比较,TRβ mRNA 和蛋白表达水平均没有明显的变化。在同一剂量下,3 种细胞内TRβ mRNA 和蛋白表达水平也无明显差异。
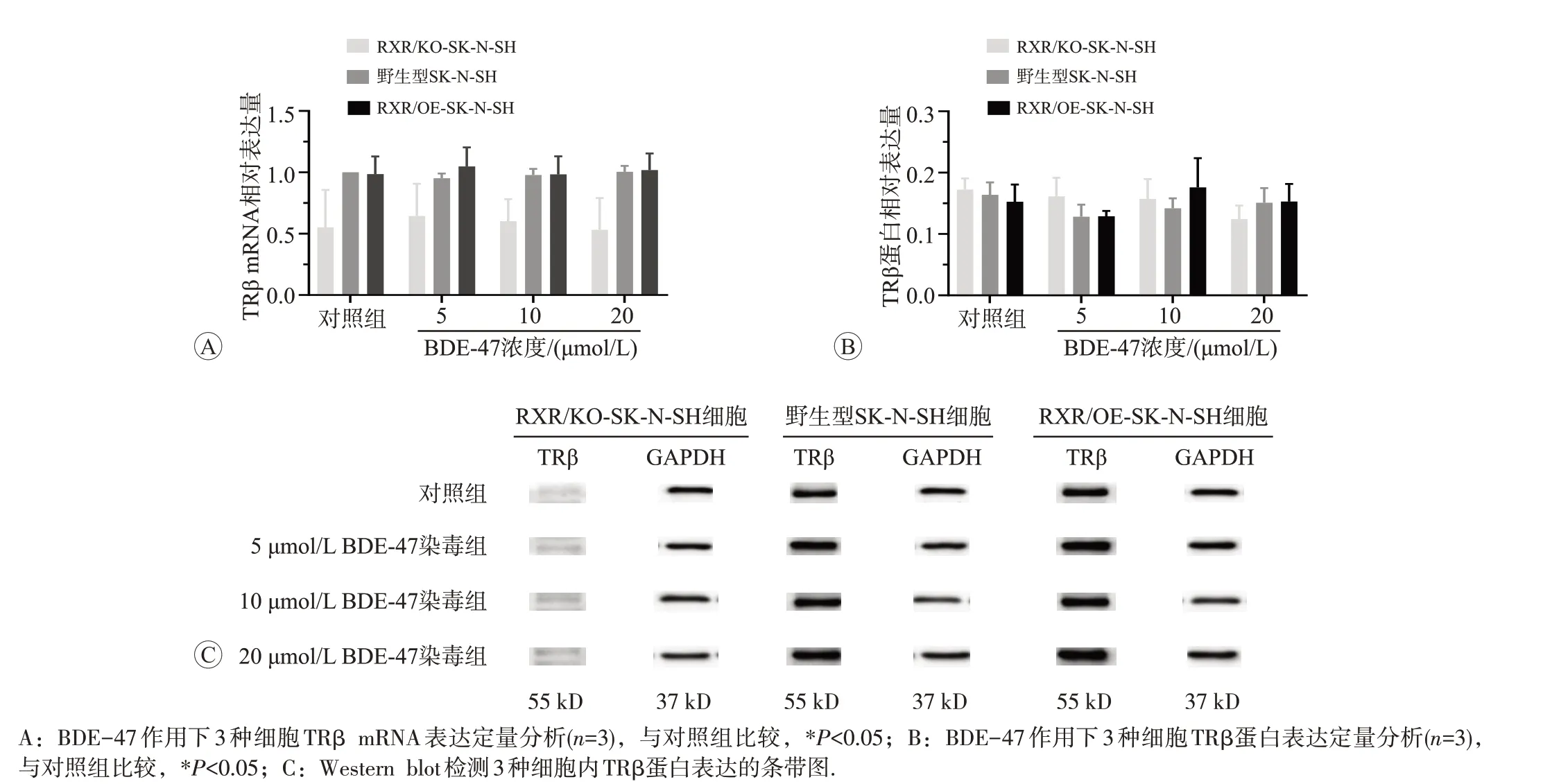
图6 BDE-47对3种细胞内TRβ mRNA和蛋白表达的影响
2.3.4 BDE-47 对 3 种细胞内 PPARα mRNA 和蛋白表达的影响BDE-47 处理3 种细胞后,PPARα mRNA 和蛋白表达水平见图7。RXR/KO-SK-N-SH 细胞内,PPARα mRNA表达水平无明显变化,蛋白表达水平分别是对照组的70%、91%、69%,表达水平明显降低。在BDE-47 高剂量组,野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中PPARα mRNA 表达水平分别是对照组的1.13 和1.14 倍,差异有统计学意义(P<0.05);蛋白表达水平分别是对照组的1.33 和1.21 倍,差异有统计学意义(P<0.05)。

图7 BDE-47对3种细胞内PPARα mRNA和蛋白表达的影响
2.3.5 BDE-47 对 3 种细胞内 PPARγ mRNA 和蛋白表达的影响BDE-47 处理3 种细胞后,PPARγ的mRNA 和蛋白表达水平见图8。RXR/KO-SK-N-SH 和野生型SK-N-SH 细胞中PPARγ mRNA 表达是分别是对照组的 99%、1.13、1.19 倍和 1.05、1.16、1.22 倍,蛋白表达是对照组的1.11 倍、95%、89%和92%、97%、74%;RXR/OE-SK-N-SH 细胞内,PPARγ的mRNA表达是对照组的1.09、1.07、1.22倍,蛋白表达是对照组的98%、1.10倍、76%。说明BDE-47处理3种细胞后,RXR/KO-SK-N-SH 和野生型SK-N-SH 细胞内PPARγ mRNA 表达和蛋白表达水平均无明显变化,RXR/OE-SK-N-SH细胞在高剂量组mRNA表达显著升高(P<0.05),而其蛋白表达水平无显著变化。

图8 BDE-47对3种细胞内PPARγ mRNA和蛋白表达的影响
3 讨 论
BDE-47 作为一种环境内分泌干扰物,对生物体具有内分泌干扰作用、器官毒性、生殖毒性、免疫毒性和神经发育毒性[2,7]。在BDE-47 致肝癌细胞HepG2毒性的研究中发现,氧化应激、DNA损伤和细胞周期异常可能是肝癌细胞毒性效应的机制[8]。在BDE-47致MCF-7细胞毒性效应机制研究中,嘧啶、嘌呤、戊糖磷酸途径代谢中相关代谢产物的表达显著下调[9]。有报道显示,大鼠产前暴露BDE-47 诱发细胞内质网应激和自噬缺陷导致甲状腺组织损伤[10]。但关于受体介导的神经细胞毒性效应及机制的研究报道较少。我们前期研究发现,人SK-N-SH 细胞主要表达RXRα亚型,因此本研究构建了RXRα基因敲除和高表达两种不同的SK-N-SH细胞,旨在探讨RXRs为核心的多个核受体在BDE-47 致神经细胞毒性中的相互作用,以期揭示受体介导的PBDEs 神经毒性效应的分子机制。细胞增殖抑制实验结果显示,RXR/KO-SK-N-SH 细胞的IC50是野生型和RXR/OE-SK-N-SH 细胞的1/2,说明RXR/KO-SK-N-SH 细胞对BDE-47 的毒性更敏感。因此,RXR在提高细胞生存能力中可能发挥重要作用。
体内外研究表明,RXRα可以提高细胞对抗氧化应激损伤的能力。RXRα缺失的模型小鼠中GSH 合成明显下调,而肝脏GSH 水平显著降低。RXRα缺失的肝脏细胞与野生型细胞相比,对三丁基过氧化氢(t-BHP)诱导的氧化应激更加敏感[11]。还有研究也发现RXR与细胞增殖相关,胃癌组织中RXR的表达低于正常胃组织[12]。上述研究与本研究结果一致,说明RXRα可提高细胞的增殖,而其缺失会增加细胞对外源性化合物的敏感性,而RXRα在外源性化合物致毒性效应中所发挥的作用可能是通过提高细胞抗氧化应激能力实现的。
RXR是一类以同源二聚体存在或与其他核受体形成异二聚体的核受体,通过识别特异性反应元件激活目的基因,并调节基因转录与翻译,从而与其他核受体形成异源二聚体调控细胞发育、分化和代谢,其在自身免疫和神经退行性疾病的药理靶向治疗方面发挥重要作用[13-16]。异源二聚体与配体的相互作用方式决定了其被激活的配体,如RXR/TR二聚体只能被TR配体激活,而不能被RXR配体激活;RXR/PPAR 异二聚体可以被其中任意受体的配体激活[17]。甲状腺激素受体(TRα和TRβ)可促进神经祖细胞增殖分化和调节神经元细胞死亡等,对神经系统的发育有着重要作用[18]。TRs 缺失或突变会导致甲状腺功能减退、骨骼发育迟缓、运动障碍与认知能力缺陷等[19]。有报道显示配体化合物通过激活异聚体RXR而间接活化TR,实现TR/RXR协同干扰甲状腺激素的分泌[20]。PPARα与PPARβ可促进肝脏对脂肪的摄取与异生,从而增加肝脏脂肪的合成[21]。研究细胞胆固醇代谢、淀粉样蛋白Aβ前体生成和转移的过程时,RXR和PPARα激动剂同时激活PPARα/RXR 二聚体,提示PPARα/RXR 二聚体在细胞胆固醇代谢过程中发挥重要作用[22]。PPARγ作为配体活化转录因子常与RXR异质二聚化调控基因转录,维持成熟脂肪细胞的功能与存活、胰岛素敏感度及脂肪和骨生成的平衡[23]。
因PPARs 和TRs 的活化前提是与RXRα形成异源二聚体,BDE-47作为RXR的配体,激活RXR之后再活化TRα、PPARα。在RXR/KO-SK-N-SH 细胞中,TRα mRNA表达水平升高,但是蛋白表达水平明显降低;野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中,mRNA 表达水平无明显变化,蛋白表达水平在高剂量组明显升高。在RXR/KO-SK-N-SH 细胞内,PPARα的mRNA 表达水平无明显变化,蛋白表达水平却明显降低;而高剂量BDE-47 处理的野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中,PPARα的 mRNA 和蛋白表达水平升高。本研究发现,BDE-47 可诱导野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中TRα和PPARα的蛋白表达上调,而TRα在上述两种细胞中的mRNA表达无明显变化,由于mRNA 经过修饰后翻译合成蛋白质,表观遗传修饰可调控基因表达从而影响蛋白翻译,其mRNA 和蛋白水平的表达不一致可能与表观遗传修饰有关,这有待未来深入研究。上述两个受体在RXR/KO-SK-N-SH 细胞中表达下调,同时在野生型SK-N-SH 和RXR/OE-SK-N-SH 细胞中表达上调,说明RXRα可以介导TRα和PPARα的表达。同时,随着BDE-47剂量的增加,TRβ和PPARγ在3种细胞中的表达均没有明显升高或者降低,说明BDE-47 并未激活或者抑制SK-N-SH 细胞TRβ和PPARγ表达,提示RXR没有介导TRβ和PPARγ的表达。
综上,RXRα在BDE-47 细胞毒性中发挥重要作用;BDE-47对人SK-N-SH 细胞的毒性效应主要是通过激活RXRα,从而诱导TRα和PPARα表达而实现的。提示多溴二苯醚类化合物可能通过RXRα通路发挥其神经内分泌干扰毒性效应。然而,以RXR为核心的多个细胞核受体之间的相互作用,有待进一步深入研究。

