地西他滨单药治疗骨髓增生异常综合征疗效和安全性的Meta分析
郑丽 宫一凡 孙雪林 张卫娜 赵妍
摘 要 目的:系統评价地西他滨单药治疗骨髓增生异常综合征(MDS)的疗效和安全性,为临床提供循证参考。方法:计算机检索Embase、Cochrane图书馆、PubMed、Medline、Clinical Key、Google学术、中国知网、中国生物医学文献数据库及万方数据等中英文数据库,检索时限均为建库起至2020年6月26日,收集地西他滨(地西他滨组)对比传统联合化疗方案(对照组)治疗MDS患者的随机对照试验(RCT)。筛选文献,提取资料并采用Cochrane系统评价员手册5.2.2推荐的偏倚风险评估工具评价纳入文献质量后,采用Rev Man 5.3软件进行Meta分析。结果:共纳入11项RCT,共计590例患者。Meta分析结果显示,地西他滨组患者的完全缓解率[OR=1.82,95%CI(1.23,2.70),P=0.003]和总有效率[OR=1.54,95%CI(1.05,2.27),P=0.03]均显著高于对照组,不良反应发生率[OR=0.26,95%CI(0.16,0.40),P<0.000 01]、感染发生率[OR=0.48,95%CI(0.27,0.85),P=0.01]和骨髓抑制发生率[OR=0.37,95%CI(0.17,0.81),P=0.01]均显著低于对照组。按疗程进行的亚组分析结果显示,在疗程为3、4个月的方案中,两组患者的完全缓解率和总有效率比较差异均无统计学意义(P>0.05);在疗程为1、2个月的方案中,地西他滨组患者的完全缓解率和总有效率均显著高于对照组(P<0.05)。结论:地西他滨单药治疗MDS患者的疗效和安全性均较好,且当治疗时长≤2个月时,地西他滨治疗MDS患者的完全缓解率及总有效率更优。
关键词 地西他滨;骨髓增生异常综合征;疗效;安全性;Meta分析
中图分类号 R551.3;R969 文献标志码 A 文章编号 1001-0408(2020)18-2269-06
DOI 10.6039/j.issn.1001-0408.2020.18.17
ABSTRACT OBJECTIVE: To systematically evaluate the efficacy and safety of decitabine monotherapy in the treatment of myelodysplastic syndrome (MDS), and to provide evidence-based reference to the clinic. METHODS: Retrieved from Embase, Cochrane Library, PubMed, Medline, Clinical Key, Google Scholar, CNKI, CBM and Wanfang data, during the inception to Jun. 26th, 2020, randomized controlled trials (RCTs) about decitabine (decitabine group) versus traditional combined chemotherapy (control group) in the treatment of MDS were collected. After literature screening and data extraction, literature quality evaluation with bias risk evaluation tool recommended by Cochrane systematic evaluator manual 5.2.2, Meta-analysis was performed by using Rev Man 5.3 software. RESULTS: A total of 590 patients with 11 RCTs were included. Meta-analysis results showed that complete remission rate [OR=1.82, 95% CI(1.23,2.70), P=0.003] and total response rate [OR=1.54,95% CI(1.05,2.27),P=0.03] of decitabine group were significantly higher than those of control group; the incidence of ADR [OR=0.26, 95% CI(0.16,0.40), P<0.000 01], the incidence of infection [OR=0.48, 95% CI(0.27,0.85), P=0.01] and the incidence of myelosuppression [OR=0.37, 95% CI(0.17,0.81), P=0.01] in decitabine group were significantly lower than control group. The results of subgroup analysis according to the course of treatment showed that there was no significant difference in the complete remission rate and total response rate between 2 groups in the treatment course of 3 and 4 months (P>0.05); but there was significant difference in the treatment course of 1 month or 2 months, the decitabine group was significantly higher than control group (P<0.05). CONCLUSIONS: Decitabine has good efficacy and safety in the treatment of MDS patients, and when the treatment time is less than or equal to 2 months, the complete remission rate and total response rate of decitabine in MDS patients are better.
KEYWORDS Decitabine; Myelodysplastic syndrome; Efficacy; Safety; Meta-analysis
骨髓增生异常综合征(Myelodysplastic syndrome,MDS)是一种起源于造血干细胞的恶性克隆性疾病,具有高度异质性,表现为无效造血、难治性血细胞减少、造血功能衰竭,并以高风险向急性髓系白血病(Acute myelod leukemia,AML)转化为特征[1]。临床一般采用CAG(阿糖胞苷+阿克拉霉素+粒细胞集落刺激因子)[2]或HAG(高三尖杉酯碱+阿糖胞苷+粒细胞集落刺激因子)[3]等预激方案治疗MDS,然而上述方案的有效性和安全性尚有待进一步提高[4]。研究证实,DNA甲基化异常特别是抑癌基因甲基化异常与MDS和AML的发生密切相关,抑制DNA甲基化异常可改善部分MDS患者的病情,延迟向AML转化,甚至延长生存期[5-6]。由于DNA甲基化状态改变具有可逆性,因此可考虑通过逆转基因的甲基化来治疗MDS。
地西他滨于2006年由美国FDA批准上市,目前已被国内外多个指南推荐用于较高危及部分低危(严重血细胞减少、输血依赖或原始细胞增多)MDS患者的一线治疗[7-8]。地西他滨能够在S期与肿瘤细胞DNA结合,干扰其DNA合成,具有细胞毒性作用,可以直接杀伤肿瘤细胞;此外,地西他滨可通过抑制DNA甲基化转移酶的活性,减少DNA的甲基化,从而抑制肿瘤细胞增殖并防止耐药的发生[6]。《NCCN临床实用指南——骨髓增生异常综合征2018版》[7]指出,地西他滨可以明显延长MDS向AML进展的时间,患者显示出较高的应答率,且患者总体缓解率显著高于采用传统治疗方案者。相关临床研究表明,地西他滨单药治疗即可取得较高的反应率[8]。但NCCN指南主要是针对欧美人种而定,考虑到亚洲人种和欧美人种存在差异性,对于亚洲人种应用地西他滨单药对比传统化疗方案治疗MDS的相关临床证据并不多,且研究样本量均较小,故笔者采用Meta分析的方法系统评价了我国MDS患者单用地西他滨对比传统联合化疗的疗效和安全性,旨在为临床治疗方案的选择提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 文献类型 国内外公开发表的随机对照试验(RCT)。语种限定为中文和英文。
1.1.2 研究对象 确诊为MDS的中国患者,原发性和继发性MDS不限,患者年龄、性别、民族、地域、病程及样本量均不限。
1.1.3 干预措施 地西他滨组患者采用地西他滨单药治疗,对照组患者采用传统联合化疗方案(CAG、HAG等)治疗。两组患者的剂量、疗程均不限。
1.1.4 结局指标 疗效指标:①完全缓解率;②总有效率[(完全缓解+部分缓解+显效率)/总例数×100%]。安全性指标:③不良反应发生率(中性粒细胞减少、血小板减少、贫血等);④感染发生率;⑤骨髓抑制发生率。疗效根据国际工作组(IWG)2006中的疗效判定标准[9]进行评价。
1.1.5 排除标准 ①非MDS患者的文献;②重复发表或数据不全的文献;③非RCT研究,如单臂研究、个案报道、综述、基础研究等;④干预措施及结局指标完全不符的文献。
1.2 文献检索策略
计算机检索Embase、Cochrane图书馆、PubMed、Medline、Clinical Key、Google学术、中国知网、中国生物医学文献数据库及万方数据等中英文数据库。英文检索词:“Decitabine”“Myelodysplastic syndrome”“MDS”;中文检索词:“地西他滨”“骨髓增生异常综合征”。检索时限均为各数据库建库起至2020年6月26日。
1.3 文献筛选及资料提取
由2位研究者独立筛选检索到的文献,先阅读题目和摘要,将明显不符合纳入标准的文献排除,对于可能符合纳入标准的文献经阅读全文后决定是否纳入。若遇分歧,则通过协商解决或与第3位研究者讨论后裁定。提取资料包括第一作者、发表年份、患者例数、性别、年龄、MDS分型、国际预后积分系统(IPSS)预后危险分层、干预措施及结局指标等。
1.4 文献质量评价
采用Cochrane系统评价员手册5.2.2推荐的偏倚风险评估工具对纳入文献质量进行评价,包括:①随机方法是否正确;②是否实施分配隐藏;③是否采用盲法;④数据结果是否完整;⑤是否存在选择性的报告;⑥是否存在其他偏倚。
1.5 统计学方法
应用Rev Man 5.3软件进行Meta分析,主要统计过程包括异质性检验、Meta分析、发表偏倚分析和敏感性分析。二分类变量采用比值比(OR)及其95%置信区间(CI)表示。采用χ2检验分析纳入研究的异质性,并结合I 2检验对异质性大小进行定量判断。若P<0.05和(或)I 2>50%,则认为各研究间存在异质性,采用随机效应模型进行Meta分析;反之,则采用固定效应模型进行Meta分析。采用倒漏斗图进行发表偏倚评价分析。在Rev Man 5.3软件中,逐个排除所包含的研究进行敏感性分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
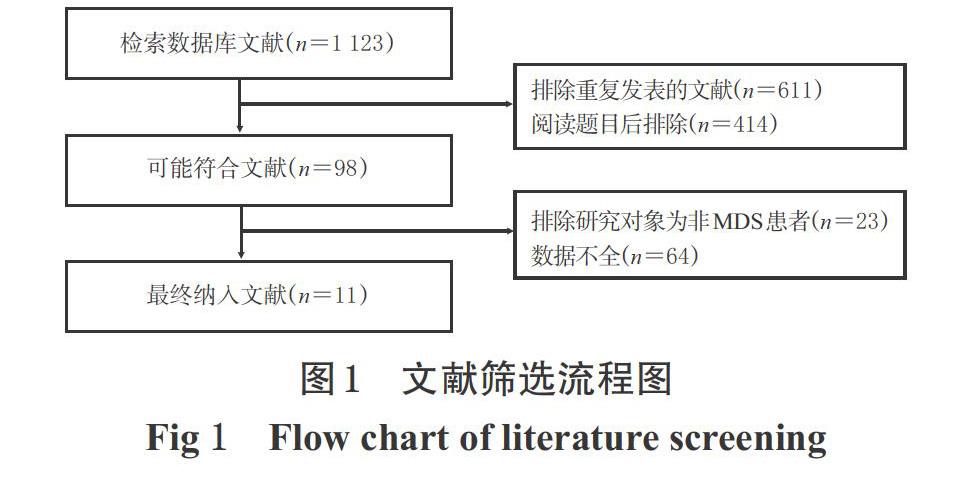
根据预先设定的检索策略及方法,初检共获得文献1 123篇;经阅读题目、摘要及全文后,最终纳入11篇文献[10-20],共计患者590例,其中地西他滨组294例、对照组296例。文献筛选流程图见图1,纳入研究基本信息见表1。
2.2 纳入研究质量评价结果
纳入研究均为RCT,但在随机分配方法、是否采用盲法、数据结果是否完整等方面存在較大偏倚。偏倚风险评价结果见图2、图3。
2.3 Meta分析结果
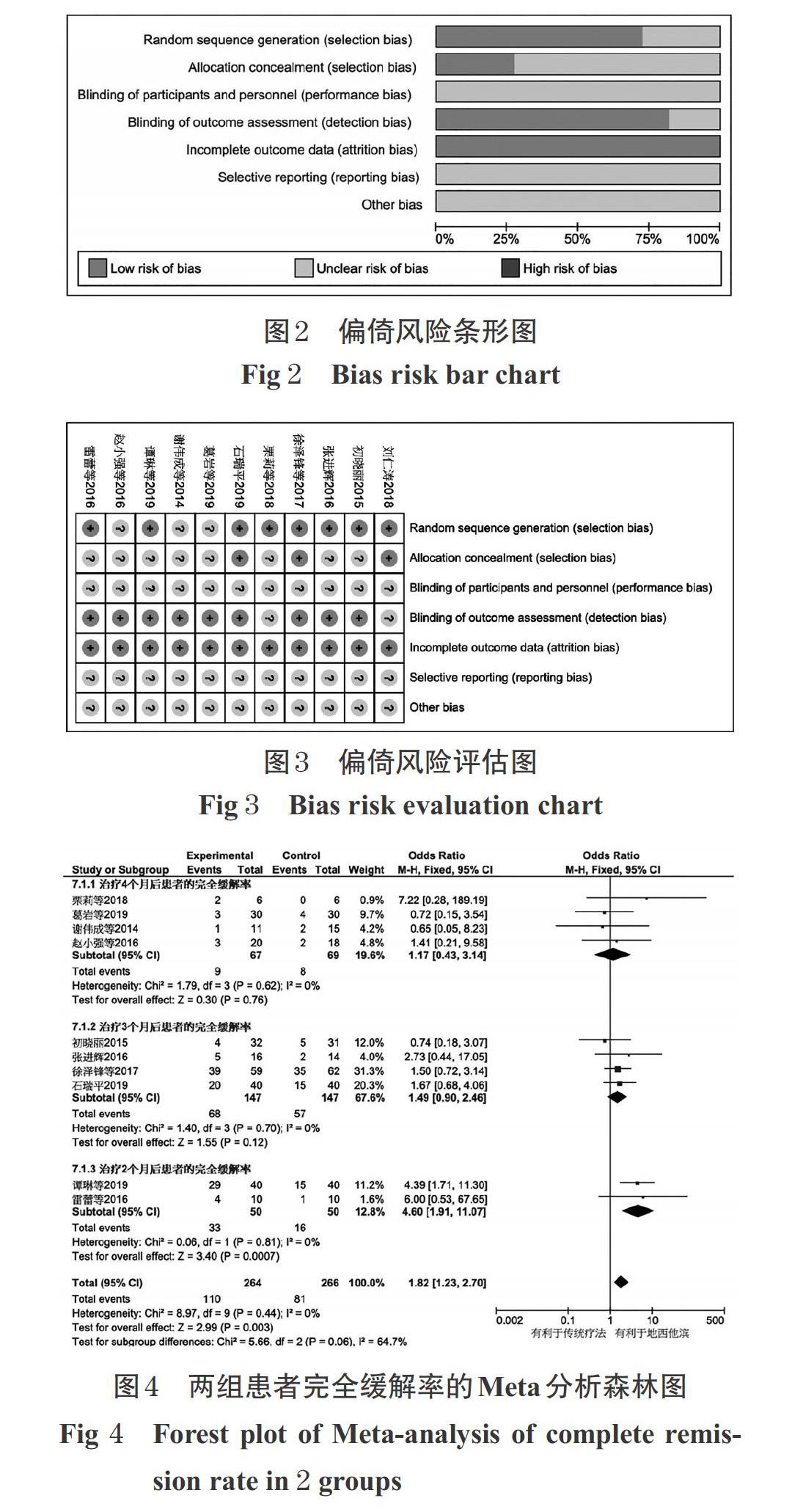
2.3.1 完全缓解率 11项[10-20]研究均报道了患者完全缓解率,各研究间无统计学异质性(I 2=0,P=0.44),采用固定效应模型进行Meta分析,详见图4。Meta分析结果显示,地西他滨组患者的完全缓解率显著高于对照组[OR=1.82,95%CI(1.23,2.70),P=0.003]。由于纳入研究间的疗程差异较大,故按疗程进行亚组分析。
有4项研究[11,12,15,17]的疗程为3个月,共计患者294例,各研究间无统计学异质性(I 2=0,P=0.70),采用固定效应模型进行Meta分析,详见图4。Meta分析结果显示,治疗3个月后,两组患者的完全缓解率比较,差异无统计学意义[OR=1.49,95%CI(0.90,2.46),P=0.12]。
有2项研究[10,18]的疗程为2个月,共计患者100例,各研究间无统计学异质性(I 2=0,P=0.81),采用固定效应模型进行Meta分析,详见图4。Meta分析结果显示,治疗2个月后,地西他滨组患者的完全缓解率显著高于对照组[OR=4.60,95%CI(1.91,11.07),P=0.000 7]。
另有1项研究[19]的疗程为1个月,共计患者60例。该研究结果表明,地西他滨组的完全缓解率显著高于对照组(20%vs.10%,P<0.05)。
2.3.2 总有效率 11项[10-20]研究均报道了总有效率,各研究间无统计学异质性(I 2=0,P=0.47),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,地西他滨组患者的总有效率显著高于对照组[OR=1.54,95%CI(1.05,2.27),P=0.03]。由于纳入研究间疗程的差异较大,故按疗程进行亚组分析。
有4项研究[13,14,16,20]的疗程为4个月,共计患者136例,各研究间无统计学异质性(I 2=0,P=0.78),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,治疗4个月后,两组患者的总有效率比较,差异无统计学意义[OR=0.88,95%CI(0.42,1.83),P=0.74]。
有4项研究[11,12,15,17]的疗程为3个月,共计患者294例,各研究间无统计学异质性(I 2=3%,P=0.38),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,治疗3个月后,两组患者的总有效率比较,差异无统计学意义[OR=1.68,95%CI(1.01,2.80),P=0.05]。
有2项研究[10,18]的疗程为2个月,共计100例患者,各研究间无统计学异质性(I 2=0,P=0.63),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,治疗2个月后,地西他滨组患者的总有效率显著高于对照组[OR=3.40,95%CI(1.14,10.14),P=0.03]。
另有1项研究[19]的疗程为1个月,共计患者60例。该研究结果表明,地西他滨组患者的总有效率为70%,稍高于对照组的60%,组间比较差异无统计学意义(P>0.05)。
2.3.3 不良反应发生率 8项[10,12-17,19]研究报道了不良反应发生率,共计患者437例,各项研究间无统计学异质性(I 2=0,P=0.54),故采用固定效应模型进行Meta分析,详见图6。Meta分析结果显示,地西他滨组患者不良反应发生率显著低于对照组[OR=0.26,95%CI(0.16,0.40),P<0.000 01]
2.3.4 感染发生率 9项[10-12,14-18,20]研究报道了感染发生率,共计患者460例,各项研究间无统计学異质性(I 2 =0,P=0.96),故采用固定效应模型进行Meta分析,详见图7。Meta分析结果显示,地西他滨组患者感染发生率显著低于对照组[OR=0.48,95%CI(0.27,0.85),P=0.01]。
2.3.5 骨髓抑制发生率 6项[10,12,14-17]研究报道了骨髓抑制发生率,共计患者317例,各项研究间无统计学异质性(I 2=0,P=0.95),故采用固定效应模型进行Meta分析,详见图8。Meta分析结果显示。地西他滨组患者骨髓抑制发生率显著低于对照组[OR=0.37,95%CI(0.17,0.81),P=0.01]。
2.4 发表偏倚及敏感性分析
采用Rev Man 5.3软件以完全缓解率为指标进行发表偏倚分析,结果见图9。由图9可知,倒漏斗图较为对称,数据比较集中,无文献落在倒漏斗图外,表明本研究无明显的发表偏倚。对各项结果进行敏感性分析,逐个剔除所纳入研究,再重新评估合并效应量,与之前的Meta分析结果一致,表明本研究结果的稳定性较好。
3 讨论
现有研究表明,MDS可能与DNA异常甲基化导致抑癌基因沉默表达有关[21]。地西他滨作为特异性DNA甲基化转移酶抑制剂,可逆转DNA的甲基化过程,降低肿瘤细胞内DNA总体甲基化程度,并引发基因表达改变,进而诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡[5-6]。在体内,地西他滨被磷酸化后,以磷酸盐的形式与DNA结合,发挥抗肿瘤作用。高剂量的地西他滨可抑制DNA合成进而诱导肿瘤细胞凋亡,发挥细胞毒作用;低剂量的地西他滨可替代肿瘤细胞内的胞嘧啶与DNA甲基化转移酶结合,进而导致DNA甲基化转移酶失活但不会诱导细胞凋亡[22]。
由本研究结果可见,地西他滨治疗MDS患者的完全缓解率及总有效率均显著高于对照组,且不良反应发生率、感染发生率和骨髓抑制发生率等均显著低于对照组,表明地西他滨单药治疗MDS的疗效和安全性均较好。根据疗程进行亚组分析,当治疗时长不长于2个月时,地西他滨治疗MDS患者的完全缓解率及总有效率均显著高于对照组;而当治疗时长为3~4个月,地西他滨治疗MDS患者的优势不显著,表明地西他滨在疗程为2个月及以下的方案中,疗效更优。
本研究存在一定的局限性:首先,纳入研究的病例数普遍较少,各项研究结局指标不完全统一,可能存在一定的异质性和偏倚;其次,纳入的部分文献对结局指标的报道不够完善,可能影响本次Meta的证据强度;另外,纳入的研究只评价了近期疗效及安全性,对于远期疗效及安全性均未作进一步分析。因此,地西他滨是否可以改善疾病进展及延迟MDS向AML进展尚需更多前瞻性、大样本、高质量的RCT加以验证。
参考文献
[ 1 ] WILL B,ZHOU L,VOGLER T O,et al. Stem and progenitor cells in myelodysplastic syndromes show aberrant stage-specific expansion and harbor genetic and epigenetic alterations[J]. Blood,2012,120(10):2076-2086.
[ 2 ] WEI G,NI W,CHIAO JW,et al.A meta-analysis of CAG(cytarabine,aclarubicin,G-CSF) regimen for the treatment of 1 029 patients with acute myeloid leukemia and myelodysplastic syndrome[J]. J Hematol Oncol,2011,46(4):1-13.
[ 3 ] 张磊,苏定雷,苏爱玲,等.个体化小剂量HAG方案治疗老年急性髓细胞白血病的疗效观察[J].临床血液学杂志,2009,22(5):502-503.
[ 4 ] NAZHA A,RAVANDI F. Acute myeloid leukemia in the elderly:do we know who should be treated and how? [J]. Leuk Lymphoma,2014,55(5):979-987.
[ 5 ] GUGLIELMELLI T,CAPELLA S,SAGLIO G. Very low doses of thalidomide as single agent in relapsed/refractory multiple myeloma[J]. Acta Haematol,2006,116(1):70- 71.
[ 6 ] JASIELEC J,SALOURA V,GODLEY LA. The mechanistic role of DNA methylation in myeloid leukemogenesis[J]. Leukemia,2014,28(9):1765-1773.
[ 7 ] PETER LG,EYAL A,JOHN MB,et al. NCCN clinical practice guidelines in oncology: myelodysplastic syndromes[J]. JNCCN,2011,9(1):30-56.
[ 8 ] XIE JF,XING ZH,FENG JW,et al. Clinical efficacy of ultralow dose of decitabine alone for treatment of myelodysplastic syndromes [J]. J Leuk lymphoma,2018,27(8):483-485.
[ 9 ] CHESON BD,GREENBERG PL,BENNETT JM,et al. Clinical application and proposal for modification of the International Working Group(IWG)response criteria in myelodysplasia[J]. Blood,2006,108(2):419-425.
[10] 谭琳,刘琳,谢瑜,等.地西他滨治疗骨髓增生异常综合征的疗效及对心肺功能的影响[J].癌症进展,2019,17(20):2445-2447.
[11] 徐泽锋,秦铁军,张宏丽,等.地西他滨单药与CAG/HAG方案治疗难治性贫血伴有原始细胞增多的疗效和安全性比较[J].中华血液学杂志,2017,38(7):572-577.
[12] 初晓丽.地西他滨治疗骨髓增生异常综合征的疗效分析[J].中国医药科学,2015,5(18):195-197.
[13] 葛岩,丁香梅,高凌霞.地西他滨治疗骨髓增生异常综合征的疗效观察[J].北方药学,2019,16(6):128-129.
[14] 赵小强,吴雅莉,杨海平.地西他滨治疗骨髓增生异常综合征的临床观察[J].医学信息,2016,29(20):43-44.
[15] 石瑞平.地西他滨治疗骨髓增生异常综合征的临床疗效观察[J].北方药学,2019,16(3):143-144.
[16] 谢伟成,程淑琴,林翠芳,等.地西他滨治疗骨髓增生异常综合征的临床疗效研究[J].临床和试验医学杂志,2014,13(11):877-880.
[17] 张进辉.地西他滨治疗骨髓增生异常综合征的临床效果分析[J].中外医学研究,2016,14(33):39-41.
[18] 雷蕾,王樹叶.地西他滨治疗骨髓增生异常综合征的临床效果分析[J].中外医疗,2016,35(23):10-12.
[19] 刘仁涛.地西他滨对骨髓增生异常综合征患者的临床疗效与安全性评价[J].抗感染药学,2018,15(9):117-120.
[20] 栗莉,孙巍,白晶.分析地西他滨治疗骨髓增生异常综合征临床效果及安全性[J].智慧健康,2018,4(23):127- 128.
[21] KANG HY,WANG XR,GAO L,et al. Clinical significance of ID4 gene mehtylation in demethylation-treated MDS cell line and 2 MDS patients[J]. J Exp Hematol,2015,23(2):455-459.
[22] RIUS M,STRESEMANN C,KELLER D,et al. Human concentrative nucleoside transporter 1-mediated uptake of 5-azacytidine enhances DNA demethylation[J]. Mol Cancer Ther,2009,8(1):225-231.
(收稿日期:2019-12-20 修回日期:2020-08-11)
(编辑:孙 冰)

