萘酰亚胺基硫醚型光引发剂的合成与性能研究
李雪纯 于佳 孙芳
摘要:以4-溴-1,8-萘二甲酸酐和4-甲氧基苄基硫醇为原料合成了一种单组份萘酰亚胺基硫醚型光引发剂NPS。研究了NPS的紫外一可见光吸收性能、光解机制和引发光聚合能力。结果表明,NPS在常用的LED光源发射波长下具有优异的光吸收性能,在384nm处有最大吸收峰,该吸收峰强度随着光辐照时间的延长逐渐降低。在405nm LED照射下,NPS分子通过苄硫基的C-S键断裂和夺氢反应两个过程产生具有引发活性的对甲氧基苄基自由基、取代的萘硫自由基和a-酰亚胺基烷基自由基。NPS光引发剂可以较好的引发丙烯酸酯类单体的自由基聚合,并对氧阻聚有一定的抑制作用。
关键词:光引发剂;LED光聚合;萘酰亚胺;芳硫醚
中图分类号:TQ5724.4,TQ630.1,TQ325
文献标识码:A
文章编号:1001-5922(2020)09-0001-05
LED光固化技术因其所用光源设备的使用寿命较长、能量转换率和能量利用率高、不产生臭氧、生產成本低等优势而逐渐成为目前研究的热点[1-4]。但是,目前工业上常用的光引发剂的吸收波长与LED光源发射波长难以匹配,无法用于LED光聚合体系,因此急需人们对适用于LED光聚合的光引发剂的种类进行拓展和研究[5-7]。迄今为止,针对这方面的研究主要集中在多组份光引发体系的开发上[8-10]。然而,这种多组分光引发体系包括增感剂、光敏剂、供氢体以及其他助剂等组份,在使用的过程中存在着配方复杂的缺点,同时还存在着不同程度的小分子挥发问题,这将导致环境污染,也会带来人体的健康问题[11-13]。因此,开发适用于LED光源的单组份的Norrish I型光引发剂对LED光聚合技术的发展具有重要的意义。
以萘酰亚胺为骨架的化合物有着较好的光吸收性能,能在常用LED光源的发射波长下有着较高的摩尔消光系数,可应用于光引发剂的设计之中。在高压汞灯的照射下,含有C-S键的化合物经C-S键均裂产生的自由基可以引发聚合,如苯硫二苯甲酮[14]。结合以上两点,本文设计开发了一种适用于LED光源的新颖的Norrish I型萘酰亚胺基硫醚型光引发剂(NPS),并对NPS的光吸收性能、光解行为及引发光聚合能力的进行详细研究,这将为光引发剂的设计提供新的思路。
1 实验材料和方法
1.1 药品与仪器
1,1一双(二苯基膦)二茂铁(dppf)、4-甲氧基苄基硫醇(SH)和无水K3P04均购于北京偶合科技有限公司,5,5-二甲基一1-吡咯啉氮氧化物自由基捕捉剂(DMPO)购于东仁化学科技(上海)有限公司,无水NiC12和4-溴-1,8一萘二甲酸酐(NA)购于萨恩化学技术(上海)有限公司,1,6-己二醇二丙烯酸酯(HDDA)则购于长兴树脂公司,乙酸酐(Ac20)、无水乙醇(EtOH)、丙酮(acetone)、甲苯(toluene)和乙腈均购于北京化工厂,40%甲氨水溶液(CH3NH2)购于福晨(天津)化学试剂有限公司,双(二亚苄基丙酮)钯(Pd(dba)2)购自北京百灵威科技有限公司,叔丁基苯购于艾览(上海)化工科技有限公司。
深圳兰普里克公司UVEC-411 LED点光源照射机,德国Bruker公司Avance 400M核磁共振仪(NMR),德国Honele公司Honele UVmetre UV光强计,德国Bruker公司ELEXSYS II电子顺磁共振波谱仪,美国Thermo Electron公司Nicolet 5700实时红外光谱仪,日本岛津公司UV-3600紫外分光光度计。
1.2 萘酰亚胺基硫醚型光引发剂NPS的制备
NPS的制备流程如图1所示。在50mL的单口瓶中加入SH (6.17g, 0.040mol)、 NiC12 (0.518g,0.004mol)和Ac20(8.16g,0.080mol)。经室温搅拌4h,将反应液倒人lOOmL的去离子水,混合液用CH7Cl2萃取3次,取有机相以10%的NaHC03水溶液和去离子水分别洗涤3次,以无水Na2S04干燥有机相后,旋蒸除去溶剂得到粗产物。粗产物经柱层析提纯后,得到呈无色液体状的PS (7.22g,产率为92%)。在250mL的单口烧瓶中,加入NA (2.77g,O.OlOniol)、150mL无水EtOH和40%的CH。NH2水溶液(2.72g,0.035mol),将反应液于室温下进行3d的搅拌。之后过滤反应液,保留滤饼,用EtOH洗涤滤饼3次,再将滤饼真空干燥得到淡黄色的固体BN (2.85g,产率98%)。最后在25mL的三口烧瓶内添加BN(0.580g, 0.002mol)、Pd (dba)2(0.115g,0.2mmol)、PS (0.393g, 0.002mol)、dppf (0.ll5g,0.28mmol)、K3PO4(1.02g,4.8mmol)、4mL的甲苯和2mL的丙酮。在N2的保护下,以IIOoC搅拌反应液12h。之后将反应液冷却至室温,将其倒人饱和NH4Cl的水溶液中,以CH2Cl2萃取3次,保留有机相,再以饱和NaCl水溶液洗涤3次。所得混合液经干燥、过滤和旋蒸除去溶剂后得到粗产品,再用柱层析提纯,得到呈黄色固体状的NPS (0.456g,产率63%)。
1.3 电子顺磁共振(ESR)测试
使用Matlab软件模拟苄基自由基、芳基硫自由基和烷基自由基的电子顺磁共振谱图。配置浓度为1×10-4mo1L-1的NPS的叔丁基苯溶液,在该溶液中加入摩尔量为5倍的自由基捕捉剂5,5-二甲基-1-毗咯啉N-氧化物。待溶液于避光条件下通15minN2后,向毛细管装入该溶液。用电子顺磁共振波谱仪(EIEX-SYS II)测试溶液在光强为IOOITiWCITI-2的405nm的LED点光源照射15min的电子顺磁共振谱图。
1.4 光聚合性能测定
选取HDDA为单体,与光引发剂NPS混合均匀配制成感光液,光引发剂NPS占HDDA总质量的0.5%。辐射光源是光强为lOOrriWcrri-2的405nm的LED点光源。用两个KBr盐片形成夹层,夹层中涂有感光液,使其保持在阻氧条件中,夹层的厚度约为30μm;或将感光液直接涂在暴露于空气中的KBr盐片,在辐射光源的照射下进行光聚合性能的测定。在测试过程中,使用实时红外光谱仪(Nicolet 5700)来监测双键的特征峰831-792cm-1的峰面积变化,通过该峰面积的变化得到丙烯酸酯双键转化率。
2 结果和讨论
2.1 光引发剂NPS的光吸收性能
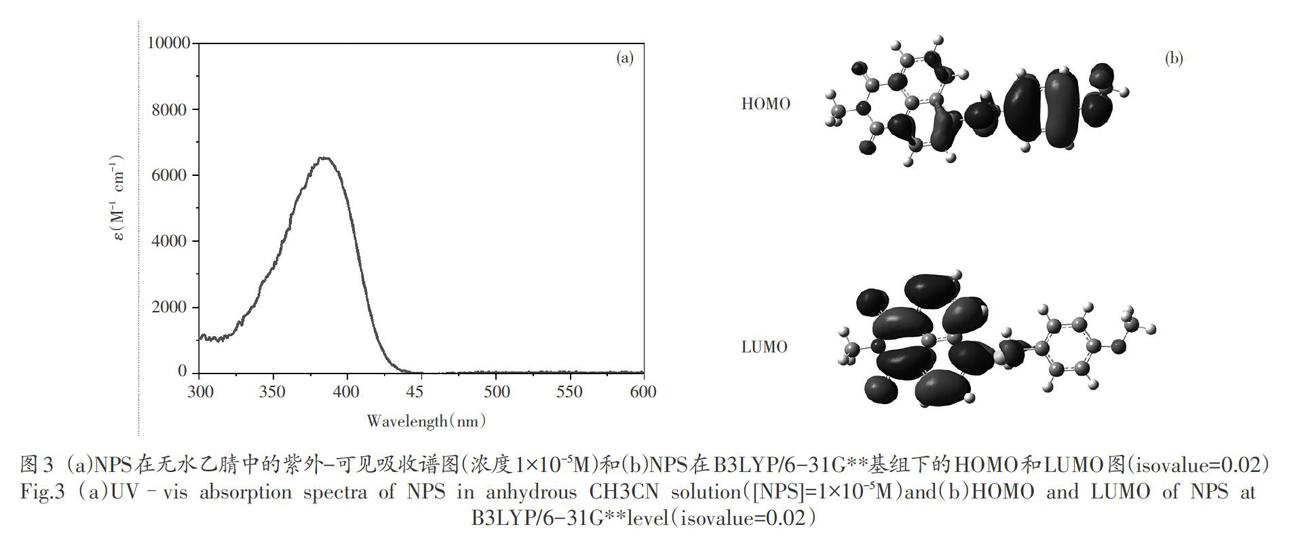
为了探究NPS的光吸收性能,我们测试了其紫外一可见吸收光谱。如图3 (a)所示,NPS的最大吸收峰位于近紫外区的384nm,吸收带能进入可见光区域。此外NPS在常用的LED光源发射波长下也有良好吸收:8385nm、8395nm和e405nm分别为6500M-1cm-1、5900M-1cm-1和4100M-1cm-1。通过理论计算[15,16],我们得到了NPS的前线轨道分布结果。图3(b)表明,最高占有轨道(HOMO)集中在含有硫和甲氧基取代的苯环一侧,而最低未占有分子轨道(IUMO)则主要分布于萘酰亚胺基团上。这种前线轨道分布使得NPS受光激发后,电子易从含硫的苯环一侧转移到萘酰亚胺基团上,令NPS具有良好的光吸收性能[17],具有应用于LED光固化领域的优势。
2.2 NPS的稳态光降解
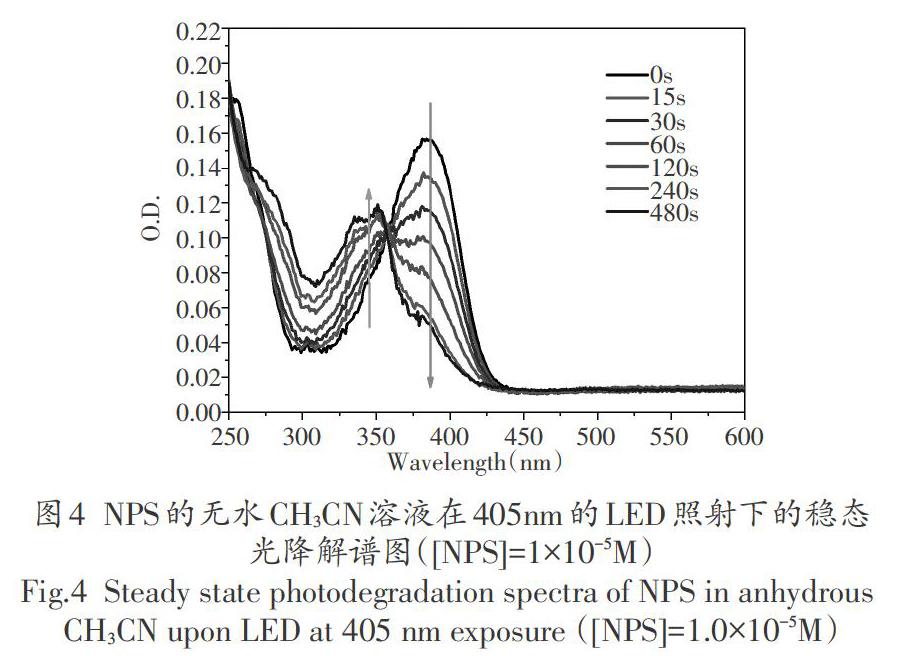
随着405nm的LED辐照时间的增加,NPS的UV- vis光谱出现了明显的变化。首先,NPS位于384nm处的最大吸收峰随着照射时间的延长而不断减弱,同时在335-350nm范围出现一个强度不断提升的新吸收峰。这说明NPS不仅在405nm的LED照射下不断光解,其光解产物的吸收峰处于335-350nm,且产物的浓度还在随着光照时间的增加而上升。其次,NPS的光解过程未出现副反应,这可由图4中的位于358nm和265nm的等吸收点所证实[18]。
2.3 NPS的ESR光谱
由于NPS分子结构中的萘酰亚胺基团可作为Nor-rish II型光引发剂使用,且其氮原子上有一个甲基取代基,能够作为供氢体使NPS以单组份的形式引发聚合。结合NPS分子结构中的C-S键,NPS极有可能既是一种单组份Norrish II型光引发剂又是一种NorrishI型光引发剂。为了进一步探究NPS在LED照射下发生碳硫键均裂或通过夺氢反应产生自由基的能力,我们测试了光照后NPS的ESR信号,结果如图5(a)所示。同时,我们拟合了苄基自由基(aN=14.5C,aH=21.3G)、芳硫自由基(aN=12.3C,aH=13.0)和烷基自由基(aN=16.1C,aH=23.0G)的ESR谱图[19,20],如图5 (b)所示。对比图5(a)和图5(b)可以发现,两者相似。这表明NPS能够在405nm的LED辐照下,既能通过碳硫键的均裂产生对甲氧基苄基自由基和芳硫基自由基,还能依靠分子间的夺氢反应生成烷基自由基。为了进一步阐明NPS发生裂解反应的机理,我们通过理论计算得到了NPS所含的两种C-S键的键能:苄硫基的C-S键的键能为264.55kjmol-1,而萘硫基的C-S键的键能更高,是332.7lkjmol-1。因此,NPS在光照下的裂解反应主要依靠能量更低的苄硫基的C-S键的均裂,从而生成取代的萘硫自由基和对甲氧基苄基自由基。基于上述推论,我们推测NPS的光解机制为(图6):以405nm的LED为光源时,NPS从基态到达激发态*NPS。*NPS不仅能经历苄硫基的碳硫键的均裂,生成取代的萘硫自由基( ArS‘)和对甲氧基苄基自由基(CH30-Bri),还能与另一分子的NPS通过分子间的夺氢反应生成a-酰亚胺基烷基自由基。
2.4 光聚合动力学
首先我们考察了NPS在阻氧条件下引发HDDA自由基聚合的能力,图7表明NPS起初引发HDDA聚合的速率较快,聚合最大速率达到2.64%s-1,光照50s后双键轉化率的增长变得缓慢,当光照时间达到200s时,HDDA的双键转化率达到70%。这说明NPS在405nm的LED光照下产生的自由基能在阻氧条件下较好地引发HDDA的自由基聚合。
之后,我们探究了NPS在有氧条件下,以相同的光源照射时对于HDDA自由基聚合的引发能力。从图8可以看出,虽然HDDA的双键转化率与阻氧条件相比增长缓慢,但是在光照时间达到900s后,其最终双键转化率达到28%。因此,NPS具有一定的抗氧阻聚能力,可以在有氧条件下引发自由基聚合。NPS的抗氧阻聚能力是由于它能通过两种机理产生具有引发能力的自由基,然而NPS对氧阻聚的抑制作用还有待通过进一步优化分子结构来提高。
3 结语
在文章中,我们合成了一种新颖的单组份萘酰亚胺基硫醚型光引发剂NPS。 NPS的吸收光谱能与常用的LED光源的发射光谱所匹配。对NPS的光解机理进行研究,结果表明NPS可以依靠苄硫基碳硫键的均裂和分子间的夺氢反应2个途径来产生具有引发能力的自由基,同时起到了Norrish I型和单组份Norrish lI型光引发剂的作用。这种产生自由基的双重机制使NPS不仅能在阻氧条件下,有效地引发HDDA的自由基聚合,还具有一定的抗氧阻聚能力。
参考文献
[1] Hongyuan Fu, Yunzhao Qiu, Jian You, et aI.Photopo-lymerization of acrylate resin and ceramic suspensionswith benzylidene ketones under blue/green LED[J].Poly-mer, 2019, 154(19): 121841.
[2] Dietlin C,Schweizer S,Xiao P,et al.Photopolymeriza-tion upon LEDs: new photoinitiating systems and strate-gies [J].Polymer Chemistry, 2015,6(21): 3895-3912.
[3] Yong Wang, Weixiang Han, Tao Wang, et al.Facile-ly prepared blue- green light sensitive curcuminoidswith excellent bleaching properties as high performancephotosensitizers in cationic and free radical photopoly-merization[J].Polymer Chemistry, 2018,9(14):1787-1798.
[4] Weixiang Han, Yizhong Shi, Tanlong Xue, et al.Syn-thesis and electrochemical, linear and third- order non-linear optical properties of ferrocene- based D-π一Adyes as novel photoredox catalysts in photopolymeriza-tion under visible LED irradiations[J].Dyes and Pig-ments , 2019 , 166 : 140-148.
[5] Kirschner J, Bouzrati-Zerelli M, Fouassier J P, et al.Silyl glyoxylates as high-performance photoinitiators forcationic and hybrid polymerizations : towards better poly-mer mechanical properties[J].Joumal of Polymer SciencePart A : Polymer Chemistry , 2019 , 57 ( 13) : 1420-1429.
[6] Julie K, Florian S, Mariem B Z, et al.lodonium sulfo-nates as high-performance coinitiators and additives forCQ-based systems : toward aromatic amine-free photoini-tiating systems[J].Joumal of Polymer Science Part A:Polymer Chemistry , 2019 , 57 ( 15) : 1664- 1669.
[7] Shaoyi Liu, Dami en Brunel, Ke Sun, et al.A mono-component bifunctional benzophenone-carbazole type lIphotoinitiator for LED photoinitiating systems[J].PolymerChemistry , 2020 , 11 (21) : 355 1-3556.
[8] Abdallah M , Hijazi A, Lin J T, et al.Coumarin deriva-tives as photoinitiators in photo-oxidation and photo-re-duction processes and a kinetic model for simulations ofthe associated polymerization profiles[J].ACS AppliedPolymer Materials , 2020 , 2( 7) : 2769-2780.
[9] Rahal M, Abdallah M, Bui T T, et al.Design of newphenothiazine derivatives as visible light photoinitiators[J]. Polyruer Chemistry , 2020 , 11 ( 19) : 3349-3359.
[10] Sautrot-Ba P, Jockusch S, Malval J P, et aI.Quiniza-rin derivatives as photoinitiators for free-radical and cat-ionic photopolymerizations in the visible spectral range[J]. Macromolecules , 2020 , 53 (4) : 1129-1141.
[11] Julie K, Alexandre B,Bemadette G, et al. 1-aryl-2-(triisopropylsilyl) ethane- 1, 2- diones: toward a newclass of visible type I photoinitiators for free radical po-lymerization of methacrylates[J]. Macromolecular RapidCommunications , 2019 , 40 ( 20) : 1900319.
[12] Tingjie Zhan, Liumeng Pan, Zhengfeng Liu, et al.Metabolic susceptibility of 2-chlorothioxanthone and itstoxic effects on mRNA and protein expression and activi-ties of human CYPIA2 and CYP3A4 enzymes[J] Envi-ronmental Science & Technology , 2018 , 52 ( 20) : 11904-11912.
[13] Rhodes M C,Bucher J R, Peckham J C, et al.Carci-nogenesis studies of benzophenone in rats and mice[J].Food and Chemical Toxicology ,2007,45(5) : 843-851.
[14] Fouassier J P, Lalevee J.Photoinitiators for polymersynthesis- scope , reactivity , and efficiency[M].Weinheim :Wiley-VCH Verlag GmbH & Co KGaA ,2012.
[15] Xiaoyu Ma , Renquan Cu , Liujian Yu , et al.Conjugat-ed phenothiazine oxime esters as free radical photoinitia-tors [J].Polymer Chemistry , 2017 , 8 ( 39) : 6134-6142.
[16] Kosar N, Mahmood T, Ayub K. Role of dispersioncorrected hybrid CCA class in accurately calculatingthe bond dissociation energy of carbon halogen bond: abenchmark study[J].Journal of Molecular Structure,2017 , 1150 : 447-458.
[17]黄春辉,李富友,黄维,有机电致发光材料与器件导论[M],上海,复大学出版社,2005.
[18] Sarker A M, Sawabe K, Strehmel B, et aI.Synthesisof polymeric photoinitiators containing pendent chromo-phore- borate ion pairs: photochemistry and photopoly-merization activities[J].Macromolecules , 1999, 32 ( 16) :5203-5209.
[19] Caihong Zheng, Fangling Lu, Hanwei Lu, et al.Cop-per catalyzed selective radical- radical cross- couplingfor C-S bond formation : an access to a-alkylthionitriles[J].Chemical Communications , 2018 , 54 ( 44) : 5574-5577.
[20] Criqui A, Lalevee J, Allonas X, et al.Electron spinresonance spin trapping technique: application to thecleavage process of photoinitiators[J].MacromolecularChemistry and Physics , 2008 , 209 ( 21 ) , 2223-2231.
作者簡介:李雪纯(1998-)女,研究方向:紫外光固化材料。E-mail: lixuechun0116x@163.com
通讯作者:孙 芳,E-mail: sunfang60@yeah.net

