Na+、Ca2+及Na+-Ca2+混合离子对胡敏酸胶体稳定性的影响*
李少博,徐英德,张 昀,张广才,左 研,汪景宽,高晓丹
Na+、Ca2+及Na+-Ca2+混合离子对胡敏酸胶体稳定性的影响*
李少博,徐英德,张 昀,张广才,左 研,汪景宽,高晓丹†
(沈阳农业大学土地与环境学院,农业部东北耕地保育重点实验室,沈阳 110866)
以胡敏酸为研究对象,通过光散射技术比较土壤中常见盐基离子(Na+、Ca2+和Na+-Ca2+混合三种电解质)不同浓度条件下胡敏酸胶体凝聚动力学过程,明确不同价态离子界面行为和陪补离子效应对胡敏酸分散稳定性和凝聚体结构的影响。结果发现,Na+和Ca2+对胡敏酸胶体聚沉能力的差异远远大于舒尔策-哈迪(Schulze-Hardy)规则中因其化合价不同所引起的差异;Na+-Ca2+混合体系中Ca2+主导凝聚过程,且Na+-Ca2+混合与Ca2+两种离子体系中凝聚现象的差异随离子浓度的降低而增大;混合离子体系中Na+作为陪补离子,其陪补离子效应对临界聚沉浓度、颗粒间活化能和胡敏酸凝聚体结构均有一定影响,尤以对凝聚体的结构特征影响显著;Na+-Ca2+混合体系中胡敏酸凝聚体的结构紧实程度介于单纯离子体系之间,因此可通过调节溶液中的离子组成实现对凝聚体结构紧实程度的调控。上述结果表明,Ca2+对胡敏酸的聚沉不仅依赖于静电作用,还有Ca2+在强电场中的极化诱导其与胡敏酸表面含氧官能团之间发生的共价键和桥键的贡献;此外,陪补离子Na+与Ca2+在胡敏酸胶体表面的竞争吸附抑制了Ca2+对胡敏酸的聚沉作用,从而形成紧实程度适中的结构体。研究结果为探究胶体界面反应及土壤胶体凝聚机制提供新的思路和理论。
胡敏酸胶体;盐基离子;光散射;胶体稳定性;陪补离子
胡敏酸是由不同分子量有机组分通过疏水、氢键等作用形成的高分子聚合物,是研究土壤有机质的重要标识物[1-3]。胡敏酸胶体因其较大的比表面积和负电性而难以单独存在[4],在自然条件下会与金属离子及其氧化物或矿物质相互作用形成有机-无机复合体,同时也会与其他有机质发生络合作用[5-8]。因此,胡敏酸的分散稳定性必然影响土壤生态系统中金属离子和一些污染物的环境归趋。
通常,胡敏酸胶体的凝聚与分散受德查金-朗道-维韦-奥弗比克(Derjaguin-Landau-Verwey- Overbeek,DLVO)理论的支配,并高度依赖于环境条件的变化(如溶液体系的温度、pH和所含离子种类等)[9]。这些因素通过介导胶体颗粒间的DLVO力影响胶体的相互作用和分散稳定性[4,10-11]。土壤溶液中存在大量的金属阳离子[11],这些反号离子使得胡敏酸颗粒双电层被压缩,颗粒间的静电斥力减弱,从而促进胡敏酸的凝聚。以往研究表明,不同金属阳离子对胡敏酸的凝聚效力大小及作用过程是不同的。Tan等[4]发现铕离子(Eu3+)以较锶离子(Sr2+)和铯离子(Cs+)低得多的浓度诱导胡敏酸胶体凝聚,其中高价的Eu3+和Sr2+离子可在胡敏酸分子之间形成分子内或分子间桥来促进凝聚过程,而Cs+不能形成分子间桥。高晓丹等[10]研究发现,在一定pH条件下,Ca2+和Cu2+因其在表面吸附作用的不同而对胡敏酸胶体的聚沉能力有显著的差异,且形成的凝聚体具有不同的老化特征。另有学者[12]通过分子模拟研究了不同金属离子与胡敏酸作用形成复合物的结构差异,发现Ca2+可与胡敏酸表面形成桥键从而形成结构复杂的凝聚体。
尽管国内外大量研究均证实了不同离子类型及浓度对胡敏酸胶体的聚沉作用和机制的差异,但大多数研究均基于单一离子体系进行。而土壤是一个复杂、开放的多元素共存体系,因而十分必要在单一离子体系相关研究的基础上,探究多离子体系对胡敏酸凝聚过程影响的综合效应,不断丰富和发展固-液界面理论。Na+和Ca2+是土壤中最为常见的两种盐基离子,且在土壤胶体表面的竞争吸附作用直接决定土壤的理化性质[13]。研究表明,棕壤中添加陪补离子后,随温度的增加,土壤对Ca2+的吸附受到抑制[14]。然而,Na+作为陪补离子下的Na+-Ca2+混合体系对胡敏酸胶体凝聚及其稳定性的影响尚不明确。基于此,本研究针对Na+、Ca2+和Na+-Ca2+三种不同浓度的电解质对胡敏酸胶体的凝聚动力学过程的影响做了比较,采用动、静态光散射技术[10],分别探究胡敏酸在观测时间内凝聚体粒径的变化、平均凝聚速率、临界聚沉浓度、活化能及凝聚体的分形维数,定量分析不同价态盐基离子和混合离子体系中陪补离子效应对胡敏酸胶体稳定性和凝聚结构体的影响。研究结果可为明晰土壤颗粒间的相互作用机制及土壤团聚体的稳定机制提供理论依据,对胡敏酸在土壤肥力及环境保护领域的合理应用具有重要的实践意义[15]。
1 材料与方法
1.1 胡敏酸胶体的纯化与表征
供试胡敏酸胶体由胡敏酸粉末(巨枫化学科技有限公司,上海)经纯化后获得。胡敏酸粉末的基本性质:粉末状,200目,微溶于水,胡敏酸含量大于97%,总酸性基含量为135.1 mg·g–1,酸性基绝大部分为羧基(羧基量为132.5 mg·g–1),另外还有小部分酚羟基(酚羟基量为2.64 mg·g–1)。
胡敏酸的纯化[10]:称取10 g胡敏酸粉末溶解于1 L 0.1 mol·L–1的KOH溶液,以6 000 r·min–1的速度离心20 min,以去除其中含有的杂质。经离心获得的胡敏酸悬液用HCl调pH至1~1.5,静置后离心,弃上清液,再用KOH溶解沉淀,如此酸碱反复处理3次,收集所有胡敏酸沉淀,超纯水洗3次后移入1 L大容量瓶中定容备用。
胡敏酸胶体制备:取纯化后的胡敏酸悬液300 mL于烧杯中,用KOH调pH至7.5,探针型超声波处理器20 kHz分散20 min,静置24 h。图1是25 ℃下胡敏酸(颗粒密度为0.015 7 g·L–1)胶体悬液的粒径分布。由图可见,实验用胡敏酸胶体的有效粒径为123.6 nm,分布范围48.77~313.4 nm。
1.2 凝聚实验
本研究所设置的电解质浓度梯度如下:Na+:100、150、200、250、300、400和500 mmol·L–1;Ca2+:0.5、1、1.5、2、3、4和5 mmol·L–1;Na+-Ca2+:0.5、1、2、3、4、8和10 mmol·L–1。本实验中按照Na+、Ca2+的物质的量浓度比为1︰1的比例配置1 mol·L–1Na+-Ca2+混合电解质溶液,将混合液逐级稀释用于实验中。根据所设置的不同浓度,按照1 mL胡敏酸胶体悬液—超纯水—电解质溶液的顺序加样于散射瓶中,确保待测液总体积为10 mL,轻摇均匀后置于样品池开始测定。监测仪器为广角度激光散射仪(BI-200SM,Brookhaven,美国),数字相关器为BI-9000AT,设定激光器功率为200 mW。具体步骤:打开激光器预热30 min,并使用温控器将测量体系温度控制为25℃。动态光散射实验设置狭缝100 nm,散射角90°,测定时间40 min。
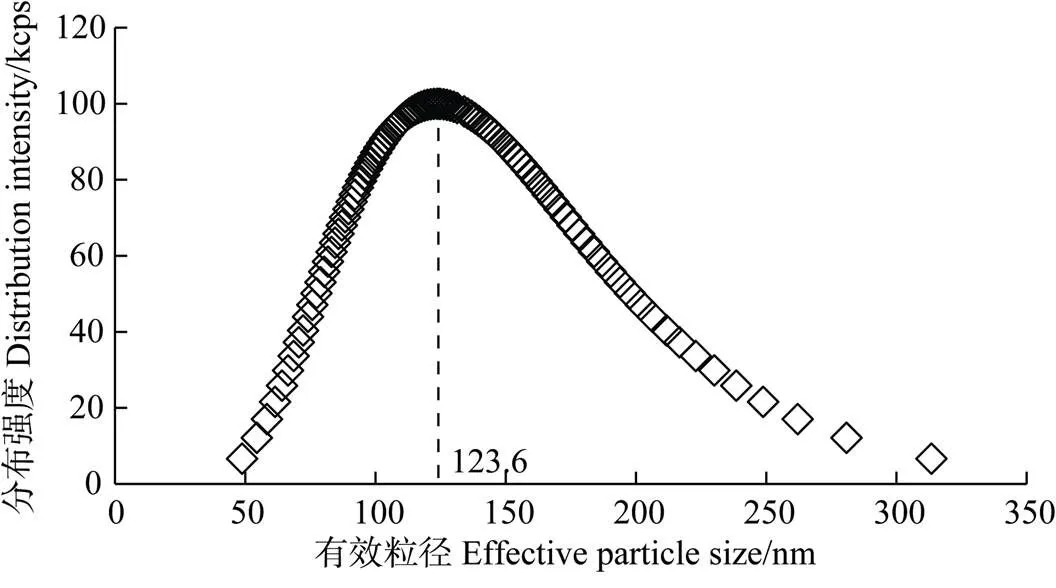
图1 胡敏酸胶体的粒径分布
胡敏酸凝聚体的分形维数d测定:通过静态光散射测定散射光强随散射矢量的变化,可测得散射指数,当散射指数不变时,即为凝聚体的分形维数[16]。在动态光散射测定后的24 h测定凝聚体的分形维数,表征凝聚完成时的凝聚体结构特征;放置60 d后进行第二次分形维数的测定,表征老化后的凝聚体结构特征。静态光散射扫描范围从15°~120°,每隔15°扫描一次。
凝聚速率的计算:将动态光散射所测得的有效水力直径大小随时间的变化关系做散点图,并得出拟合方程。将复合体的有效直径大小对凝聚时间求导,即可得到凝聚速率随时间的变化(()~),进而可求得一定时间段内其粒径增长的平均速率。总体平均凝聚速率(Total average aggregation rate,TAA)[17]为:
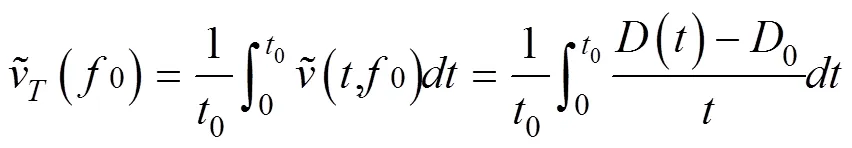
将相对较低电解质浓度下的平均凝聚速率值和相对较高电解质浓度下的平均凝聚速率值分别拟合成两条直线,这两条直线的交点处对应的电解质浓度值即为临界聚沉浓度(Critical coagulation concentration,CCC)。CCC为在指定条件下,使胶体发生快速凝聚所需的最低电解质浓度[18]。
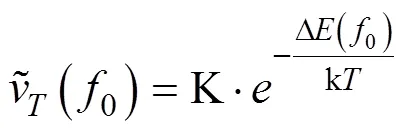
式中,Δ(0)为活化能,J·mol–1;k为Botzmann常数,J·K–1;为绝对温度,K;K是一个常数。由于0=CCC时Δ(0)=0,所以有:
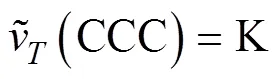
将方程(3)代入方程(2),得到活化能的计算公式:

1.3 红外光谱测定
分别取单纯的胡敏酸、4 mmol·L–1Na+-Ca2+和4 mmol·L–1Ca2+作用24 h后的胡敏酸凝聚体悬液于蒸发皿中,经真空冷冻干燥机(SCIENTZ-10N,新芝,宁波)在冷阱–50℃、压力10 Pa条件下冷冻干燥约24 h,收集胡敏酸粉末。按照样品与KBr比例为1︰200称取KBr粉末于玛瑙研钵中,再分别加入上述胡敏酸粉末样品,在红外灯照射下研磨至颗粒小于2 μm后用手动压片机制片。制好片后用傅里叶变换红外光谱仪(IRAffinity-1S,岛津,日本)测定样品谱图。设置上机分析的分辨率为4 cm–1,波数范围:400~4 000 cm–1。
2 结果与讨论
2.1 不同离子体系中胡敏酸胶体凝聚体粒径随时间的变化
胡敏酸胶体悬液中加入不同浓度的电解质组合后,其凝聚体的粒径随时间变化如图2所示。从图中可以看出,Na+、Ca2+和Na+-Ca2+三种类型的电解质均可引发胡敏酸胶体不同程度的凝聚。电解质的浓度越大,粒径增加的速度越快。在监测时间内,当Na+为100 mmol·L–1时,胡敏酸凝聚体粒径从183.1 nm增长至397.0 nm,粒径随时间呈线性增长的关系,说明在低电解质浓度下的胶体双电层重叠所产生的静电排斥力较强,使胶体颗粒间有效碰撞概率小于1,其凝聚为慢速的反应控制团簇凝聚(Reaction-limited cluster aggregation,RLCA)机制[20]。当Na+为500 mmol·L–1时,胡敏酸凝聚体粒径从896.4 nm增长至2 887 nm,粒径随时间呈幂函数增长,说明在较高电解质浓度条件下,胶体颗粒间的静电斥力逐渐减小,颗粒间的有效碰撞概率逐渐增大,近乎等于1,此时凝聚为快速的扩散控制团簇凝聚(Diffusion-limited cluster aggregation,DLCA)机制[10]。同样,随着Ca2+和Na+-Ca2+体系中电解质浓度的增加,胡敏酸凝聚体粒径也由线性增长转化为幂函数增长,分别对应着RLCA和DLCA两种凝聚机制。
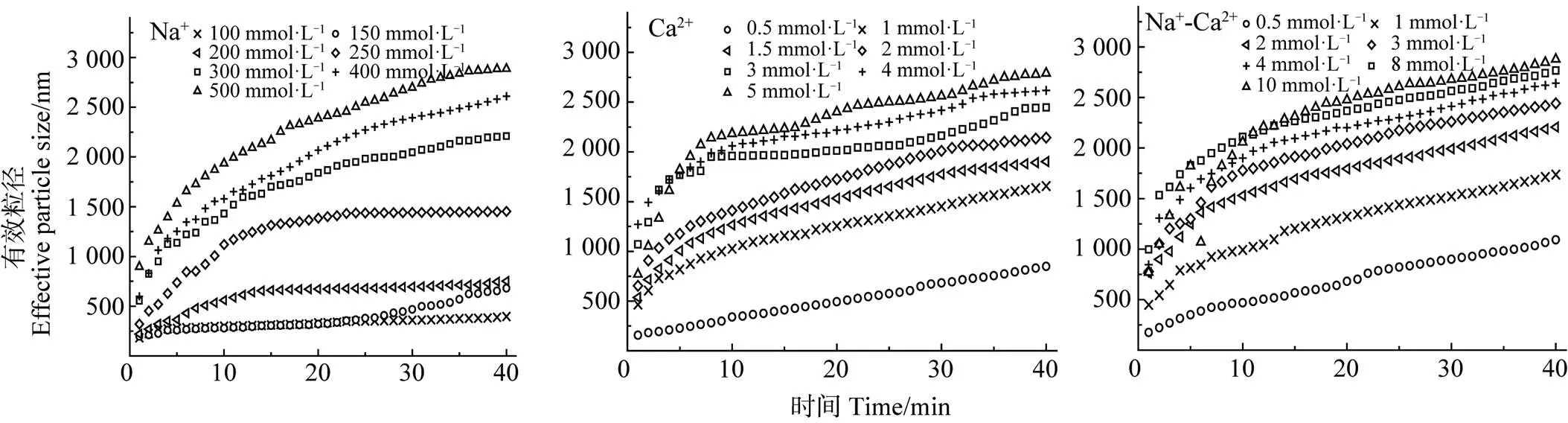
图2 不同离子组合下胡敏酸胶体凝聚体的有效粒径增长
此外,Ca2+对胡敏酸胶体的聚沉能力远大于Na+。Na+引发胡敏酸胶体由慢速凝聚到快速凝聚所包含的浓度梯度为100~500 mmol·L–1,而Ca2+所需的浓度梯度仅为0.5~2 mmol·L–1。当Na+为100 mmol·L–1时,胡敏酸凝聚体有效粒径随时间呈线性增长,最大粒径为397.0 nm;当Ca2+为5 mmol·L–1时,胡敏酸凝聚体粒径随时间则呈幂函数增长,且最大粒径可达2 791 nm。可见,虽然Na+浓度为Ca2+的20倍,但其引发凝聚所形成的胡敏酸凝聚体的粒径却远小于Ca2+,说明Ca2+引发胡敏酸胶体的聚沉能力远大于Na+。在Na+-Ca2+混合体系中,仍然是Ca2+离子对胡敏酸的凝聚过程发挥主导作用。对比Ca2+和Na+Ca2+两种组合可见,电解质为0.5、1和2 mmol·L–1时,Ca2+和Na+-Ca2+体系中对应的凝聚体粒径分别增长至848.7、1 656、2 144 nm和1 092、1 737、2 206 nm,此时Na+-Ca2+体系中的胡敏酸凝聚体粒径大于Ca2+的体系。而当电解质为3、4 mmol·L–1时,Ca2+和Na+-Ca2+对应的凝聚体粒径分别增加至2 447、2 617 nm和2 442、2 641 nm,这时Na+-Ca2+体系中凝聚体粒径接近Ca2+体系。可见,Na+-Ca2+和Ca2+对胡敏酸胶体聚沉作用的差异在较低的电解质浓度下更显著。
DLVO理论一直是胶体稳定性研究的基础理论,胶粒的分散与聚沉由范德华引力和双电层斥力共同主导[9]。Tang等[21]研究表明,同一体系中电解质浓度越高,胶粒越易凝聚。本研究结果也表明,低离子浓度条件下,胶体的扩散双电层较厚,颗粒间排斥力高,有利于胶体体系保持分散的稳定状态,而随着离子浓度的增加,胶体扩散双电层被反号离子压缩、厚度变小,颗粒间排斥力降低,颗粒间引力占优势,从而利于胶体的凝聚[22-24]。相似的,本研究中胡敏酸胶体的凝聚对Ca2+的敏感程度远大于Na+,这主要是由于高价离子对胶体表面附近的双电层压缩能力较强,导致其在胶体表面的吸附能力和对胶体的聚沉能力强于低价离子。
2.2 不同离子体系中胡敏酸胶体总体平均凝聚速率和临界聚沉浓度变化
不同离子组合及浓度下胡敏酸胶体的总体平均凝聚速率(TAA)随电解质浓度变化如图3。当电解质浓度为0.5、1和2 mmol·L–1时,Ca2+体系中的平均凝聚速率分别为18.60、61.66、88.76 nm·min–1,Na+-Ca2+体系的分别为28.14、62.57、92.79 nm·min–1,此时Na+-Ca2+体系凝聚速率稍快于Ca2+体系。随着电解质浓度的升高,在3、4 mmol·L–1时,Ca2+体系中的平均凝聚速率分别为116.8、127.2 nm·min–1,Na+-Ca2+体系中分别为105.7、117.5 nm·min–1。此时Na+-Ca2+体系凝聚速率稍慢于Ca2+体系。
此外,随着各离子体系中电解质浓度的升高,胡敏酸胶体凝聚速率呈现出不同变化模式,即先直线升高而后趋于平缓。两种模式分别对应着RLCA慢速凝聚阶段和DLCA快速凝聚阶段,用线性关系拟合后的交点为临界聚沉浓度,即CCC[18]。经计算,Na+、Ca2+、Na+-Ca2+三种类型离子体系中的CCC值分别是331.1、2.48、2.82 mmol·L–1。
Na+的CCC值最大,说明其对胡敏酸胶体的聚沉能力远远小于Ca2+和Na+-Ca2+。Na+-Ca2+混合体系的CCC值介于单独的Na+和Ca2+之间,更靠近Ca2+的CCC值(图 3),即由于化合价的差异,Na+-Ca2+对胡敏酸胶体的聚沉作用仍由高价离子Ca2+主导。向Ca2+体系中添加Na+,增加的Na+并未导致双电层的进一步压缩和对胡敏酸聚沉作用的显著增强,而仅表现为CCC(Na+-Ca2+)略大于CCC(Ca2+)。这可能的原因是当Ca2+主导胡敏酸的聚沉时,Na+作为其陪补离子,发挥一定的陪补离子效应抑制了Ca2+的聚沉作用。例如,当电解质浓度大于2 mmol·L–1时,随着阳离子浓度的增大,扩散层的厚度变小,原胡敏酸胶体所吸附的部分交换性Ca2+可为Na+所取代,使得Ca2+对胶体的聚沉作用削弱,从而提高了胶体的稳定性,导致CCC的增大。
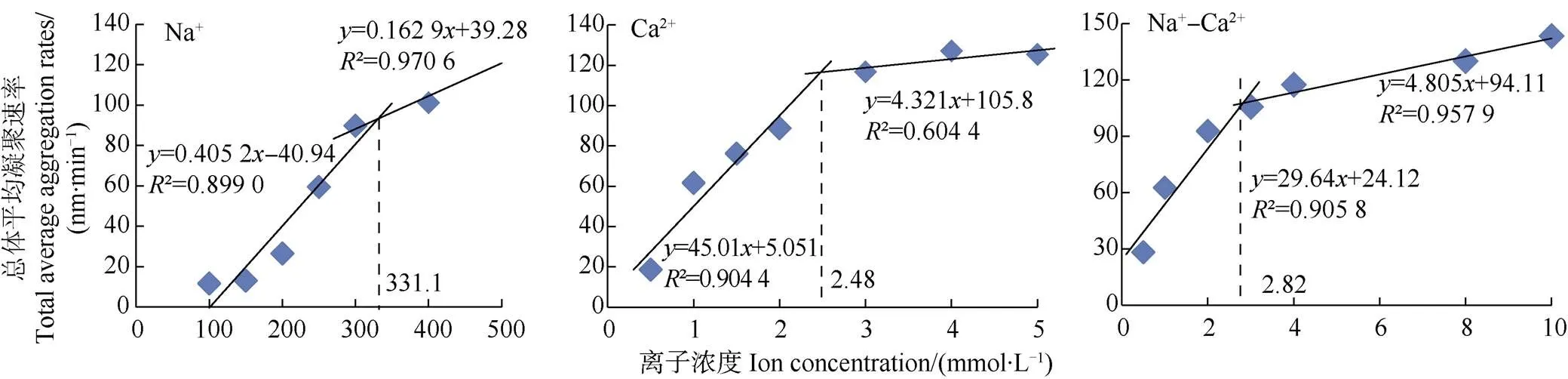
图3 不同离子组合下胡敏酸胶体的总体平均凝聚速率
2.3 不同离子体系中胡敏酸胶体颗粒相互作用的活化能变化
胡敏酸胶体带有大量负电荷,它的分散与凝聚由胶粒之间的排斥作用能和吸引作用能的净能量大小来决定,即净排斥势垒的强弱[4]。活化能越高,颗粒间排斥势垒越强,体系中的离子通过压缩双电层而引发凝聚越困难。
将2.2节中TAA的拟合方程及CCC的值带入方程(4),从而得到各体系中胡敏酸胶体颗粒间活化能∆(0)的计算式:
Na+:(0)=–kln(0.004 40–0.439 2);
Ca2+:(0)=–kln(0.385 80+0.043 3);
Na+-Ca2+:(0)=–kln(0.275 20+0.224 0)
活化能的计算结果如图4所示,随着电解质浓度的升高,各体系的活化能均下降。当Na+浓度为200 mmol·L–1、Ca2+浓度为2 mmol·L–1时,两种体系中活化能分别为:0.82 k、0.20 k。可见,尽管Na+浓度远高于Ca2+,但其作用下胡敏酸胶体颗粒间的排斥势垒却远远高于Ca2+体系。对比Ca2+和Na+-Ca2+两种体系,低离子浓度下的活化能差异较大(图4),这是由于离子浓度的降低,胡敏酸胶粒表面周围的电场强度反而增大。这也很好地解释了2.1节和2.2节中Ca2+和Na+-Ca2+两种体系在较低的电解质浓度下引发胡敏酸胶体聚沉差异较大的现象。

图4 不同离子组合下胡敏酸胶体相互作用的活化能
2.4 不同离子体系中胡敏酸凝聚体的分形维数变化
通过静态光散射测定不同条件下形成的胡敏酸凝聚体在凝聚完成时(24 h)及60 d后的分形维数,以反映凝聚体结构的自相似特性和结构体的疏松和开放程度[25]。从图5可以看出,随着电解质浓度的增加,三种体系中凝聚体的分形维数均呈下降趋势,Na+体系中胡敏酸凝聚体的分形维数普遍较大,Na+-Ca2+次之,Ca2+最小。相同浓度条件下,Na+-Ca2+混合体系中胡敏酸凝聚体的分形维数均大于单独Ca2+体系。同一体系下,分形维数随着电解质浓度增加,即平均凝聚速率的增大而减小,这表明胶体在快速凝聚(DLCA)下易形成结构疏松、孔隙多、较开放的结构;相反,在低浓度的慢速凝聚(RLCA)下易形成结构紧实致密的凝聚体。这是由于慢速凝聚过程有效碰撞概率小于1,使颗粒有更充裕的时间和机会寻找更为契合的吸附位点,从而颗粒间排列更为整齐紧密,结构也更紧实。放置60 d后,各体系中的分形维数出现了明显的降低。
不同离子体系中形成的胡敏酸凝聚体结构存在很大的差异,根据前面讨论的几种离子的聚沉能力差异,Ca2+强烈的聚沉作用使得胶体颗粒之间结合迅速,易形成疏松开放的结构体;Na+作为陪补离子抑制了Ca2+对胡敏酸胶体凝聚,胶体之间凝聚速率放缓,得以形成较紧凑致密的结构体。60 d后,各体系中的分形维数出现了明显降低(图5),这可能由较大的排斥势能影响,在放置期间,凝聚过程伴随着可逆性,一些短程作用力反复作用于凝聚体,导致其重新调整结构。此外,Na+作为Ca2+的陪补离子存在时,虽然对胡敏酸胶体的TAA和CCC无显著影响,但是对所形成的胡敏酸凝聚体结构却产生了很大影响。究其原因可能是Na+作为陪补离子,在双电层中与Ca2+竞争胡敏酸表面有限的吸附位点[13],使得部分吸附位点被聚沉能力弱的Na+占据,降低了胡敏酸颗粒在凝聚过程中的有效碰撞(即能够引发凝聚的碰撞)概率,有利于胡敏酸颗粒的规则排列,从而形成结构紧实的凝聚体。因此在相同浓度条件下,Na+-Ca2+混合体系中胡敏酸凝聚体的分形维数均大于单独Ca2+体系。但在Na+-Ca2+混合体系中两种离子浓度相等,由于Ca2+的化合价优势,使凝聚过程仍受到Ca2+的支配。小于等于2 mmol·L–1的Na+-Ca2+混合体系中Na+根本不会引起胡敏酸胶体的凝聚,但是当把它作为赔补离子加入Ca2+体系中后其对所形成凝聚体结构的影响却不容忽略,可见溶液中离子种类的微小改变会对所形成的凝聚体结构有显著的影响。
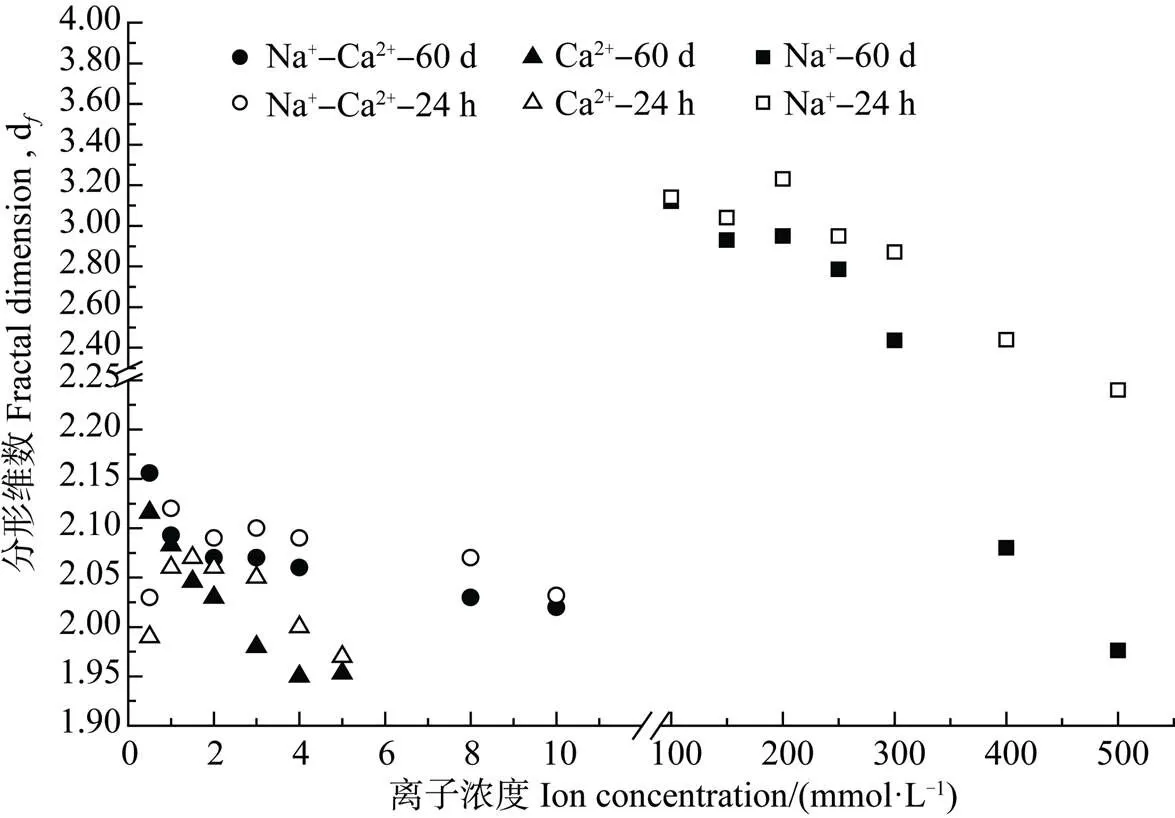
图5 不同离子组合下胡敏酸凝聚体的分形维数
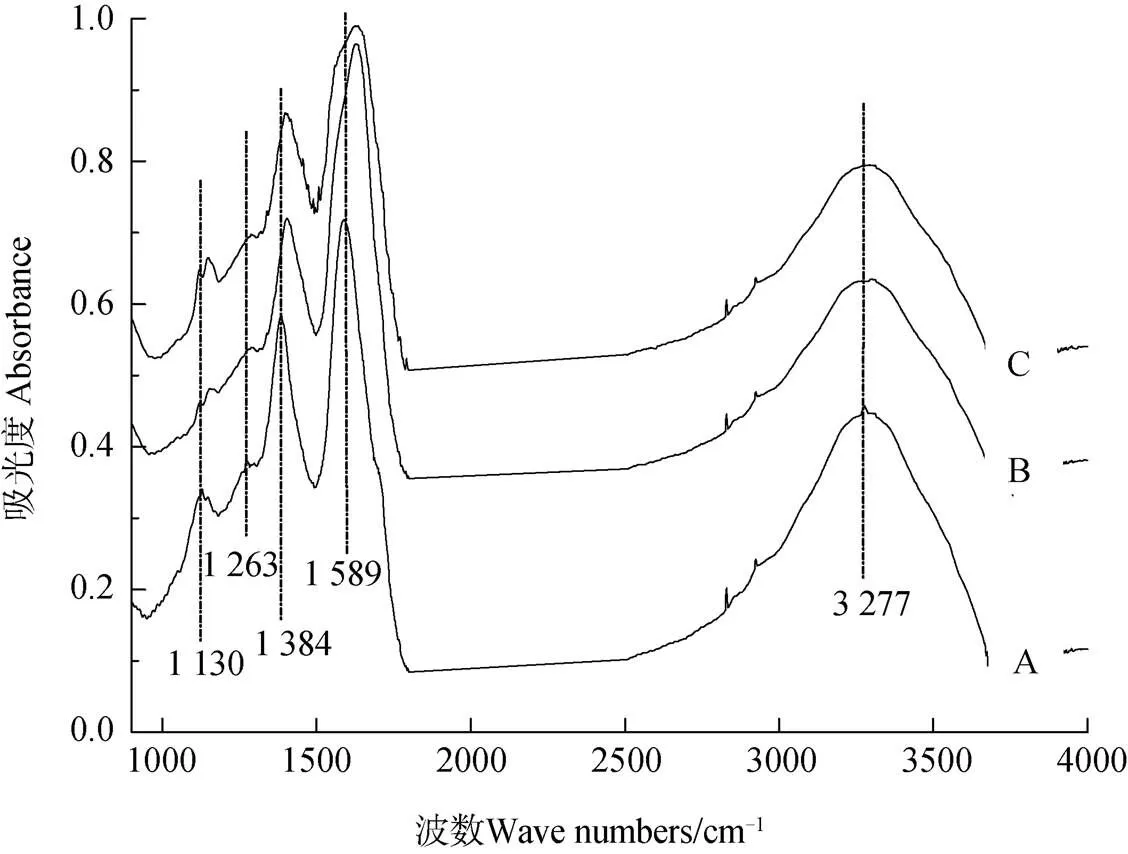
注:A代表单纯的胡敏酸;B、C分别为4 mmol·L–1Na+-Ca2+和4 mmol·L–1Ca2+作用下的胡敏酸凝聚体Note:A stands for pure humic acid;B and C stand for humic acid agglomerates in 4 mmol·L–1 Na+-Ca2+ and in 4 mmol·L–1 Ca2+,respectively
2.5 不同离子体系中胡敏酸凝聚体的官能团变化
为进一步探究胡敏酸凝聚体官能团的变化,将制备好的胡敏酸胶体悬液冷冻干燥后以红外光谱扫描,得到红外光谱图如图6所示:胡敏酸的–OH官能团的O—H伸缩振动出现在波数1 130和3 277 cm–1处,羧基–COOH官能团C—O伸缩振动位于波数1 263 cm–1处,羧基官能团的对称伸缩振动C—O和反对称的伸缩振动C—O(–COO–)分别出现在波数1 384和1 589 cm–1处。如C线(4 mmol·L–1Ca2+)所示,Ca2+加入之后,1 263、1 384、1 589和3 277 cm–1吸收峰强度明显降低,同时1 130 cm–1处吸收峰被1 120和1 288 cm–1所代替,1 384和1 589 cm–1吸收峰发生蓝移,这说明胡敏酸表面的羟基和羧基是与Ca2+发生作用的主要位点。Ca2+在羟基与羧基上的吸附及桥键作用使O-H和C-O键伸缩振动强度发生变化。对比B线(4 mmol·L–1Na+-Ca2+)和C线(4 mmol·L–1Ca2+),Ca2+和Na+-Ca2+凝聚体的谱图相似,说明Na+的加入并未引起Ca2+与胡敏酸表面作用位点的变化,仅是作用强度的变化引起了胡敏酸凝聚过程和凝聚体结构的差异。
红外光谱结果表明胡敏酸表面含有大量羧基(–COOH)、羟基(–OH)等官能团(图6)。官能团上的H发生电离致使它带有大量电荷,电荷在其周围产生强大的电场,影响到胶体周围反号离子与界面相互作用[26-27]。近期有报道[28-29]指出,不同电子层结构的离子由于受到强电场的诱导,会发生强烈的极化作用,此极化作用通过影响离子的界面行为而对胶体颗粒的凝聚和分散产生影响。研究发现,Ca2+与氧化铁的–OH表面官能团反应受到外电场的影响,形成可能由极化诱导的–OCa+共价键[30]。另有研究[31]表明,胡敏酸表面电位为–0.082 V,电场强度可达到7.3×108V·m–1,胡敏酸表面附近强电场界面上的Ca2+离子诱导,使其发生强烈的极化作用,从而更有利于靠近胡敏酸表面官能团而产生共价键和离子桥键。通过图6红外光谱图中盐基离子加入后C-O键振动峰的蓝移,推测正是由于阳离子在羧基间形成离子桥键和共价键的作用。根据Schulze-Hardy规则[32]:在带电胶体体系中,近似认为反号离子的聚沉能力与离子电荷数的六次方成正比,即一价Na+的聚沉能力为二价Ca2+的1/26=1/64。然而,本文结果表明:CCC(Na+)/CCC(Ca2+)≈1/134,此差异远远大于理论值。因此,Ca2+离子对胡敏酸的聚沉不仅单纯依赖于反号离子对表面双电层的压缩从而降低静电斥力,还有Ca2+在强电场中的极化诱导,使其与胡敏酸表面含氧官能团之间发生共价键和桥键的贡献。
3 结 论
Na+、Ca2+和Na+-Ca2+引发胡敏酸胶体的凝聚特征类似,均是在低浓度下胡敏酸凝聚体有效粒径随时间呈线性增长,高浓度下呈幂函数增长。胡敏酸胶体的凝聚对Ca2+的敏感性远大于Na+,因此Na+-Ca2+混合体系中Ca2+离子主导凝聚过程。Ca2+离子对胡敏酸的聚沉不仅依赖于静电作用,还与其在强电场中发生极化作用以及胡敏酸表面含氧官能团之间发生的共价键和桥键有关。Na+作为陪补离子,与Ca2+在胡敏酸胶体表面的竞争吸附抑制了Ca2+对胡敏酸的聚沉作用,且这种陪补离子效应对凝聚体的结构特征影响显著。对比Na+和Na+-Ca2+两种体系中胡敏酸凝聚体差异表明,可通过改变溶液中离子种类而调控所形成凝聚体的结构特征。
[ 1 ] Dou S. Soil organic matter[M]. Beijing:Science Press,2010. [窦森. 土壤有机质[M]. 北京:科学出版社,2010.]
[ 2 ] D'Orazio V,Senesi N. Spectroscopic properties of humic acids isolated from the rhizosphere and bulk soil compartments and fractionated by size-exclusion chromatography[J]. Soil Biology and Biochemistry,2009,41(9):1775—1781.
[ 3 ] Conte P,Piccolo A. High pressure size exclusion chromatography(HPSEC)of humic substances:Molecular sizes,analytical parameters,and column performance[J]. Chemosphere,1999,38(3):517—528.
[ 4 ] Tan L Q,Tan X L,Mei H Y,et al. Coagulation behavior of humic acid in aqueous solutions containing Cs+,Sr2+and Eu3+:DLS,EEM and MD simulations[J]. Environmental Pollution,2018,236:835—843.
[ 5 ] Liu X H,Zhang J W,Liu H J,et al. Study on complexation characteristics of soil HA with manganese ion and their biological availability[J]. Chinese Journal of Soil Science,2015,46(4):972—976. [刘小虎,张俊文,刘侯俊,等. 土壤胡敏酸与锰离子的络合特征及生物有效性研究[J]. 土壤通报,2015,46(4):972—976.]
[ 6 ] Wang H,Yi S,Fu Q L,et al. Phosphorus adsorption of iron oxides-humic acid compounds[J]. Plant Nutrition and Fertilizer Science,2012,18(5):1144—1152.[王慧,易珊,付庆灵,等. 铁氧化物-胡敏酸复合物对磷的吸附[J]. 植物营养与肥料学报,2012,18(5):1144—1152.]
[ 7 ] Huang Y F,Liu Z Z,Li Y L,et al. Effects of humic acids and minerals on adsorption-desorption of atrazine in soil[J]. Acta Pedologica Sinica,2016,53(1):155—165. [黄玉芬,刘忠珍,李衍亮,等. 土壤矿物和胡敏酸对阿特拉津的吸附-解吸作用研究[J]. 土壤学报,2016,53(1):155—165.]
[ 8 ] Niu P J,Wei S Y,Fang D,et al. Adsorption characteristics for humic acid by binary systems containing kaolinite and goethite[J]. Environmental Science,2016,37(6):2220—2228. [牛鹏举,魏世勇,方敦,等. 高岭石、针铁矿及其二元体对胡敏酸的吸附特性[J]. 环境科学,2016,37(6):2220—2228.]
[ 9 ] Li X H. Soil chemistry[M].. Beijing:Higher Education Press,2001. [李学垣. 土壤化学[M].北京:高等教育出版社,2001.]
[ 10 ] Gao X D,Li H,Zhu H L,et al. Aggregation of humic colloidal particles as affected by electrolyte and pH[J]. Acta Pedologica Sinica,2012,49(4):698—707. [高晓丹,李航,朱华玲,等. 特定pH条件下Ca2+/Cu2+引发胡敏酸胶体凝聚的比较研究[J]. 土壤学报,2012,49(4):698—707.]
[ 11 ] Cheng D,Liao P,Yuan S H. Effects of ionic strength and cationic type on humic acid facilitated transport of tetracycline in porous media[J]. Chemical Engineering Journal,2016,284:389—394.
[ 12 ] Iskrenova-Tchoukova E,Kalinichev A G,Kirkpatrick R J. Metal cation complexation with natural organic matter in aqueous solutions:Molecular dynamics simulations and potentials of mean force[J]. Langmuir,2010,26(20):15909—15919.
[ 13 ] Zhou W,Lin B. Advances in research on chemical behavior and bioavailability of calcium in soil[J]. Soils and Fertilizers,1996(5):19—22. [周卫,林葆. 土壤中钙的化学行为与生物有效性研究进展[J]. 土壤肥料,1996(5):19—22.]
[ 14 ] Jiang W,Yi Y L,Zhang D G. Effect of different concentration of complementary ions on calcium adsorbed by brown soil[J]. Southwest China Journal of Agricultural Sciences,2011,24(5):1828—1832. [姜维,依艳丽,张大庚. 不同浓度陪补离子对棕壤钙吸附的影响[J]. 西南农业学报,2011,24(5):1828—1832.]
[ 15 ] Lu J,Zhu K,Hou B,et al. General situation of the reaction mechanisms of humic substances with heavy metal ions in soil[J]. Humic Acid,2006(5):1—5. [卢静,朱琨,侯彬,等. 腐植酸与土壤中重金属离子的作用机理研究概况[J]. 腐植酸,2006(5):1—5.]
[ 16 ] Jia M Y,Zhu H L,Li H. Application of light scattering technology in study on interactions between soil colloidal particles in suspension[J]. Acta Pedologica Sinica,2010,47(2):253—261.[贾明云,朱华铃,李航. 光散射技术在土壤胶体颗粒相互作用研究中的应用[J]. 土壤学报,2010,47(2):253—261.]
[ 17 ] Tian R,Li H,Zhu H L,et al. Ca2+and Cu2+induced aggregation of variably charged soil particles:A comparative study[J]. Soil Science Society of America Journal,2013,77(3):774—781.
[ 18 ] Jia M Y,Li H,Zhu H L,et al. An approach for the critical coagulation concentration estimation of polydisperse colloidal suspensions of soil and humus[J]. Journal of Soils and Sediments,2013,13(2):325—335.
[ 19 ] Tian R,Yang G,Li H,et al. Activation energies of colloidal particle aggregation:Towards a quantitative characterization of specific ion effects[J]. Physical Chemistry Chemical Physics,2014,16(19):8828—8836.
[ 20 ] Hui D,Nawaz M,Morris D P,et al. Study of pH-triggered heteroaggregation and gel formation within mixed dispersions[J]. Journal of Colloid and Interface Science,2008,324(1/2):110—117.
[ 21 ] Tang Y,Li H,Zhu H L,et al. Impact of electric field on Hofmeister effects in aggregation of negatively charged colloidal minerals[J]. Journal of Chemical Sciences,2016,128(1):141—151.
[ 22 ] Hou T,Xu R K. Progresses on interactions between electric double layers on colloid surface[J]. Soils,2008,40(3):377—381. [侯涛,徐仁扣. 胶体颗粒表面双电层之间的相互作用研究进展[J]. 土壤,2008,40(3):377—381.]
[ 23 ] Cheng C. The structure of electrical double layers of soil colloidal particles and its influening factors[D]. Nanjing:Nanjing Agricultural University,2009. [程程. 土壤胶体的双电层结构及其影响因素[D]. 南京:南京农业大学,2009.]
[ 24 ] Jiang J,Xu R K. Effects of ionic strengths on surface charge and ζ potential of three variable charge soils[J]. Soils,2015,47(2):422—426. [姜军,徐仁扣. 离子强度对三种可变电荷土壤表面电荷和Zeta电位的影响[J]. 土壤,2015,47(2):422—426.]
[ 25 ] Fu Q. Humic acid / montmorillonite colloid aggregation kinetics hofmeister effects:The role of non-electrostatic mechanism[D]. Chongqing:Southwest University,2016. [傅强. 胡敏酸/蒙脱石胶体凝聚动力学的Hofmeister效应:非静电作用机制初探[D]. 重庆:西南大学,2016.]
[ 26 ] Gao X D,Xu Y D,Zhang G C,et al. Effects of Cu2+and Zn2+polarization by electric fields on the colloid aggregation of black soil[J]. Journal of Agro-Environment Science,2018,37(3):440—447. [高晓丹,徐英德,张广才,等. Cu2+和Zn2+在土壤电场中的极化对黑土胶体凝聚的影响[J]. 农业环境科学学报,2018,37(3):440—447.]
[ 27 ] Huang X R,Li H,Li S,et al. Role of cationic polarization in humus-increased soil aggregate stability[J]. European Journal of Soil Science,2016,67(3):341—350.
[ 28 ] Gao X D,Li H,Tian R,et al. Quantitative characterization of specific Ion effects using an effective charge number based on the gouy-chapman model[J]. Acta Physico-Chimica Sinica,2014,30(12):2272—2282. [高晓丹,李航,田锐,等. 利用基于Gouy-Chapman模型的离子有效电荷定量表征离子特异性效应[J]. 物理化学学报,2014,30(12):2272—2282.]
[ 29 ] Liu H Y,Liu X M,Tian R,et al. Specific ion effect of aggregating montmorillonite nanoparticles[J]. Acta Pedologica Sinica,2018,55(3):673—682. [刘汉燚,刘新敏,田锐,等. 蒙脱石纳米颗粒聚集中的离子特异性效应[J]. 土壤学报,2018,55(3):673—682.]
[ 30 ] Zhu L H,Li Z Y,Tian R,et al. Specific ion effects of divalent cations on the aggregation of positively charged goethite nanoparticles in aqueous suspension[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2019,565:78—85.
[ 31 ] Tian R,Liu Y L,Li H,et al. A light scattering study on Zn2+-adsorption induced humic molecule aggregation[J]. Journal of Southwest University(Natural Science Edition),2010,32(11):118—123. [田锐,刘艳丽,李航,等. Zn2+吸附引发腐殖质分子凝聚的激光散射研究[J]. 西南大学学报(自然科学版),2010,32(11):118—123.]
[ 32 ] Verrall K E,Warwick P,Fairhurst A J. Application of the Schulze–Hardy rule to haematite and haematite/humate colloid stability[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,1999,150(1/2/3):261—273.
Effects of Na+,Ca2+and Na+-Ca2+Mixture on the Stability of Humic Acid Colloids
LI Shaobo, XU Yingde, ZHANG Yun, ZHANG Guangcai, ZUO Yan, WANG Jingkuan, GAO Xiaodan†
(College of Land and Environment,Shenyang Agricultural University/Northeast Key Laboratory of Arable Land Conservation and Improvement,Ministry of Agriculture,Shenyang 110866,China)
In this study on humic acid in soil,the technique of light scattering was adopted to compare effects of three different electrolytes common in soil,i.e. Na+,Ca2+and Na+-Ca2+mixture,on agglomeration kinetics of humic acid colloids relative to concentration of the electrolyte and elucidate effects of interface behaviors of ions different in valence and complementary ions on humic acid dispersion stability and agglomerate structure.The technique of dynamic light scattering was used to monitor effective hydrodynamic diameters of humic acid agglomerates,which were found increasing with time in all the three electrolytes,regardless of concentration. Based on the time-dependent changes in agglomerate diameter,total mean agglomeration rate,critical agglomeration concentration and activation energy were calcuated,and agglomeration mechanism analyzed. Fractal dimension of humic acid agglomerates 60 d after agglomaeration was determined.Resuls show: (1) agglomeration of humic acid colloids was quite similar in all the electrolytes: effective hydrodynamic diameter of humic acid agglomerates linearly increased with time in electrolytes low in concentrations and followed a power law in those high in concentration. The effects of Na+and Ca2+on agglomeration of humic acid colloids in the experiment were much higher than those of the ions different in valence as is described in the Schulze-Hardy law; (2) in the electrolyte of Na+-Ca2+mixture,Ca2+ions dominated agglomeration process,and agglomeration process in the electrolyte of Ca2+differed from that in the electrolyte of Na+-Ca2+and the sharper the lower the concentration; (3) in the electrolyte of Na+-Ca2+mixture,Na+,as complementary ion in the electrolyte of Na+-Ca2+mixture,had certain complementary effects on critical coagulation concentration,inter-particle activation energy and agglomerate structure,especially the last; and (4) the humic acid agglomerates in the electrolyte of Na+-Ca2+mixture was quite compact in structure,varying between those in the electrolytes of Na+and Ca2+. It is,therefore,feasible to control compactness of the agglomerates in structure in the electrolyte by adjusting ion composition of the electrolyte.The agglomeration of humic acid colloids induced by Ca2+depends not only on compression of the surface electric double layer on the counter ions,which reduces electrostatic repulsion and causes agglomeration,but also on polarization of Ca2+in the strong electric field that induces and contributes to formation of covalent and bridge bonds between Ca2+and oxygen-containing functional groups on the surface of humic acid. In addition,the competitive adsorptions of Na+and Ca2+on the surface of humic acid inhibits agglomeration of Ca2+,thus forming agglomerate moderate in compactness. All these findings may provide some new ideas and theories for exploring colloidal interface reaction and mechanism for agglomeration of soil colloids.
Humic acid colloid; Salt-based ion; Light scattering; Colloidal stability; Complementary ion
S153.3
A
10.11766/trxb201906050252
李少博,徐英德,张昀,张广才,左研,汪景宽,高晓丹. Na+、Ca2+及Na+-Ca2+混合离子对胡敏酸胶体稳定性的影响[J]. 土壤学报,2020,57(5):1240–1248.
LI Shaobo,XU Yingde,ZHANG Yun,ZHANG Guangcai,ZUO Yan,WANG Jingkuan,GAO Xiaodan. Effects of Na+,Ca2+and Na+-Ca2+Mixture on the Stability of Humic Acid Colloids [J]. Acta Pedologica Sinica,2020,57(5):1240–1248.
* 中国博士后科学基金项目(2017M611265)、国家自然科学基金项目(41601230)和公益性行业(农业)科研专项基金项目(201503118-10)资助Supported by the Postdoctoral Science Foundation of China(No. 2017M611265),the the National Natural Science Foundation of China(No. 41601230)and the Special Scientific Research Fund for Agricultural Public Welfare Profession of China(No. 201503118-10)
,E-mail:wataxi221@126.com
李少博(1993—),男,河北张家口人,硕士研究生,研究方向:土壤胶体与界面化学。E-mail:bobshaoli@163.com
2019–06–05;
2019–10–11;
优先数字出版日期(www.cnki.net):2020–01–07
(责任编辑:陈荣府)

