膜萃取电喷雾电离质谱快速分析菌血血样的研究
王 姜 黄丽娟 徐贞俊 刘 昱 徐静娟* 陈洪渊
1(南京大学生命分析化学国家重点实验室,南京大学化学化工学院, 南京 210023) 2(南京大学医学院附属鼓楼医院心胸外科, 南京 210008)
1 引 言
血流感染(Bloodstream infection, BSI),如菌血症、败血症等,是一类可对人体健康构成严重威胁的疾病,严重者可引起全身炎症反应综合征,甚至死亡[1,2]。新生儿、手术后的病人、癌症患者、艾滋病病毒(Human immunodeficiency virus, HIV)感染者及抵抗力低下的外伤人员等,都是该类疾病的易感人群[1,3~8]。由金黄色葡萄球菌引起的菌血症, 30天全因病死率可达20%,如救治不及时,死亡率可高于80%[9,10]。我国BSI平均死亡率高达27.8%,由烧伤、血液病、恶性肿瘤诱发BSI病死率更高[11,12]。准确快速检测BSI患者所感染细菌种类,为临床诊断提供参考,对降低死亡率至关重要[13,14]。血流感染的诊断金标准为血液培养法[15,16],但对血液样本培养诊断时间为2~5天,并存在假阴性等问题[17,18],其它辅助检测手段(如血清降钙素原检测)也无法快速、有效地确认细菌种类[17,19]。
为了提高细菌的检测效率和准确性,研究者开发了多种有效检测方法,如酶联免疫法[20]、协同凝集法[21]、微流控芯片筛分法[22~24]、毛细管电泳法[25,26]等。以上方法在一定程度上缩短了检测时间,但仍然存在假阴性,或者难于满足多种细菌高灵敏度检测的需求。质谱具有灵敏度高、检测速度快等优点,已广泛应用于化学、生物、医学检测等领域。在菌血症的检测中,Chingin等[14]通过质谱检测血液培养过程中细菌产生的挥发性物质,对不同细菌进行区分,获得了良好的结果。但该方法需要对血液样品培养16 h左右,对BSI患者而言,培养时间仍然较长。因此,发展一种可在更短时间内对临床样本进行快速处理和检测、准确判断患者所感染细菌种类的检测方法,为患者赢得宝贵治疗时间十分必要。
膜萃取电喷雾质谱(Membrane extraction electrospray ionization mass spectrometry, MEESI-MS)法是通过聚四氟乙烯微孔膜将样品与萃取剂分隔,待测物质通过微孔膜被萃取剂萃取并发生电离的一种在线萃取电离质谱分析方法。根据待测分子的物化性质可以调整和优化萃取剂,以获得较好的检测效果。利用此方法已实现了牛奶中手性药物的直接质谱检测[27]。本研究以临床BSI患者血样分离病原菌占比位列前四位的大肠杆菌(27.7%)、金黄色葡萄球菌(10.3%)、肺炎克雷伯菌(10.2%)、铜绿假单胞菌(7.1%)为研究对象[28,29],利用膜萃取具有的抗复杂基体干扰的能力,结合血液培养,建立了一种对菌血血液样品进行快速分析的MEESI-MS方法。从血液培养、质谱检测到细菌分类分析,整个过程仅需65 min,为临床诊断提供了一种快速分析方法。
2 实验部分
2.1 仪器与试剂
6530Q-TOF质谱仪(安捷伦科技有限公司,分析软件为仪器自带Qualitative Analysis B.06.00); VD-850桌上型净化工作台(上海尚道仪器制造有限公司); THZ-100B恒温培养摇床(上海一恒科学仪器有限公司); VARI FLASH酶标仪(美国Thermo Scientific公司); Pump 11 Elite注射泵(Harvard Apparatus公司); 0.45 μm聚四氟乙烯膜(迈博瑞生物膜技术有限公司)。乙酸(>99%,南京化学试剂股份有限公司); 甲醇(>99.9%,百灵威科技有限公司); 营养琼脂(国药集团化学试剂有限公司); LB肉汤(广东环凯微生物科技有限公司)。肺炎克雷伯氏菌菌株、大肠杆菌菌株、铜绿假单胞菌菌株、金黄色葡萄球菌菌株(上海鲁微科技有限公司); 人血样品由南京大学医学院附属鼓楼医院心胸外科提供(血液提供人员已知情并同意)。实验用水为二次蒸馏水。
2.2 膜萃取电喷雾电离装置
采用自制的膜萃取电喷雾电离装置。如图1A中的装置示意图所示,装置由两个金属三通、一个自制的双向连接器和聚四氟乙烯(PTFE)微孔膜组成。装置中间为PTFE微孔膜,左侧红色管道是样品引入通道,管道出口距离微孔膜1 mm; 蓝色通道为萃取剂通道,萃取剂通道通过金属三通与电喷雾毛细管相连; 电喷雾毛细管左侧距离微孔膜1 mm。样品由红色通道进入,待测物通过微孔膜,被萃取剂萃取后进入电喷雾毛细管,并在高压电场作用下发生电离。完成萃取后的样品废液由左侧三通的废液出口排出。实验中,样品流速控制在3 μL/min,萃取剂流速4 μL/min。
2.3 样品处理
固态培养基:称取营养琼脂33.0 g,加1000 mL水,将其煮沸至营养琼脂完全溶解,120℃高压灭菌30 min后,制备成琼脂平板,备用。
液态培养基:称取LB肉汤21.0 g,加1000 mL水, 120℃高压灭菌30 min后,备用。
细菌预培养:在净化工作台中分别将肺炎克雷伯氏菌菌株、大肠杆菌菌株、铜绿假单胞菌菌株、金黄色葡萄球菌菌株接种到琼脂平板上培养12 h,再挑取单独菌落,置于液体培养基中培养16 h,获得细菌母液。用生理盐水稀释细菌母液,制成102CFU/mL的接种菌液,备用。
血液样品分组:将血样分为5组,第一组血液不添加细菌; 第二组血液添加金黄色葡萄球菌; 第三组血液添加大肠杆菌; 第四组血液添加铜绿假单胞菌; 第五组血液添加肺炎克雷伯氏菌。处理方法如下:取100 μL接种菌液加入1 mL无菌的人血样本中,制成10 CFU/mL的菌血样品,然后向菌血样品中加入4 mL液态培养基,混匀,在培养摇床中37℃培养1 h。每组菌血样本设置2个盲样,共8个盲样,在盲样中抽取3个样品(编号1、2、3)进行主成分分析(Principal component analysis, PCA),分析后揭盲,验证PCA方法的准确性。
2.4 数据的采集与处理
质谱仪采用正、负离子两种检测模式,离子源电压为4.3 kV(正离子模式)和3.5 kV(负离子模式)。离子源电喷雾口至质谱入口毛细管的距离为6.0 mm。质谱离子源反吹氮气流速为1.5 L/min,检测扫描范围为m/z50~3200,离子传输管温度为220℃。串联质谱设置隔离质量宽度为±4 Da,碰撞能量为10 eV。
将质谱数据(正离子模式下,无菌血液样本及每种细菌样本各10个; 负离子模式下,无菌血液样本及每种细菌样本各10个)导出,利用Matlab(2018版,美国Mathworks公司)软件进行PCA。
3 结果与讨论
3.1 MEESI-MS方法验证
经过培养的血液样品由图1A中红色管道进入MEESI装置,血样中待测物质被膜右侧的萃取剂(乙腈-水(1∶1,V/V),含0.1% 乙酸)萃取并电离,得到图1B中的质谱图(正离子模式),其中m/z757 (+20)、m/z797 (+19)、m/z841 (+18)是血红蛋白β链质谱信号。这些信号表明,血液中的血红蛋白可穿过微孔膜,被萃取剂萃取后进入电喷雾管道,并发生电离而被质谱检测到。此结果说明,利用本装置,在优化的实验条件下可获取血样中的物质信息。
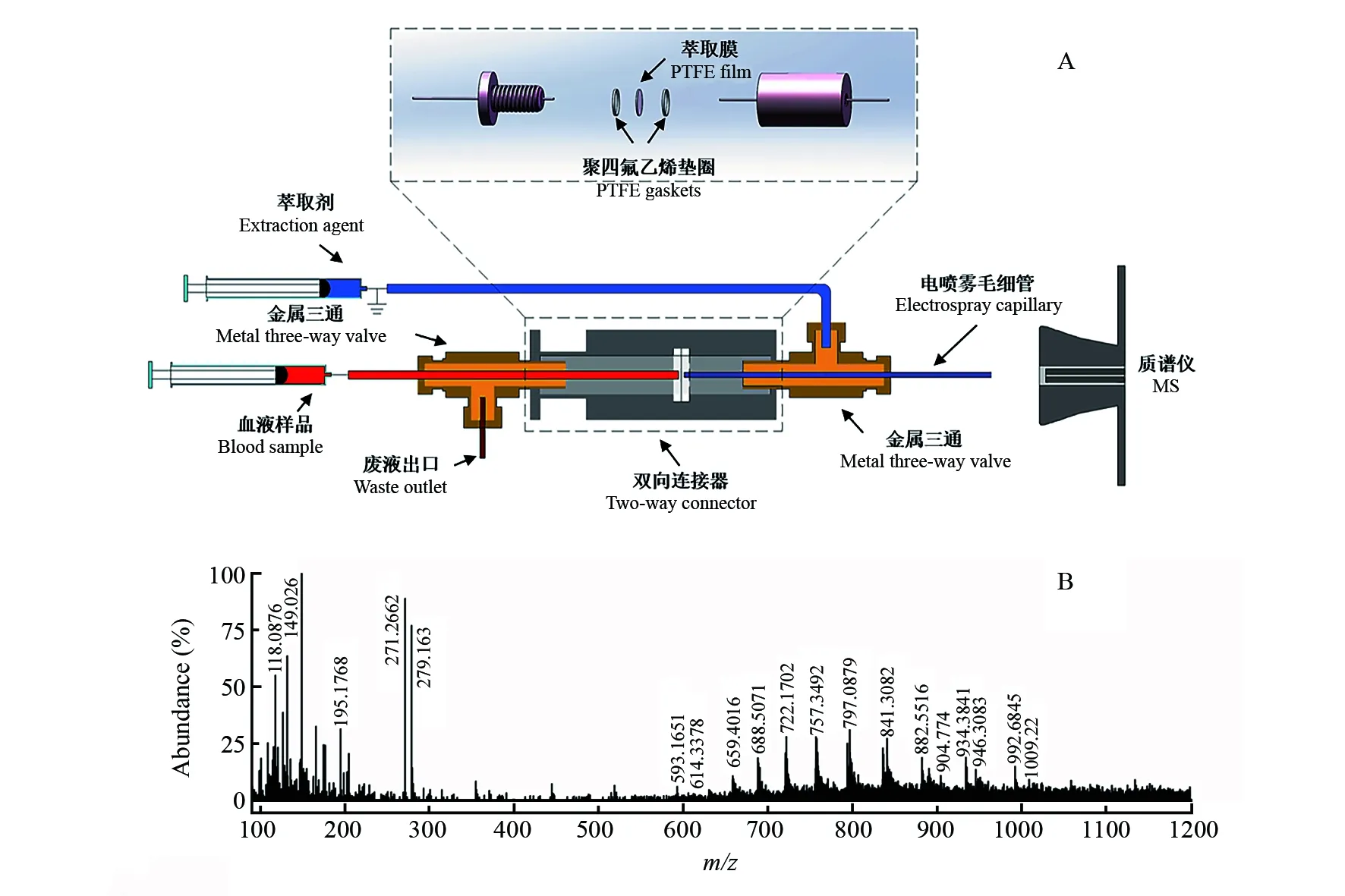
图1 (A) 膜萃取电喷雾电离质谱(MEESI-MS)装置示意图; (B) 培养1 h的无菌血样的MEESI-MS图Fig.1 (A) Schematic diagram of membrane extraction electrospray ionization mass spectrometry (MEESI-MS) device; (B)MEESI-MS spectrum of normal blood samples cultured for 1 h
根据文献[14]报道,在菌血症致病菌的挥发性代谢产物的检测过程中,只在金黄色葡萄球菌中发现异戊酸(Isovaleric acid)。 通过HMDB(Human metabolome database, www.hmdb.ca)数据库进行精确质量查找,确定在负离子模式下m/z101为异戊酸。在负离子模式下,对比培养时间为1、6和24 h的金黄色葡萄球菌血样(图2B、2D和2F)和正常血样(图2A、2C和2E)的指纹谱图,发现金黄色葡萄球菌血样中存在异戊酸,且异戊酸信号强度与样品的培养时间呈正相关。在正常血样的指纹谱图中未发现异戊酸,与文献[14]的结果相符。
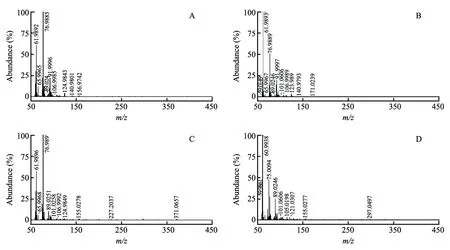

图2 在负离子模式下血样的MEESI质谱图:无菌血样培养1 h(A)、6 h(C)和24 h(E); 金黄色葡萄球菌血样培养1 h(B)、6 h(D)和24 h(F) Fig.2 MEESI-MS spectra of blood samples under negative ion mode: sterile blood samples cultured for 1 h (A), 6 h (C) and 24 h (E); Staphylococcus aureus blood samples cultured for 1 h (B), 6 h (D) and 24 h (F)
为了进一步确认异戊酸,选择m/z101分子离子峰进行二级质谱分析(图3)。在培养1、6和24 h(图3B、3D、3F)金黄色葡萄球菌血样的二级质谱中均获得了主要碎片信息m/z83的信号和m/z73、57的碎片信号,碎片信息与文献[14]报道的异戊酸的二级质谱碎片信息相符,并且碎片信号强度也随培养时间的延长而增强; 在培养1和6 h的正常血样中未获得异戊酸相关碎片信号(图3A和3C),培养24 h的正常血样中可获得m/z83的碎片信号,但没有m/z57和73的相关碎片信号(图3E),说明样品中不含有异戊酸。以上结果表明,MEESI-MS获得的血液培养液中的信息可用于相关菌血样品的分析。
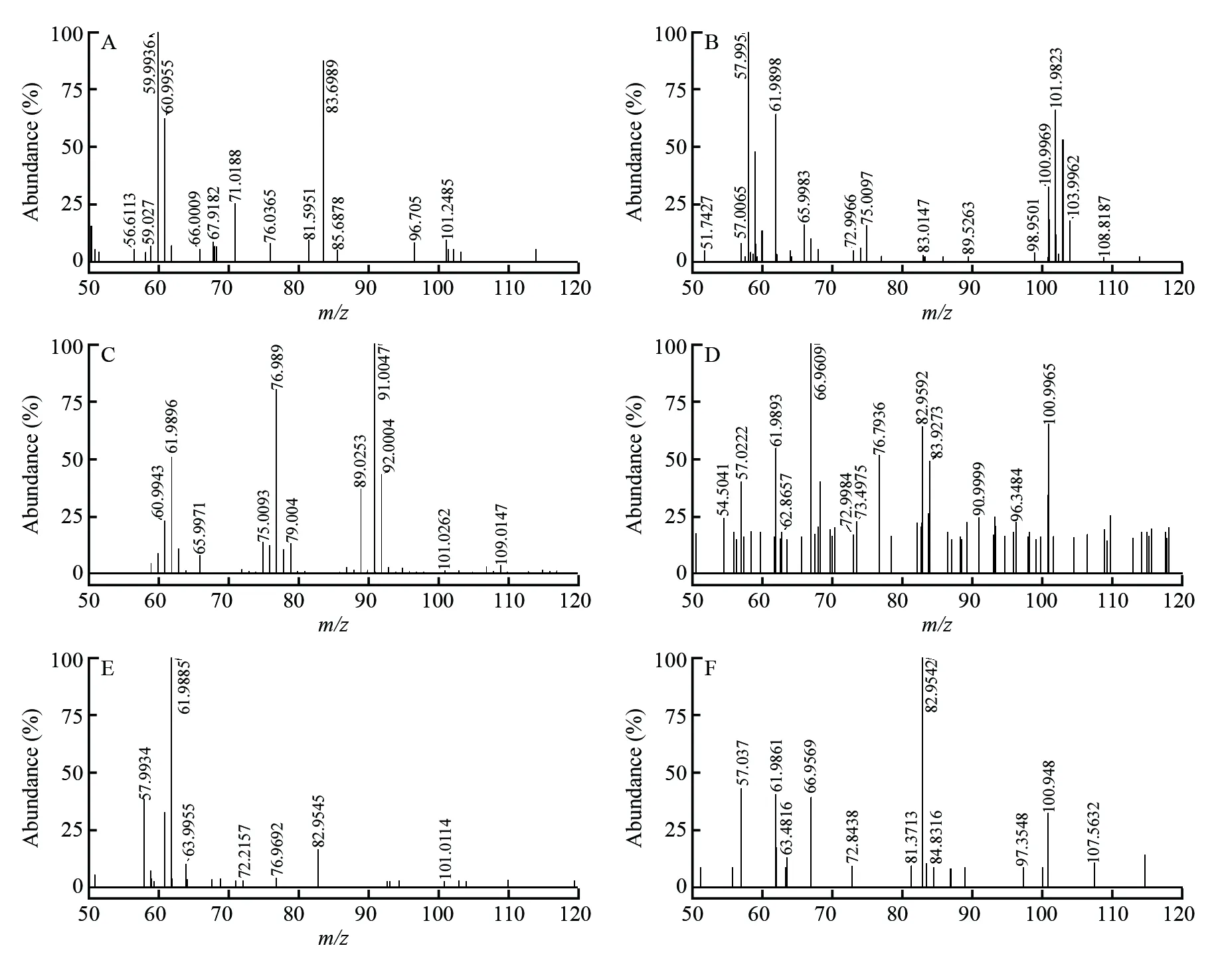
图3 在负离子模式下血样中m/z 101的二级质谱图:无菌血样培养1 h(A)、6 h(C)和24 h(E); 金黄色葡萄球菌血样培养1 h(B)、6 h(D)和24 h(F) Fig.3 Tandem mass spectra of blood samples (m/z 101) under negative ion mode: sterile blood samples cultured for 1 h (A), 6 h (C) and 24 h (E); Staphylococcus aureus blood samples cultured for 1 h (B), 6 h (D) and 24 h (F)
3.2 4种细菌血液培养液MEESI-MS的指纹谱图
利用PCA方法对细菌进行分析的关键是获取不同细菌的特征代谢产物信息。本实验对4种细菌血液培养液的MEESI-MS指纹谱图进行了对比分析。由于样品成分复杂,很多物质信号较弱,无法通过串联质谱进行分析。本研究将精确质量与HMDB数据库中数据进行比对,获得了部分与细菌代谢物质相关的物质信息(表1)。
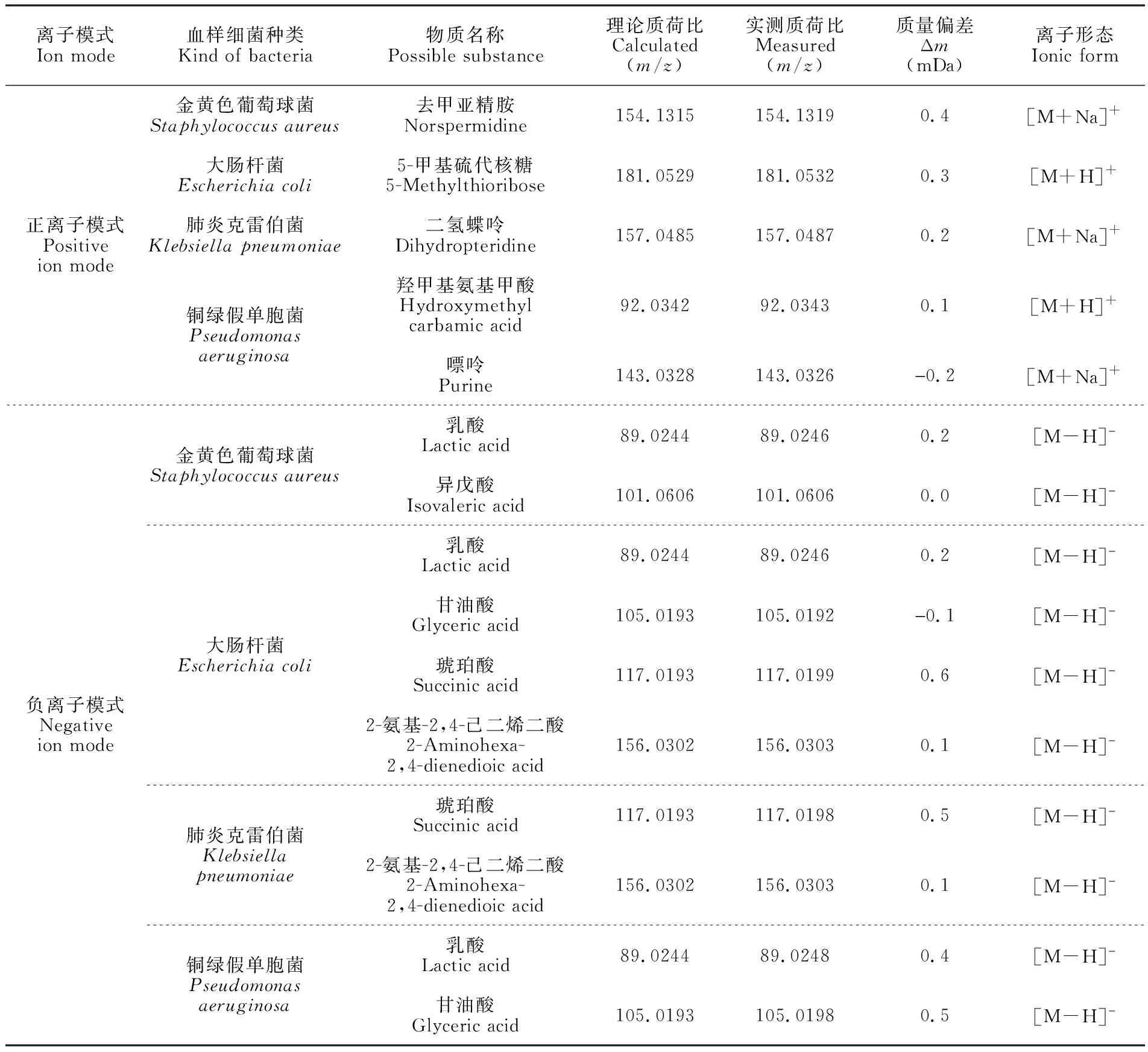
表1 不同细菌血样的典型代谢产物
在正离子模式下,在金黄色葡萄球菌血样质谱数据(图4B)中出现m/z154,为去甲亚精胺(Norspermidine)的[M+Na]+信号; 在大肠杆菌血样质谱图(图4C)中出现m/z181,为5-甲基硫代核糖(5-Methylthioribose)的[M+H]+信号,此物质是细菌在进行蛋氨酸或半胱氨酸S回收反应过程的中间产物,可在大肠杆菌代谢物中出现[30]; 在肺炎克雷伯菌血样质谱图(图4D)中发现m/z157,为二氢蝶呤(Dihydropteridine)的[M+Na]+信号,此物质为二氢蝶呤还原酶底物,参与生物体合成四氢蝶呤[31,32]; 在铜绿假单胞菌血样质谱图(图4E)中发现m/z92和143,分别是羟甲基氨基甲酸((Hydroxymethyl) carbamic acid)的[M+H]+信号和嘌呤(Purine)的[M+Na]+信号,其中,嘌呤浓度与人体细菌感染有一定的正相关性[33],嘌呤也是铜绿假单胞菌的主要氮源[34]。
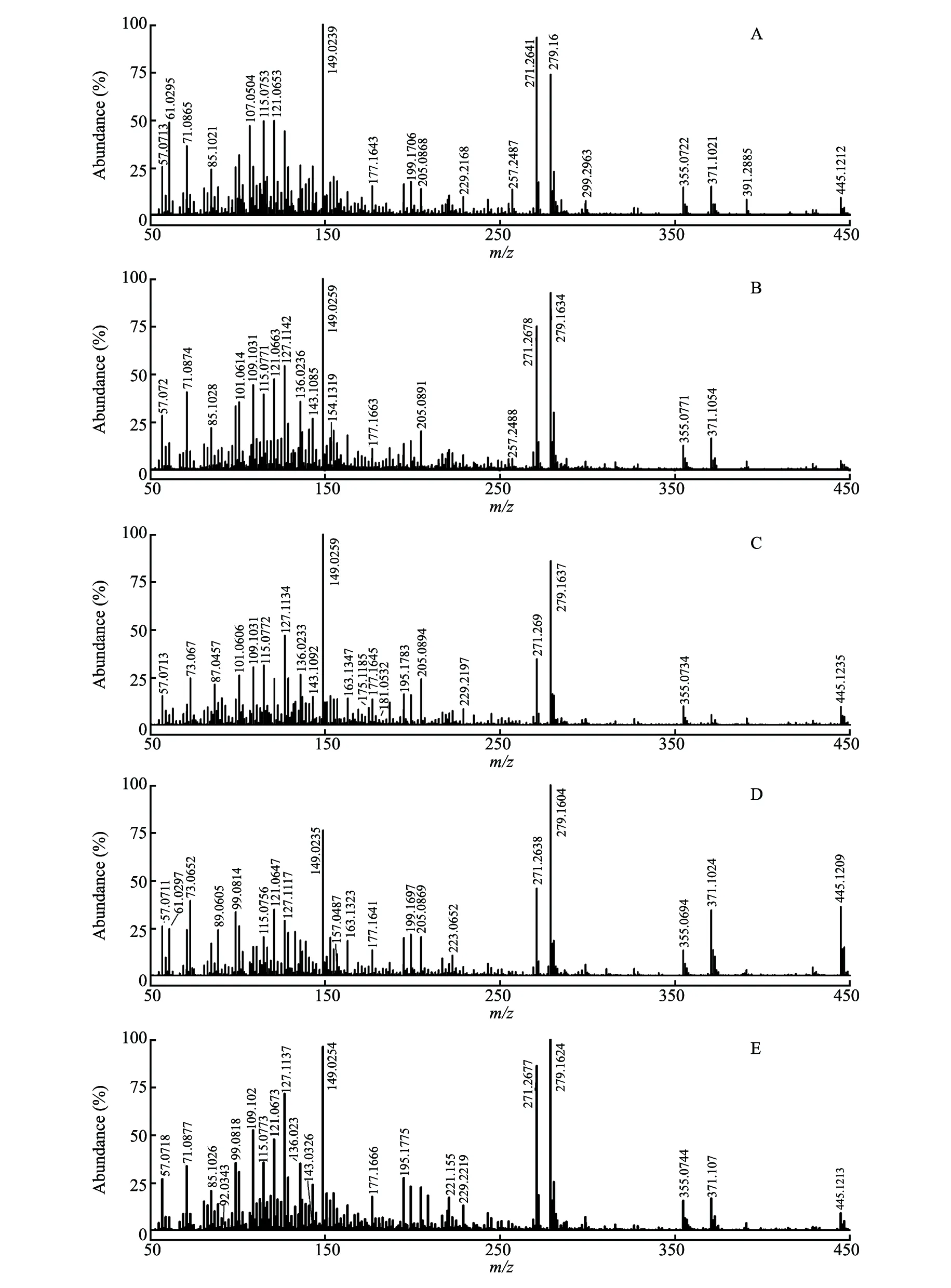
图4 在正离子模式下培养1 h的血样的质谱图:(A)无菌血样; (B)金黄色葡萄球菌血样; (C)大肠杆菌血样; (D)肺炎克雷伯菌血样; (E)铜绿假单胞菌血样Fig.4 Mass spectra of blood samples cultured for 1 h under positive ion mode: (A) Sterile blood sample; (B) Staphylococcus aureus blood sample; (C) Escherichia coli blood sample; (D) Klebsiella pneumoniae blood sample; (E) Pseudomonas aeruginosa blood sample
在负离子模式下,在金黄色葡萄球菌血样质谱图(图2B)中发现m/z89,为乳酸(Lactic acid)的[M-H]-信号, 此物质存在于多种细菌培养代谢产物中[35];m/z101为异戊酸的[M-H]-信号,此物质曾在菌血症患者血样中被检出[14]。大肠杆菌血样质谱图(图5A)中,m/z89为乳酸;m/z105为甘油酸(Glyceric acid)的[M-H]-信号,此物质与微生物代谢有关,是细菌将甘油转化为二羟基丙酮的中间产物[36];m/z117为琥珀酸(Succinic acid)的[M-H]-信号,琥珀酸是多种革兰氏阴性细菌都可产生的一种代谢产物[35];m/z156为2-氨基-2,4-己二烯二酸(2-Aminohexa-2,4-dienedioic acid)的[M-H]-信号。肺炎克雷伯菌血样质谱图(图5B)中,m/z117对应琥珀酸;m/z156峰为2-氨基-2,4-己二烯二酸。在铜绿假单胞菌血样质谱图(图5C)中,m/z89为乳酸,m/z105为甘油酸。
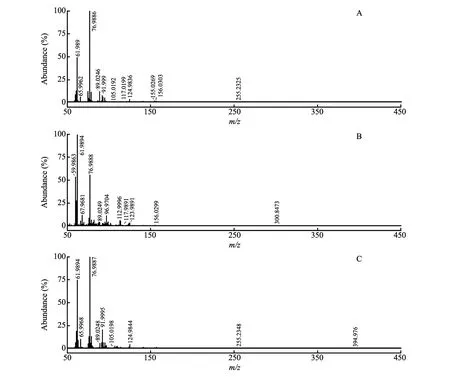
图5 在负离子模式下培养1 h的血样的质谱图:(A)大肠杆菌血样; (B)肺炎克雷伯菌血样; (C)铜绿假单胞菌血样Fig.5 Mass spectra of blood samples cultured for 1 h under negative ion mode: (A) Escherichia coli blood sample; (B) Klebsiella pneumoniae blood sample; (C) Pseudomonas aeruginosa blood sample
在负离子模式下,发现检测到的物质多为有机酸,这可能是由于酸性物质在负离子模式下更容易电离。在负离子检测结果中,每种细菌之间的代谢产物种类有较多的重叠,从质谱图中也可看出,负离子模式下,不同细菌的质谱信号差异相对较小,信息量少于正离子模式。因此,本研究采用正离子模式下的数据进行PCA分析。
3.3 主成分分析
将MEESI-MS的正离子模式数据导入Matlab软件中进行PCA分析(图6A),无菌血样(Normal)、金黄色葡萄球菌血样(SA)、大肠杆菌血样(EC)、肺炎克雷伯菌血样(KP)、铜绿假单胞菌血样(PA)获得了较为明显的区分, 主成分PC1、PC2和PC3的贡献率分别为72.8%、9.4%和3.5%,说明PC1对区分菌血样品起主要作用。由图6A可见,大肠杆菌样品与其它样品分离明显,这可能是大肠杆菌活跃度相对其它3种细菌较高,差异更大,而另外3种细菌由于培养时间仅为1 h,不同种类细菌样品间分离度有限。但从图6A中可以清晰地区分不同细菌的区域,其中PA样品中有1个样品点与SA样品的1个样品点非常接近,整体50个样品点中出现2个样品点区分不明显,占总样品数的4%, 其它样品点区分良好,区分正确率大于90%,可实现细菌种类初步鉴定。在盲样(Sample)分析中,1号样品为铜绿假单胞菌血样,2号样品为大肠杆菌血样,3号样品为金黄色葡萄球菌血样,以上3个样本通过本方法分析均获得了准确区分。
在PCA分析的载荷图(图6B)中,差异最大的物质为m/z101、102、116、127、143和175等。将以上物质与上述检出物质进行匹配,发现在PC1和PC3的载荷因子为负值的m/z143与铜绿假单胞菌样品检出的嘌呤相符。同时,铜绿假单胞菌样品分布在PC1和PC3负轴,在PC2中分布在正轴一侧(图6A),这也佐证了m/z143为嘌呤。由于生物样品物质复杂,通过相关数据库搜索和文献查找,其它差异较大的谱峰的物质信息难以确认,但对本研究中细菌种类的区分不会造成影响。
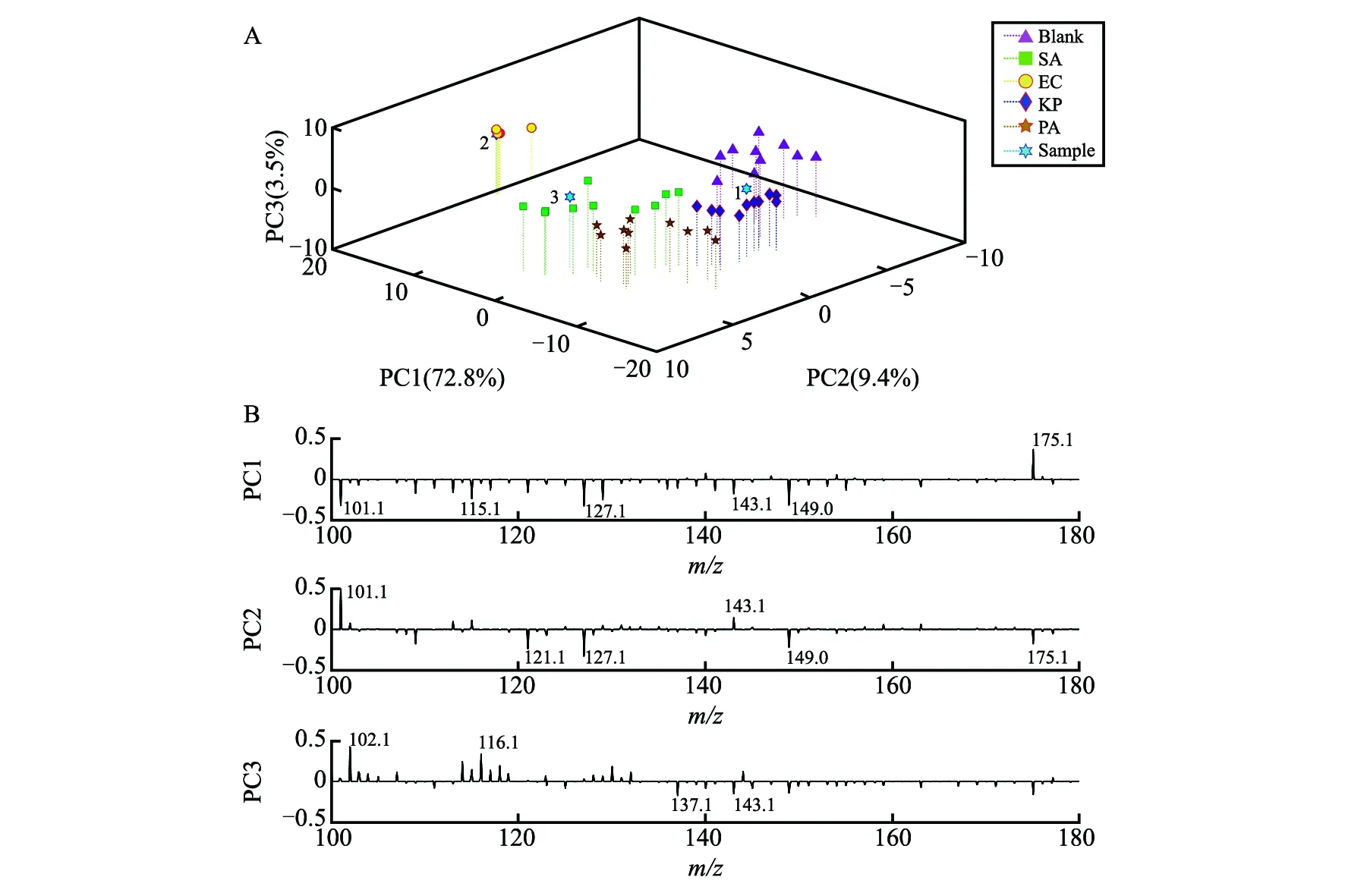
图6 正常血样及四种菌血样品正离子模式下质谱数据的三主成分分析散点图(每种样品十个样品点)(A)和载荷图(B)Fig.6 Principal component analysis (PCA) results of MEESI-MS data under positive ion mode originating from normal blood samples and four kinds of bacterial blood samples: (A) Scatter plot of PCA with ten sample points for each sample; (B) PC1, PC2 and PC3 loading results
3.4 分析速度和稳定性
本研究中,菌血样品培养时间约60 min,整体分析时间少于65 min,因此,可满足对批量样品进行快速分析的需求。本研究还对分析方法的稳定性进行了考察,实验中单个样品重复进样6次,经计算,在正、负离子模式下检测到的物质信号的相对标准偏差(RSD)分别为16.3%和7.7%。说明本研究所采用的方法能够在短时间血液培养后,快速鉴别4种细菌血样,检测效果良好。
4 结 论
利用MEESI-MS技术结合血液培养对4种细菌血样进行快速分析,得到对应的指纹图谱,并对其中常见的化学成分(异戊酸等)进行串联质谱鉴定。将MEESI-MS与PCA方法相结合,可在1 h左右直接对4种细菌血样进行快速区分,区分正确率大于90%。本方法所需血样中细菌起始浓度与临床疾病血样样本浓度[15]相当,具有分析速度快、方法简单等特点。虽然不能实现边界分明的区分效果,但已可以明确地进行细菌种类初步判断,为临床治疗提供信息支撑,争取宝贵的治疗时间。本研究使用的样品不是实际病例样品,相较于实际病例样品,细菌与血液接触时间更短,区分难度更大。因此,通过PCA算法的改进及大量实际样本的机器学习,本方法可望为临床血液感染类疾病的快速检测提供一种新手段。

