小分子化合物诱导骨髓间充质干细胞类神经分化的实验研究*
李光然,邱裕佳,段思腾,马义勇,李宇,王伟
(1.锦州医科大学附属第一医院,辽宁 锦州 121001;2.辽宁中医药大学研究生院,辽宁 沈阳 110016;3.锦州医科大学骨外科学研究所,辽宁 锦州 121001)
神经系统疾病是发生于中枢神经系统、周围神经系统、自主神经系统的,以感觉、运动、意识、自主神经功能障碍为主要表现的疾病,是对人类生命危害很大的疾病之一[1]。随着再生医学的发展,诱导干细胞神经分化的细胞替代疗法已成为治疗神经系统疾病的新途径[2]。诱导方法和细胞来源是细胞替代疗法的2 个关键点。目前,小分子化合物以其使用便捷性、可控性和功能多样性等方面的显著优势,被广泛用于诱导干细胞增殖和分化[3]。CHAMBERS 等[4]报道,2 种Smad 信号通路抑制剂(SB431542+重组Noggin)协同诱导胚胎干细胞或诱导多能干细胞(induced pluripotent stem cells, iPSCs)表达神经外胚层早期标志物PAX6 和SOX1,从而实现类神经分化。此诱导方法称为双Smad 抑制。而在此诱导分化过程中,加入Wnt 信号通路激活剂CHIR99021 可提高诱导效率,快速、有效地诱导iPSCs 向类神经分化[5]。此外,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种成体干细胞,相比于胚胎干细胞有不涉及伦理问题的优势,且具有多向分化、来源广泛、取材相对容易、致瘤风险低的特点[6]。本研究应用小分子化合物诱导BMSCs 类神经分化并进行鉴定,探讨其可行性,意在拓展神经系统疾病替代疗法的思路。
1 材料与方法
1.1 主要材料
胎牛血清(德国Sera Pro 公司),DMEM/F12 培养液、胰蛋白酶、青链霉素(美国HyClone 公司),Forskolin、SB431542、DMH1、CHIR99021(美国Selleck公司),Neurobasal 培养基、B27、NEAA(美国Gibco 公司),表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)(美国PeproTech 公司),L-谷氨酰胺、DAPI 染料(美国Sigma 公司),兔抗CD34 抗体、兔抗CD45 抗体、兔抗CD90 抗体、兔抗CD105 抗体、兔抗NSE 抗体、兔抗Nestin 抗体、兔抗SOX1 抗体及兔抗Actin 抗体(美国Abcam 公司),山羊抗兔二抗(美国Earthox 公司),蛋白提取试剂盒、蛋白定量试剂盒、SDS-PAGE凝胶试剂盒(上海碧云天生物技术有限公司),蛋白Maker、Triton X-100(美国Thermo Fisher 公司)。
1.2 实验方法
1.2.1 全骨髓贴壁法分离培养BMSCs取4 周龄SD大鼠4 只,无特定病原体(SPF)级,体重(100±10)g/只,由锦州医科大学实验动物中心提供。脱颈处死,于75%酒精中消毒15 min,随后置于超净工作台。无菌条件下分离双侧股骨和胫骨,以含体积分数为10%胎牛血清的DMEM/F12 培养基反复冲洗骨髓腔,收集冲洗液充分吹打至细胞悬液。以1×109个/L密度接种至培养皿中,放置于37℃、5%二氧化碳培养箱中培养。48 h 首次半量换液,72 h 全量换液,以后每2 天全量换液1 次。待贴壁细胞达到80%~90%融合后,按1 ∶2 比例传代。
1.2.2 流式细胞仪鉴定BMSCs取生长状态良好的第3 代BMSCs,制备单细胞悬液,以1 500 r/min 离心5 min,弃上清,4%多聚甲醛4℃固定30 min,0.1%Triton X-100 室温通透10 min,加入一抗(CD34、CD45、CD90、CD105),4℃孵育2 h。洗涤2 次,加入荧光素标记的二抗,4℃孵育30 min,避光,上机检测。
1.2.3 小分子化合物诱导BMSCs 类神经分化取生长状态良好的第3 代BMSCs,以5×105个/ml 密度接种于培养皿,待细胞生长到70%后随机分为实验诱导组和对照组开始诱导。对照组以神经元培养基诱导4 d;实验诱导组以预诱导培养基诱导1 d,然后以诱导培养基诱导3 d。神经元培养基包含DMEM/F12:Neurobasal(1 ∶1) 培养基,1% B27,1%NEAA,1%青/链霉素,20 ng/ml EGF,10 ng/ml bFGF,0.2%肝素。预诱导培养基包含:神经元培养基,10 μmol/L Forskolin。诱导培养基包含:神经元培养基,0.1 mmol/L 抗坏血酸,2 μmol/L CHIR99021,4 μmol/L DMH1 和4 μmol/L SB431542。诱导方案见表1。
1.2.4 倒置显微镜观察细胞形态倒置显微镜观察BMSCs 分离培养过程中,诱导开始后第1、2 及3 天的细胞数量、形态、生长状况,记录并采集照片。
1.2.5 免疫荧光鉴定BMSCs 类神经分化去除培养基,4%多聚甲醛室温固定15 min,0.1% Triton X-100室温通透胞膜10 min,1% BSA 室温封闭60 min,加入一抗NSE、Nestin,4℃孵育过夜。二抗室温孵育2 h,DAPI 染核5 min,荧光防淬灭剂封片。以PBS 代替一抗作为阴性对照。荧光显微镜下观察并采集图像。
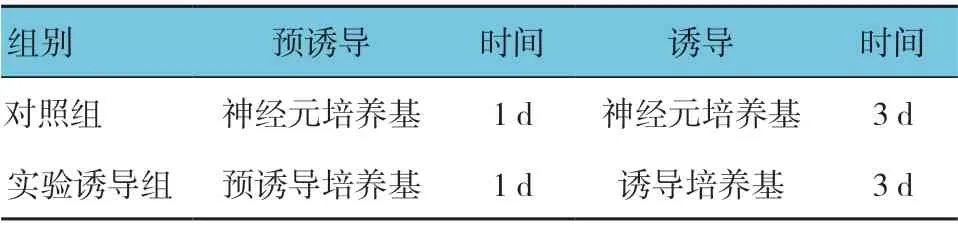
表1 BMSCs 类神经分化诱导方案
1.2.6 Western blotting 检测特异性蛋白表达水平提取蛋白样品并调整至同等浓度(3 μg/μl),制备10%SDS-PAGE 凝胶,上样电泳后转移至PVDF 膜,1%BSA 封闭1 h,加入一抗NSE、Nestin、SOX1、β-actin,4℃过夜,加入二抗室温孵育2 h,ECL 显色显影拍照。所得条带用Image J 软件分析。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 BMSCs 的鉴定结果
观察原代细胞,多为梭形或多角形,大小不一,换液去除杂质细胞后可见短梭形、星形细胞分散贴壁生长。细胞传代后可见伸出长短不一、粗细不均的突起,以梭形细胞为主,细胞生长旺盛。见图1。
流式细胞仪检测结果显示,第3 代细胞的间充质干细胞表面标志抗原CD90、CD105 表达呈阳性,阳性率分别为98.23%、99.27%;而造血干细胞表面标志抗原CD34、CD45 表达呈阴性,阳性率分别为1.09%、0.14%。见图2。
2.2 BMSCs 诱导后的细胞形态

图1 BMSCs 生长状态
诱导第1 天,可见少数细胞折光性变强,有较长突起;诱导第2 天,细胞形态变化更加明显,突触伸长,形成分支,并交织成网,呈神经细胞样形态,折光性更加明显;诱导第3 天,突起增多,相互连接成网。见图3。
2.3 免疫荧光鉴定BMSCs 诱导后蛋白表达
将诱导3 d 后的细胞进行免疫荧光染色,可见实验诱导组细胞被神经特异性标志物NSE、Nestin 标记,PBS 对照组未被荧光标记。见图4。
2.4 BMSCs 诱导后特异性蛋白表达水平

图2 CD34、CD45、CD90、CD105 阳性率情况

图3 BMSCs 诱导过程中细胞形态变化
Western blotting 检测细胞神经特异性蛋白的表达水平,结果显示:NSE 表达水平从对照组(0.463±0.154)上调至实验诱导组(0.918±0.232),Nestin表达水平从对照组(0.602±0.207)上调至实验诱导组(1.616±0.337),SOX1 表达水平从对照组(0.510±0.187)上调至实验诱导组(1.272±0.328),组间比较,差异有统计学意义(t=2.822、4.443 和3.503,P=0.048、0.011 和0.025)。见图5。

图4 神经特异性标志物表达

图5 诱导后细胞神经特异性蛋白表达水平比较
3 讨论
化学生物学是利用活性的小分子化合物干预蛋白功能和解析生物系统,从而认识生物系统的本质和内在规律的交叉学科[7]。小分子化合物能快速诱导干细胞分化,时间上精确可控,作用效果通常可逆,通过改变小分子的浓度进行微调[8]。与重组蛋白质比较,合成的小分子化合物可以更稳定、更容易量化、有效性可重复,并且生产成本要低得多,这对细胞生产来说尤为重要[9]。
本研究基于小分子化合物作用于特定信号通路的作用特点,采用协同分步诱导的方式,应用小分子化合物诱导BMSCs 类神经分化。首先,预诱导阶段使用添加Forskolin 的神经元培养基,培养持续1 d。Forskolin 是腺苷酸环化酶激活剂,通常用于提高环磷酸腺苷(cAMP)和cAMP 效应元件结合蛋白(CREB)水平[10],可以调节神经元分化并促进轴突再生[11]。其次,联合应用小分子化合物SB431542、DMH1 和CHIR99021 协同诱导BMSCs 类神经分化。研究表明,SB431542 和DMH1 可以有效抑制转化生长因子-β(TGF-β)信号通路[12]。TGF-β 信号通路是一个多功能细胞因子大家族,参与胚胎的发育及组织、器官的形成与修复[13]。TGF-β 信号通路可分为TGF-β/Activin/Nodal 和BMP/GDF/MIS 2 个亚家族通路[14],被激活后通常引起胚胎干细胞向中胚层分化。激活该信号通路首先需要TGF-βs 配体分子与受体结合,从而使受体TβRs 磷酸化,磷酸化的TβR-I 直接作用于Smads 蛋白,活化的Smads 将信号从细胞膜、胞浆传递到细胞核内,调控细胞的生物过程[15]。而已有实验表明当抑制BMP 或敲除Smad4 时,胚胎干细胞向神经外胚层发育[16]。研究证实,DMH1 能够抑制BMP 信号通路,阻断下游Smad1、Smad5 和Smad8 磷酸化从而诱导hESCs 神经分化[17];同样,研究显示SB431542能够抑制TGF-β1,阻断下游的Smad2、Smad3 磷酸化从而增强hESCs 神经胚状体产生[18]。CHAMBERS 等[4]报告,在细胞贴壁培养条件下同时抑制2 种信号通路,足以诱导80%以上的hESCs 实现快速和完全的神经分化。单独抑制一种通路时,神经外胚层分化的早期标志物PAX6 阳性率低于10%,表明协同抑制增加神经诱导效率。此诱导方法称为双Smad 抑制。双Smad 抑制可能包含以下几个潜在机制,破坏Activin 和Nanog介导的多能网络,抑制BMP 诱导hESCs 分化为滋养细胞谱系[19],通过抑制Activin 和BMP 信号来抑制hESCs向中/内胚层谱系分化[20],并通过抑制BMP 促进神经外胚层的分化[21]。
此外,CHIR99021 是一种GSK3-β 抑制剂,能够激活Wnt/β-catenin 信号通路,推动PAX、SOX1、NGN2 转录因子转录,作为一种有效的化学助剂增强神经分化[22]。此外,Wnt/β-catenin 是已知的、能够与Notch 形成复合物,增强HES1 表达,从而促进神经干细胞增殖并抑制其分化[23-24]。因此,Wnt/β-catenin 信号被GSK3β 抑制剂激活,可以直接增强神经诱导初始步骤相关基因的转录,并且还可以促进诱导分化系统中神经干细胞的增殖。
在过去几年中,BMSCs 已被认为是用于细胞治疗和再生重要细胞来源。BMSCs 具有较高可塑性,在体外和体内的适当条件下,BMSCs 可以表达中胚层、外胚层和内胚层的多种基因,分别分化为3 个胚层的多种细胞类型[25]。最近的研究表明,BMSCs 的神经可塑性对治疗各种神经系统疾病具有重要作用[26]。本研究结果显示,诱导过程中观察细胞发生明显神经样改变,诱导后表达NSE、Nestin 和SOX1,结果表明该组合能够诱导BMSCs 类神经分化。然而,小分子化合物作用于细胞信号通路的同时,可能会对细胞产生毒性作用。本研究联合应用小分子化合物(Forskolin、SB431542、DMH1、CHIR99021)诱导BMSCs 过程中发现,当正式诱导第2 天,个别细胞出现凋亡现象;第3 天时发现大片细胞凋亡。SURMACZ 等[27]发现在诱导分化过程中,当DMH1 浓度高于5 μmol/L 时会产生细胞毒性,推测可能是DMH1 影响细胞内其他分子靶点所致。提示不同干细胞对小分子化合物的浓度敏感性不同,同时小分子化合物对细胞的毒性作用是亟待解决的难题。
化合物诱导干细胞分化有良好的应用前景和优势,相比传统的基因操作方式易于操作、作用可控。但是其分子机制目前尚不完全清楚,其诱导过程安全性也仍需提高,还需要优化小分子化合物组合协同诱导细胞分化。随着研究深入,这将会推动再生医学蓬勃发展,为神经系统疾病的治疗方法带来深远影响。

