‘杨氏金红50号’猕猴桃组培苗生根与移栽研究
刘立果

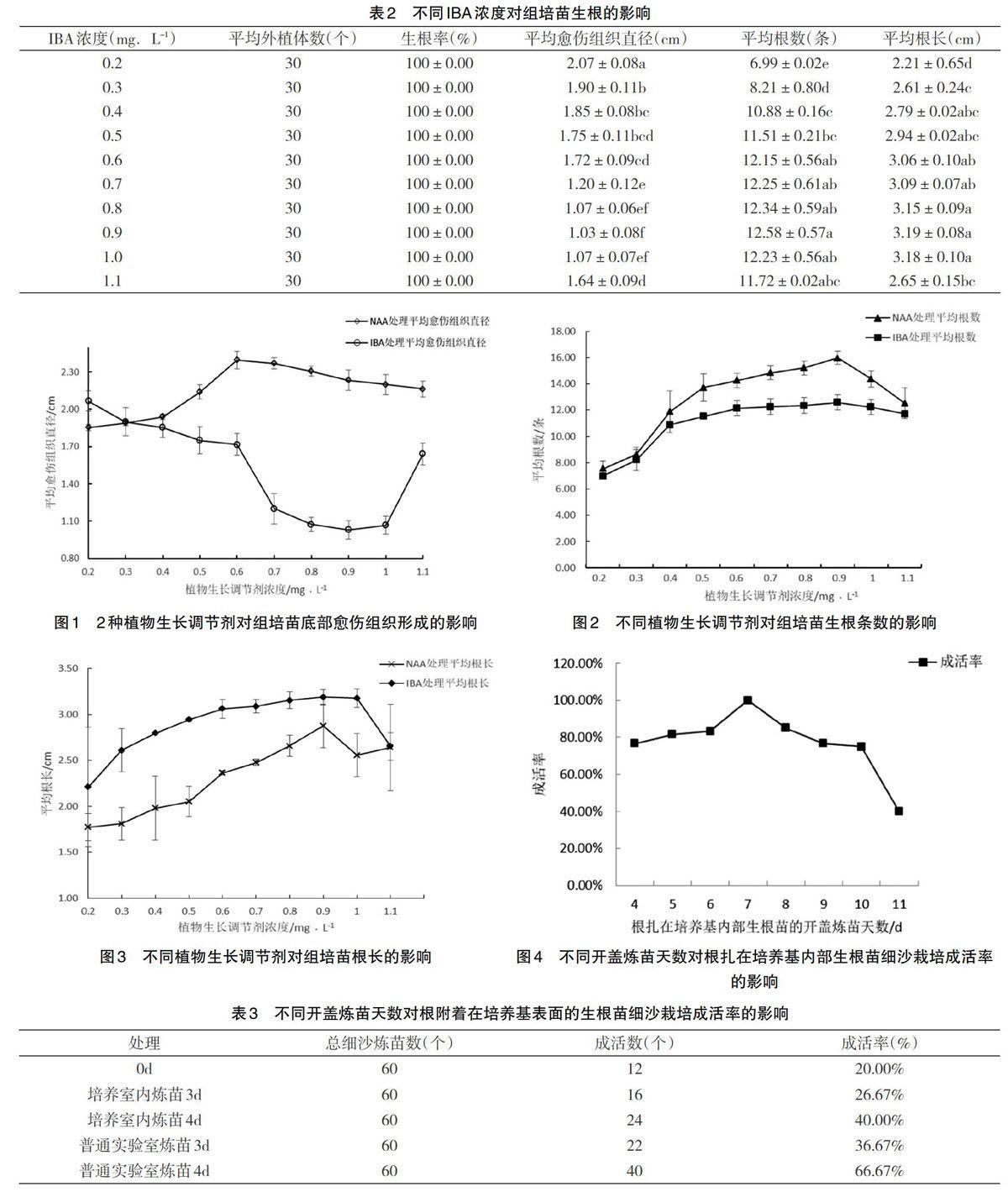
摘要:以‘杨氏金红50号猕猴桃组培苗为材料,进行生根培养、炼苗移栽研究。结果表明:‘杨氏金红50号猕猴桃生根培养中,愈伤组织块小的组培苗生根数多、根较长,且根深入培养基内部,易成活。生根培养的最佳培养基为1/2MS+0.9mg/L IBA,愈伤组织直径为1.03cm,生根率100%,生根数12.58条,根长3.19cm。培养室开盖炼苗7d后进行细沙栽培,细沙培养到根布满培养瓶时移栽至黑色腐殖土的田园土中,以成活率高。
关键词:猕猴桃;组培苗;生根;炼苗;移栽
近年来,中华猕猴桃以其优良的口感广受欢迎,人工栽培规模日趋增大。‘杨氏金红50号猕猴桃是江苏省扬州杨氏猕猴桃研究所选育的品种,果皮呈浅黄绿色,果肉呈淡黄色,果心呈红色,果实外形整齐端正,平均单果重104g左右,最大果重164.3g,耐储存,口感极佳,营养丰富,富含维生素C,具有较高的营养价值和经济价值。
猕猴桃传统的育苗方法育苗时间长,成活率低,难以满足市场的需求。利用现代生物技术——植物组织培养能实现猕猴桃苗快速大量繁殖。目前,国内对猕猴桃的组织培养研究已获得很大进展,在猕猴桃茎段、花药、叶柄、叶片等器官的组织培养方面取得很多成果。为提高‘杨氏金红50号猕猴桃组培苗的生根质量,本实验以其带芽茎段培养的组培苗为生根培养原材料,探索最佳生根培养方法、炼苗方法,提高移栽成活率,为猕猴桃的工厂化育苗提供技术指导。
一、材料与方法
以南阳师范学院组织培养室提供的‘杨氏金红50号猕猴桃组织培养苗为试验材料,采用以下方法进行生根培养及移栽试验。
(一)培养基及培养条件
生根培养的基本培养基为1/2MS培养基,培养基高度为1.5CB,pH为5.8~6.0,用高压灭菌锅灭菌,灭菌条件为:121℃、0.1MPa、20min。组织培养室温度为25±2℃,光照为1500~2000Lx。
(二)生根培养
在组织培养室选取高度3cm左右、长势较好的猕猴桃组培苗,将其不定芽切下,接种在分别含有NAA(萘乙酸)和IBA(吲哚乙酸)的1/2 MS培养基中进行诱导生根,NAA、IBA二种激素浓度设置10个梯度,均为(单位:mg/L):0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1。以1/2 MS培养基作为对照,每个处理重复3次,每个梯度接种30株组培苗,共接种1800株,培养35~40d后,进行生根率、生根数量及根长统计。
(三)炼苗、沙培和移栽
试验于2018年6月开始,组织培养实验室温度为25±2℃,普通实验室温度为25~30℃。开盖炼苗步骤如下:打开密封的瓶盖,使每棵生根苗充分接触光照,如炼苗过程中出现叶片萎焉现象,可适当向培养基内注入自来水,水面高度刚没过培养基表面即可。开盖炼苗,每个处理60个苗,开盖炼苗时间0~11d不等,炼苗环境分为培养室开盖炼苗、普通实验室开盖炼苗两种。
开盖炼苗之后,进行细沙栽培3周左右,步骤如下:在玻璃培养瓶中加入3/4体积的细沙,将猕猴桃组培生根苗从培养基中取出,用自来水洗净苗根部的培养基,将生根苗栽种在细沙中,然后用自来水一次性浇透,但不能浇过量,待其快干时,再浇第二次水。细沙炼苗在普通实验室中进行,室内通风,自然光照,温度为25~30℃。
将细沙栽培后根系发达、长势良好的生根苗移栽到装有田园土的大花盆中,田园土包括黄土或腐殖土两种,分别移栽60棵苗,然后将大花盆置于室外阳台,使其充分沐浴阳光,每天浇适量水,保持花盆内水分充足,一个月后统计成活率。
二、结果和分析
(一)组培苗生根
1、不同质量浓度的NAA或IBA对组培苗生根的影响。NAA或IBA对组培苗的生根均有促进作用,不加植物生长调节剂的1/2 MS培养基的组培苗生根率为0;加入NAA诱导生根,第10d出现根点,17d后陆续出现不定根;IBA诱导生根较快,在培养第7d有根点产生,14d后陆续长出不定根。不同浓度的NAA和IBA对组培苗生根的影响见表1和表2。
由表1可知,10个浓度的NAA处理中,生根率均达到了85%以上,生根效果良好。浓度(mg/L)为1.0、1.1时,生根率为100%,浓度(mg/L)为0.6、0.7、0.8时,生根率均为98.89%,浓度(mg/L)为0.5、0.9时,生根率为97.78%,这三档生根率之间无显著差异。
由表2可知,10个浓度的IBA处理中,生根率都达到了100%。可见,在组培苗生根率方面,IBA的效果优于NAA。
2、两种植物生长调节剂浓度对愈伤组织大小的影响。由图1可知,NAA处理的愈伤组织块相对較大,浓度为0.6 mg/L时愈伤组织直径最大,0.2mg/L时,愈伤组织直径最小,但所有的处理愈伤组织块均大于1.5cm,因此,绝大部分的根均为附着在培养基表面的不定根。IBA处理中,浓度为0.2mg/L时,愈伤组织最大,浓度为0.9mg/L时,愈伤组织最小,其中,浓度为0.2、0.3、0.4、0.5、0.6、1.1mg/L的愈伤组织直径大于1.5cm,会出现部分附着在培养基表面的根,浓度为0.7、0.8、0.9、1.0mg/L的愈伤组织直径小于1.5cm,根基本都扎在培养基内部。
3、不同植物生长调节剂对组培苗生根条数的影响。由图2可知,NAA处理的生根数均高于IBA处理,两者的趋势均为先随着激素浓度的升高生根条数逐渐增加,在浓度为0.2~0.5mg/L范围内生根条数增加迅速,NAA处理由7.55条上升到13.71条,IBA处理由6.99条上升到11.51条;浓度在0.5~0.9mg/L范围内时,NAA处理增加较明显,增长幅度为2.26条,而IBA处理增长幅度仅为1.07条;两者均在0.9mg/L时达最大值,NAA处理为15.97条,IBA处理为12.58条,此时2处理的生根条数差也达最大,为3.39条。浓度大于0.9mg/L时生根条数减少,NAA处理的下降幅度大于IBA处理。可见,在生根数量方面,NAA处理所有浓度均优于IBA处理,尤其浓度为0.9mg/L时,生根数量最多。
4、不同植物生长调节剂对组培苗根长的影响。由图3可知,IBA处理每个浓度的根长均高于NAA处理。浓度在0.2~0.9mg/L时,两种处理均随着激素浓度增加根长逐渐变长,浓度为0.9mg/L时,两种处理的平均根长均最长,IBA处理为3.19cm,NAA处理为2.87cm,差值为0.32cm;浓度在0.9~1.1mg/L时,IBA处理的根长先略微降低,然后迅速降低,NAA处理的根长是先降低然后又略有增加,但各浓度间的根长无显著差异。分析表明,IBA在促进根伸长方面效果更优,浓度为0.9mg/L时根长最长。
综上所述,浓度为0.9mg/L的IBA处理,生根率为100%,愈伤组织直径最小,平均生根数最多,平均根长最长,说明此浓度为IBA处理的最佳浓度。浓度为0.9mg/L的NAA处理,生根数最多,根长最长,且都显著高于其它浓度的处理,愈伤组织直径处于中等水平,生根率为97.78%,与最高的100%无显著差异,但显著高于其浓度以下的生根率,因此,该浓度为NAA处理的最佳浓度。
(二)开盖炼苗
由于生根培养中出现了2种生根方式,分别对其进行开盖炼苗处理,每个处理60个苗。
1、开盖炼苗对根附在培养基表面生根苗的影响。根附着在培养基表面的生根苗在开盖炼苗时,1d内就会出现叶片干焦的情况,超过4d叶片基本落完,茎也会出现萎焉现象,因此,炼苗时间应控制在5d以内。由于炼苗时间较短,可选择培养室炼苗和普通实验室炼苗两种方式,分别炼苗3d、4d,以0d为对照。炼苗过程中,培养室内的培养基4d内无污染,而普通实验室的培养基第2d便有菌斑出现,第4d已经有较大的菌落,少量菌落已沾在苗的根部,第5d时,菌落大面积接触幼苗根部,严重影响移栽。开盖炼苗3d、4d,此种苗的绝大部分根不能从培养基获得营养。
2、开盖炼苗对根扎在培养基内部生根苗的影响。根扎在培养基内部的生根苗可进行多天开盖炼苗,选择细菌相对较少的组织培养室内炼苗,炼苗时间为4~11d。试验观察发现,在培养基内部的根无明显根毛分化,主根粗、长,侧根多且清晰可辨,根与根间基本不会缠绕在一起。开盖炼苗过程中,低于4d,达不到炼苗效果,多于11d,细菌会大量污染培养基,导致生根苗无法移栽。在4~11d时,绝大部分发育完全的根开始具有吸收作用。在培养室内,第6d培养基开始出现菌点,扩展较慢,到第11d,一部分苗也会感染细菌导致无法移栽。
(三)细沙栽培
将上述2种方式开盖炼苗不同天数的生长状况良好的生根苗转栽至细沙中,进行下一阶段栽培,统计炼苗天数与移栽至细沙后成活率的关系,每个处理60个苗。
1、细沙栽培对根附着在培养基表面生根苗的影响。细沙栽培时,生根苗基部的叶片会先干枯脱落,再由腋芽重新萌发,长出新叶,整个过程2周左右。一部分幼苗1周内会直接枯萎死亡,一部分幼苗根部腐烂,间接导致死亡。不同开盖炼苗天数对生根苗细沙栽培成活的影响见表3。
由表3可見,0d时,即直接进行细沙栽培的生根苗成活率最低,仅20%;在普通实验室开盖炼苗4d的生根苗进入细沙炼苗后成活率最高,为66.67%。普通实验室炼苗效果比培养室炼苗效果好,3d时成活率高10%,4d时高26.67%。成活的苗,细沙栽培至6周,从瓶子外部不能看到根的明显生长,但苗生长正常,挖出幼苗可发现大块的愈伤组织仍然存在,但由原来的青绿色变为褐色。表明,根附着在培养基表面的幼苗,根与细沙栽培前相差不大。
2、细沙栽培对根扎在培养基内部生根苗的影响。不同开盖炼苗天数对根扎在培养基内部生根苗的影响见图4。开盖炼苗7d时,成活率最高,达到100%,4~7d时的成活率逐步上升,7~11d时成活率下降,到第11d达到最低值,仅40%,与第10d相差35%。表明组织培养室内炼苗7d的细沙栽培效果最好。在细沙栽培第2~3周时,透过透明的玻璃培养瓶可清楚看到根系穿过细沙,布满培养瓶。
上述分析表明,根附在培养基表面的幼苗由于条件限制,最佳开盖炼苗天数短,为4d,细沙栽培成活率低,仅为66.67%;根扎在培养基内部的幼苗开盖炼苗7d时,细沙栽培成活率为100%,两者细沙栽培成活率有显著差异。可见,应选择根扎在培养基内部的生根苗进行炼苗,培养室内开盖炼苗7d,再细沙栽培2~3周。
综合分析表明,浓度为0.9mg/L的IBA处理获得的‘杨氏金红50号猕猴桃生根苗为最佳的炼苗材料。
(四)田园土移栽
选择两种田园土基质黄土和黑色腐殖土,移栽幼苗为0.9mg/L IBA处理获得的愈伤组织块小、根数较多、根长较长的生根苗,并进行7d培养室内开盖炼苗,2~3周细沙栽培,选根系发达的幼苗移栽,每种基质移栽60个苗。田园土基质为黄土的成活率为97.78%,田园土基质为黑色腐殖土的成活率为100%。试验发现,在黄土中移栽的幼苗浇水比较麻烦,且土粒易溅到叶子及顶芽上,若粘在顶芽上,则有可能导致幼苗死亡,因此,黄土移栽应选择茎部较长的幼苗。黑色腐殖土不会出现上述情况,管理简单,长势也好。可见,田园土基质为黑色腐殖土更适合用于‘杨氏金红50号猕猴桃幼苗移栽。
三、讨论
在‘杨氏金红50号猕猴桃生根时,基本培养基中加入IBA 0.9mg/L可促进组培苗生根,生根率达100%,生根速度快,根数量多而长、质量好;开盖炼苗时,根在培养基内部,能充分保证根所需水分、养分,使其保持活性,移栽成活率高。而经NAA处理的组培苗,由于愈伤组织过大,根生长在培养基外表面,无法及时汲取培养基养分,在炼苗中易干枯、死亡。有关IBA与NAA诱导猕猴桃生根的报道较多,如,刘长春等对比了NAA、IBA对‘金富猕猴桃生根的影响,指出IBA诱导生根时间更短,生根率高出NAA处理9.8%,最佳使用浓度为0.7mg/L;吴秀华等对培养‘海沃德猕猴桃生根的结果表明,相同浓度的IBA诱导效果好于NAA,且有促进茎部伸长的作用,最佳使用浓度为0.7mg/L;吕海燕等培养‘东红猕猴桃生根时表明,0.5mg/L浓度时,IBA的诱导效果显著优于NAA,生根率为92.33%。本试验的结果与上述文献相似,但IBA的浓度比上述文献高,这可能是因为品种差异导致对激素的响应程度不同。
现有文献中,没有涉及愈伤组织块大小对生根培养影响的研究,本试验发现愈伤组织直径大于培养基高度时,产生的根附在培养基表面,对后续炼苗影响很大,这是因为此类根虽然根毛旺盛,但根系脆弱,与培养基接触少,大部分根裸露在空中,瓶子开盖后水分丧失多,而又不能吸收培养基中的水分和养分,因此,生根苗很快就会出现干焦的情况。愈伤组织块直径小于培养基高度时,开盖炼苗,根会被培养基包裹,有充足的养分和水分供给,可保证开盖炼苗时长时间不会枯萎,能达到炼苗的效果。因此,在猕猴桃生根培养时,应控制愈伤组织大小,使多数根生长在培养基内部。
细沙栽培是生根苗移栽至田园土的过渡阶段,此阶段在自然光照、自然温度中进行,细沙和田园土较为相似,猕猴桃幼苗的根在生长中能吸收营养及水,根变得更长更壮。细沙的透气性好,但保水性差,培养瓶是不漏水的,利用培养瓶装细沙可有效保证细沙内的水分,弥补了细沙的短处。王羽悦等将细沙和蛭石配合使用,对葛枣猕猴桃组培苗炼苗30d,得到了93.3%的成活率;林苗苗等将细沙与珍珠岩、泥炭1:1:1配比组合使用进行软枣猕猴组培苗炼苗,得到98%的成活率。上述研究将细沙与蛭石或珍珠岩等配合使用是为了保持水分和通透性,这在原理上与本试验使用培养瓶装细沙相似。
田园土移栽中,移栽于田园土基质为黄土的幼苗,浇水方式至关重要,在浇水时应注意清洗幼苗叶片附着过多的黄土。移栽于田园土基质为黑色腐殖土内的幼苗,腐殖质含量多,颗粒大,营养丰富,且透气性好,浇水时溅到叶片上影响也不大,幼苗生长迅速,叶片大而绿,根、茎健壮,成活率高。
(责任编辑 曹雯梅)

