Fe2O3-Co3O4/Al2O3催化剂催化含氯尾气脱氢性能研究
薛玲,张彤,赵斌,薛建伟,李福祥,吕志平
(太原理工大学 化学化工学院,山西 太原 030024)
中国是氯气生产和消费大国,截止2018年,中国氯碱企业生产的氯产品就有200多种,氯气供应量高达3 000万t,超过世界总量的40%[1-2]。工业上将氯气液化为液氯来储存运输,但其在液化过程中会产生部分不凝气体(主要含Cl2、N2、O2和H2),称为含氯尾气(简称尾氯),尾氯中H2体积分数超过4%会有爆炸危险,因此需进行脱氢处理[3-6]。为了安全有效脱除含氯尾气中的少量氢气,本文采用高比表面积的γ-Al2O3为载体,负载廉价金属铁和钴的氧化物,制备双金属氧化物催化剂,在低温下探索含氯尾气的脱氢性能,这将对工业上处理含氯尾气中的氢气提供借鉴和思考。
1 实验部分
1.1 试剂与仪器
氧化铝(40~60目)、硝酸铁、硝酸钴均为分析纯;实验用水均为去离子水。
202型数显恒温干燥箱;SX2-4-10型马弗炉;GC-900型气相色谱仪;MiniFlex II 型X射线衍射仪;Sigma 500型扫描电子显微镜;IRAffinity-1型傅里叶变换红外光谱仪;NOVA 2000e型物理吸附仪。
1.2 催化剂制备
采用等体积浸渍法,以γ-Al2O3为载体,Fe(NO3)3·9H2O和Co(NO3)2·6H2O为前驱体制备负载型Fe-Co双金属氧化物催化剂。首先计算出Fe2O3和Co3O4不同负载量下所需的硝酸盐质量,根据载体饱和吸水量,配制一定量的Fe(NO3)3·9H2O和Co(NO3)2·6H2O混合盐溶液,然后将盐溶液等体积浸渍于γ-Al2O3载体上,室温静置12 h,120 ℃干燥12 h,550 ℃空气气氛下焙烧5 h,即制得催化剂[7-8]。
根据以上方法,制备Fe2O3和Co3O4负载量分别为3.0%(相对于催化剂的总质量,均为质量百分比%,以下同)和1.0%的负载型Fe2O3-Co3O4/Al2O3催化剂,记为I类催化剂;制备Fe2O3负载量为3.0%,Co3O4负载量分别为0.0,0.5%,0.8%,1.0%,1.2%,1.6%,2.0%的7种负载型Fe2O3-Co3O4/Al2O3催化剂,记为II类催化剂;制备Co3O4负载量为1.0%,Fe2O3负载量分别为0.0,0.5%,1.0%,2.0%,3.0%,4.0%,5.0%的7种负载型Fe2O3-Co3O4/Al2O3催化剂,记为III类催化剂。将上述500 ℃焙烧温度分别改为400,450,500,550,600,650 ℃,制备Fe2O3和Co3O4负载量分别为2.0%和1.2%的6种Fe2O3-Co3O4/Al2O3催化剂,记为IV类催化剂。
1.3 催化剂表征
采用粉末X射线衍射(PXRD,CuKα)对催化剂物相进行表征,采用场发射扫描电子显微镜(SEM)对催化剂形貌进行表征。采用全自动表面积和孔隙度分析仪(BET)对催化剂比表面积、孔容和孔径等参数进行表征,采用傅里叶变换红外光谱仪(FTIR)对催化剂骨架结构进行表征。
1.4 催化性能测试
模拟工业含氯尾气组成即Cl2(65%~80%)、H2(1.5%~4%)、O2(8%~10%)和N2(12%~15%)配制反应气,在固定床反应装置上进行含氯尾气脱氢反应,催化剂用量0.5 g,反应开始前需用N2对整个管路进行吹扫除去管路中残留的气体和杂质,吹扫完毕后打开反应气阀门,调节转子流量计控制气速,待气速稳定后,每隔一定时间进行取样,直至反应结束。取样气体用气相色谱仪(色谱柱:φ3 mm×3 m的不锈钢填充柱,填充物为5A分子筛,TCD检测器)进行定性和定量分析,色谱测试条件:气体进样1 mL,气体流速15 mL/min(0.05 MPa),柱温53 ℃,汽化室温度100 ℃,检测器温度100 ℃,桥电流60 mA。催化性能以氢气平均转换率、氢氧反应选择性和氢氯反应选择性表示。
2 结果与讨论
2.1 Fe-Co双金属氧化物催化剂XRD谱图分析
图1a为γ-Al2O3的XRD谱图,由图可知,衍射峰位于67.25,45.63,37.22°分别对应于γ-Al2O3(440)、(400)和(311)晶面的衍射峰[9]。图1b中,在24.12°和33.25°处有极其微弱的Fe2O3衍射特征峰,说明铁物种在催化剂中主要以 Fe2O3形态存在[10]。图1c中,在65.12,32.11,19.88°处出现了不是很明显Co3O4衍射峰,说明钴物种在催化剂中主要是以Co3O4形态存在[11]。图1d为Fe2O3-Co3O4/Al2O3催化剂谱图,可以看出有明显的γ-Al2O3特征峰,与单独的Fe2O3/Al2O3和 Co3O4/Al2O3谱图相比,特征峰强度更加微弱,可能是因为金属元素负载量较少,所负载的金属元素在γ-Al2O3表面高度分散。对比4个XRD谱图发现,负载金属后的谱图与γ-Al2O3谱图没有太明显的变化,表明所制备催化剂结构稳定。

图1 不同催化剂的XRD谱图Fig.1 XRD spectra of different catalystsa.γ-Al2O3;b.Fe2O3/Al2O3;c.Co3O4/Al2O3;d.Fe2O3-Co3O4/Al2O3
2.2 Fe-Co双金属氧化物催化剂SEM谱图分析
图2为催化剂的整体和局部放大SEM电镜图。
由图2a和2b可知,载体表面光滑,为粒径大小约100 nm的片状结构。由图2c可知,负载金属氧化物后,催化剂整体表面变得疏松多孔,呈现出10~100 nm无定型的颗粒状形态,表明铁钴金属氧化物被成功地均匀负载在整个γ-Al2O3载体上。Fe2O3-Co3O4/Al2O3催化剂反应后的形貌见图2e和2f。对比图2c和2d可知,反应后催化剂的颗粒度大小没有明显变化,但整体形貌发生了一定的变化,整体表面变得粗糙不平,出现了团聚现象,这可能是因为催化剂表面被氯气和反应生成的盐酸腐蚀所导致的。

图2 催化剂的SEM谱图Fig.2 SEM spectrum of catalysta和b.γ-Al2O3;c和d.Fe2O3-Co3O4/Al2O3反应前;e和f.Fe2O3-Co3O4/Al2O3反应后
2.3 Fe-Co双金属氧化物催化剂的FTIR谱图分析
由图3可知,3个图谱均在波数为810~580 cm-1范围内出现较宽的吸收峰,此为Al—O键的伸缩振动峰[11];在3 442,1 628 cm-1处的特征吸收峰为表面—OH官能团伸缩振动产生的吸收峰[12]。

图3 催化剂的FTIR谱图Fig.3 FTIR spectrum of catalystsa.γ-Al2O3;b.Fe2O3-Co3O4/Al2O3反应前;c.Fe2O3-Co3O4/Al2O3反应后
图3中b和c在1 380 cm-1处的吸收峰可能是γ-Al2O3表面存在的Fe3 +与O—H的弯曲振动产生的吸收峰[13]。另外,b和c在1 100 cm-1处均存在微弱的Fe—O振动带,表明在Fe2O3-Co3O4/Al2O3催化剂中存在少量Fe2+,可能是由于部分Fe3+被还原所产生的[14]。由于Co3O4中的Co—O在665~578 cm-1范围内的伸缩振动峰与810~580 cm-1范围内的Al—O特征峰重叠,故图中呈现出一个宽峰,未观察到Co—O振动峰[15]。图3中的3条谱图出峰位置和强度基本一致,表明制备的Fe2O3-Co3O4/Al2O3催化剂骨架结构稳定。
2.4 Fe-Co双金属氧化物催化剂的N2吸附-脱附测试
图4为催化剂N2吸附-脱附等温线及其相应的孔径分布,根据IUPAC分类可知,该催化剂的N2等温线为IV型,是典型的介孔结构,且中间部分出现了H3型滞后环,表明为片状粒子堆积形成的狭缝孔[16]。

图4 催化剂的N2吸附-脱附等温线(插图为相应的孔径分布图)Fig.4 N2 adsorption-desorption isotherm of the catalyst(inset shows the distribution of pore diameter)a.γ-Al2O3;b.Fe2O3-Co3O4/Al2O3反应前;c.Fe2O3-Co3O4/Al2O3反应后
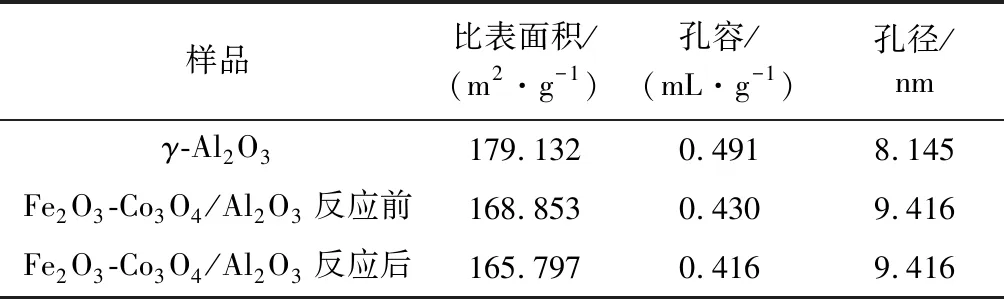
表1 载体和反应前后催化剂的比表面积、孔容和孔径Table 1 Specific surface area,pore volume and pore diameter of support and catalyst before and after reaction
由表1可知,活性组分负载在γ-Al2O3载体上后,Fe2O3-Co3O4/Al2O3催化剂的BET表面积和孔容均比载体γ-Al2O3的小,可能是因为负载型催化剂中的金属氧化物粒子与载体之间产生了相互作用,导致催化剂在干燥和焙烧过程中离子迁移能力减弱,活性组分均匀地附着在载体表面及孔道内,使得负载金属氧化物后催化剂的表面积和孔容有所减小[14]。但负载后孔径比载体γ-Al2O3的大,这可能是因为在催化剂处理过程中出现了一些孔塌缩现象,从而使得负载后催化剂孔径增大[17]。负载型催化剂反应前后的孔径大小没有发生变化,表明反应后催化剂孔结构保持良好。由BET测试结果可知,活性成分的引入不会显著影响原始载体的孔结构,可能是因为金属氧化物总负载量低且活性组分均匀地分布在载体表面,因此制备的Fe2O3-Co3O4/Al2O3催化剂仍然是具有大的比表面积和良好的孔分布的催化材料。
2.5 Fe-Co双金属氧化物催化剂催化脱氢性能
图5为1.2节中不同条件下制备的Fe2O3-Co3O4/Al2O3催化剂催化含氯尾气脱氢效果图。


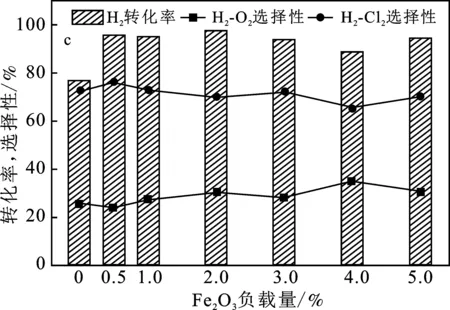

图5 催化剂在不同反应条件下的H2平均转化率和反应的选择性Fig.5 H2 average conversion rate and reaction selectivity of the catalyst under different reaction conditions
图5a为采用I类催化剂,考察了不同反应温度(50,70,90,110,130,150 ℃)催化含氯尾气脱氢效果。由图5a可知,低温时,催化剂催化反应活性较差,随着反应温度的升高,气体分子运动加速,反应生成物能很快地从催化剂表面脱离,释放出更多的活性位点,使得H2转化率逐渐增高。在150 ℃时,含氯尾气脱氢反应的效果达到最佳,H2平均转化率高达95%。
图5b和5c是在150 ℃反应温度下,采用II和III类催化剂,分别考察了不同Co3O4负载量和不同Fe2O3负载量下Fe2O3-Co3O4/Al2O3催化剂脱氢性能。由图5b可知,钴元素的加入对反应有促进作用,但过高的负载可能会堵塞催化剂载体孔道,导致催化性能降低,当Co3O4负载量为1.2%时,H2平均转化率为95%,催化活性达到最佳。由图5c可知,随着铁元素含量的增加,H2转化率大幅度提高,当Fe2O3含量达到2%时效果最优,H2转化率基本稳定在96%左右。结合图5b和5c发现,单一的Fe2O3和Co3O4负载催化剂均表现出了一定的催化活性,但 Fe2O3-Co3O4/Al2O3催化剂表现出了更为优异的催化活性,表明铁钴元素之间的协同作用更有利于催化含氯尾气脱氢。最佳Fe2O3和Co3O4负载量分别为2.0%和1.2%。
图5d是在150 ℃反应温度,采用IV类催化剂,考察了不同焙烧温度下Fe2O3-Co3O4/Al2O3催化剂脱氢性能。由图5d可知,400 ℃焙烧时脱氢效果最好,随着焙烧温度的增加,H2转化率逐渐降低,可能是因为过高的焙烧温度会破坏催化剂的孔道结构,导致催化性能降低。因此最佳焙烧温度为400 ℃。
结合图5中4个图发现,H2和O2反应的选择性普遍低于H2和Cl2反应的选择性,反应温度和焙烧温度的不同对反应的选择性影响较大,金属元素负载量的改变对反应选择性影响较小。
3 结论
本文采用等体积浸渍法制备了一系列Fe2O3-Co3O4/Al2O3催化剂,在固定床反应器上对其进行了含氯尾气脱氢活性评价,得到了以下结论。
(1)含氯尾气脱氢反应中,铁物种在催化剂中主要以 Fe2O3形态存在,钴物种在催化剂中主要是以Co3O4形态存在,说明Fe2O3和Co3O4是主要的催化活性组分。
(2)对比单一的铁基和钴基催化剂催化活性,Fe2O3-Co3O4/Al2O3催化剂表现出了更优异的催化活性,表明铁钴元素之间的协同作用更有利于催化含氯尾气脱氢反应进行。
(3)Fe2O3-Co3O4/Al2O3催化剂催化含氯尾气脱氢最优条件:Fe2O3和Co3O4负载量分别为2.0%和1.2%,焙烧温度为400 ℃,反应温度为150 ℃,反应最高脱氢效果可达96%。总体上,H2-O2反应的选择性小于H2-Cl2反应的选择性,且金属氧化物负载量对反应选择性影响不大,但反应温度和焙烧温度对反应选择性影响较大。

