不同粒径的免疫磁珠对食源性致病菌捕获效率的影响
李静雯,杜美红,杨 寅,陈 婷,陈尔凝,赵瑞雪
(北京市理化分析测试中心 北京市食品安全分析测试工程技术研究中心/北京市基因测序与功能分析工程技术研究中心,北京100089)
免疫磁珠(Immunomagnetic beads,IMBs)是 一类表面固定了特异性抗体的磁性颗粒,所以能够特异性地捕获目标物并在一定磁场强度下分离目标物[1],由此形成的免疫磁分离技术已应用于环境监测[2],体外诊断[3-4]和食品安全检测[5-6]等诸多领域。在微生物检测领域,由于传统微生物病原体检测前处理方法烦琐耗时,世界上许多国家都采用免疫磁珠特异性捕获作为一种有效的前处理方法,在大肠埃希氏菌O157:H7、贾第鞭毛虫、隐孢子虫等微生物检测标准中应用[7-12],使其检测效率得到大幅提高。
微米级免疫磁珠(1~4.5μm)在食源性致病菌快速检测样品前处理中已经被普遍采用[13-18],以DynabeadsTM1μm、2.8μm免疫磁珠应用最为广泛。粒径大小是影响免疫磁分离效率的重要因素之一,有研究发现大粒径(2.8μm)磁珠的表面抗体的密度较高,所以相对于小粒径(1μm)免疫磁珠对目标菌的捕获更加有效[19]。随着市场的需求以及超顺磁性颗粒制备技术的发展,亚微米级免疫磁珠(0.1、0.18、0.3、0.5μm等)也逐渐实现商品化应用,目前我国自主研发的免疫磁珠粒径以100 nm~1μm为主。由于比微米级免疫磁珠具有更大的比表面积优势,亚微米级免疫磁珠被更多地应用于小分子靶标的分离纯化[20-24]。但是对于细菌、细胞等大分子目标微生物的捕获分离,在不同情况下,呈现了不同的捕获率变化规律。Shan等[25]研究表明相同质量下小粒径(180 nm)免疫磁珠捕获率高于大粒径(350 nm)。但Chen等[13]研究显示,经过一段时间放置的小粒径(100 nm)免疫磁珠捕获率低于大粒径(500 nm)免疫磁珠,并不符合比表面积大捕获率高的简单规律。而且免疫磁珠在食品中目标菌的特异性捕获过程中,需要面临复杂的培养基或食品基质,且存在大量的非致病杂菌的干扰。在这种情况下,微米级与亚微米级免疫磁珠各自的捕获性能优势还没有被充分研究证实。沙门氏菌是我国最常见的食源性致病菌之一[26],是引起食品安全问题的首要原因。
作者以沙门氏菌免疫磁珠为对象,制备微米级和亚微级的免疫磁珠,比较免疫磁珠表面抗体偶联量、对不同细菌浓度沙门氏菌目标菌捕获率、特异性、在不同基质中的捕获效率及磁回收率进行表征,以阐明免疫磁珠粒径对食品样品中微生物菌体捕获效率的影响,旨在为免疫磁分离技术在食品中微生物快速检测前处理中的应用提供重要的科学依据及参考。
1 材料与方法
1.1 微生物培养
本研究采用的标准菌株:鼠伤寒沙门氏菌(Salmonella Typhimurium,ATCC14028)和金黄色葡萄球菌(Staphylococcus aureus,ATCC25923),购自美国典型微生物菌种保藏中心。大肠杆菌O157:H7(Escherichia coli O157:H7,NCTC12900),购买于广东环凯微生物科技公司。首先室温复苏标准菌株,取适量菌悬液转移至9 mL营养肉汤培养基中,36℃静置培养24 h。移取100μL培养物于灭菌离心管中,用缓冲液适当梯度稀释,然后在PCA琼脂平板或HE琼脂平板36℃培养24 h并计数。缓冲液是含有质量分数0.85%氯化钠和体积分数0.05%Tween-20的0.01 mol/L磷酸缓冲盐溶液,pH 7.2左右。
1.2 不同粒径免疫磁珠的制备
300 nm羧基磁珠:无锡百迈格生物科技有限公司产品;1μm羧基磁珠:赛默飞世尔科技有限公司产品。分别取100μg 300 nm磁珠、100μg 1μm磁珠与1、1.5、2μg山羊抗沙门氏菌抗体制备免疫磁珠,制备方法参照前期研究发表论文[25]。通过激光粒度仪用动态光散射法表征2种免疫磁珠磁珠的粒度。
1.3 抗体偶联量
免疫磁珠表面抗体偶联量通过流式细胞仪表征,表征方法参照前期研究发表论文[27]。
1.4 捕获率
制备细菌浓度为1×102~1×108CFU/mL的鼠伤寒沙门氏菌菌悬液,分别取50μg 300 nm免疫磁珠和1μm免疫磁珠加入1 mL上述菌悬液中,涡旋混匀,在混匀仪上旋转30 min。在5 000 Gs的磁力架上磁分离10 min,取上清液用PCA琼脂平板进行平板计数。用1 mL缓冲液将IMBs与沙门氏菌复合物重悬,同样进行平板计数,每个实验设置3个平行。免疫磁珠的捕获率由以下公式(1)计算得到:

其中,CE为捕获率(%);Nu为上清液的菌落数(CFU);Nb为重悬液的菌落数(CFU)。
利用扫描电子显微镜表征2种免疫磁珠的形貌特征,以及其与沙门氏菌的结合情况。
不同免疫捕获体系体积:分别取300 nm和1μm沙门氏菌免疫磁珠各200μg,分别加入1、10 mL和25 mL PBST,同时投入1×103CFU鼠伤寒沙门氏菌标准菌,温和混匀,捕获分离方法及捕获效率计算同上。
不同免疫捕获样本体系:三元特品鲜牛奶全脂巴氏杀菌乳,购自北京某超市(经平板培养,样品沙门氏菌为阴性)。分别在1 mL缓冲液、1 mL与25 mL牛奶中加入1×103CFU的鼠伤寒沙门氏菌,然后分别投入200μg 300 nm或1μm免疫磁珠,免疫捕获和磁分离过程同上,将上清液和重悬液在HE琼脂平板上培养并计数,免疫磁珠的捕获率计算方法同上。
1.5 特异性
制备细菌浓度为1×103CFU/mL金黄色葡萄球菌悬液和1×103CFU/mL大肠杆菌O157:H7菌悬液,分别与1×102CFU/mL鼠伤寒沙门氏菌菌悬液混合,向2种混合液中分别加入100μg 300 nm或1μm免疫磁珠,免疫捕获和磁分离过程同上。在含有大肠杆菌O157:H7的实验中,将上清液和重悬液分别在三糖铁琼脂和HE琼脂中培养并计数,而金黄色葡萄球菌实验中,需将培养基替换为BP琼脂和HE琼脂平板。分别计算免疫磁珠对这3种细菌的捕获率。
1.6 磁回收率
分别取1 mL缓冲液或25 mL牛奶样品,加入200μg 300 nm或1μm免疫磁珠,充分混匀。在强度为5 000 Gs的外加磁场下,每隔30 s弃去上清液,将免疫磁珠重悬。在可见光分光光度计410 nm和600 nm波长处分别检测300 nm免疫磁珠和1 μm免疫磁珠重悬液随时间变化的吸光度值,绘制标准曲线,以计算免疫磁珠的量,并按下列公式(2)计算磁回收率。

式中,I为磁回收率;I0为磁分离的免疫磁珠的物质的量;I1为磁分离前免疫磁珠的物质的量。
2 结果与分析
2.1 粒径对免疫磁珠抗体偶联量的影响
磁珠表面抗体偶联量的表征多采用BCA法或Bradford法,通过测定制备免疫磁珠后溶液中剩余抗体的浓度,以间接获得磁珠表面抗体的偶联量[28-29]。本研究中利用经过FITC荧光标记的二抗与免疫磁珠表面抗体特异性结合,采用流式细胞术表征免疫磁珠表面二抗FITC荧光强度的方法,直接反映磁珠表面抗体偶联量。经激光粒度仪检测,300 nm和1μm磁珠经抗体偶联后的平均粒径分别(310±137)、(1 103±175)nm。当不同质量浓度抗体参与免疫磁珠的制备,抗体质量浓度越高共价偶联于磁珠表面的抗体也逐渐增多(见图1),说明磁珠抗体质量比为100∶2时,并未达到磁珠的最大抗体偶联量,此时偶联于300 nm磁珠上的抗体量比1μm磁珠多31%。因为亚微米级免疫磁珠粒径较小,比微米级免疫磁珠有较大的比表面积,所以能偶联较多的抗体,也意味着有更大的概率与目标菌表面抗原结合。检测这2种粒径的免疫磁珠对1×102~1×108CFU/mL沙门氏菌的捕获情况也验证了上述推测,300 nm免疫磁珠对各细菌浓度沙门氏菌的捕获率都较高(见图2)。然而,由于磁珠表面固定了大量抗体,与非目标菌可能发生交叉反应,而且免疫磁珠自身带有一定量的静电荷,能物理吸附少量细菌菌体,因此免疫磁珠对非目标菌也能有一定的捕获率。研究粒径对免疫磁珠特异性以及杂菌干扰下捕获效率的影响,结果显示,2种免疫磁珠对大肠杆菌O157:H7的捕获率均小于8%,对免疫磁珠捕获沙门氏菌的效率影响不大,所以依然是小粒径免疫磁珠拥有较高捕获率。但由于金黄色葡萄球菌细胞壁中的蛋白A能与抗体IgG的Fc片段结合[30],导致能特异性结合目标菌的免疫磁珠相对减少,所以金黄色葡萄球菌的存在使免疫磁珠对沙门氏菌的捕获率降低了。因为相同质量的亚微米级免疫磁珠比微米级免疫磁珠偶联的抗体更多,颗粒数更多,所以对目标菌的捕获率受杂菌的影响较小(300 nm:66%,1μm:29%),但其对杂菌的捕获率也相对较高(见图3)。此外,由于300 nm免疫磁珠粒径小,在与大体积目标菌(>1μm)免疫反应过程中具有一定的空间优势与灵活性,通过扫描电子显微镜对300 nm、1μm免疫磁珠形态特征及其与沙门氏菌免疫捕获反应情况进行表征(见图4)可以看出。总之,粒径较小的亚微米免疫磁珠因抗体偶联量多,有助于目标菌的特异性捕获。

图1 流式细胞术表征300 nm、1μm免疫磁珠表面抗体Fig.1 Characterize of antibody on 300 nm,1μm IMBs by flow cytometry
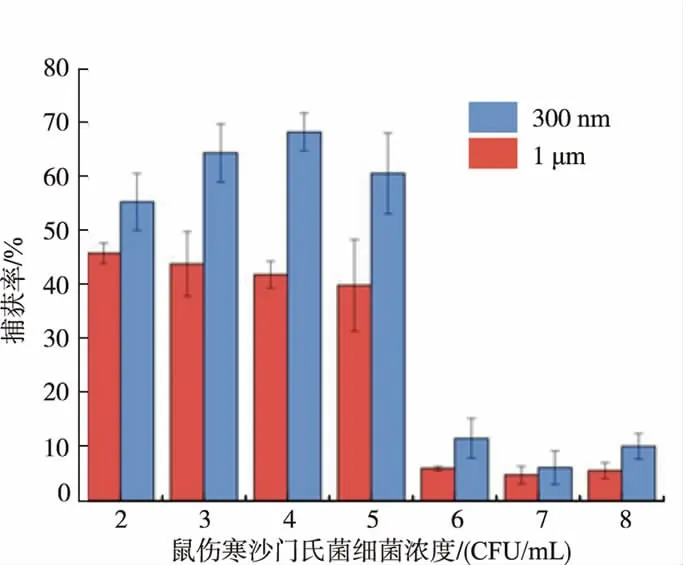
图2 300 nm、1μm免疫磁珠在1 mL PBST中对鼠伤寒沙门氏菌的捕获率Fig.2 Capturing efficiency of 300 nm and 1μm IMBs for Salmonella Typhimurium in 1 mL PBST
2.2 粒径对免疫磁珠磁回收性能的影响
采用分光光度计测量300 nm免疫磁珠和1μm免疫磁珠分别在410 nm与600 nm波长处的吸光度值定量免疫磁珠的浓度,以计算出在PBST溶液和牛奶中经过不同时间磁分离后的免疫磁珠的回收率。结果显示:在1 mL缓冲液中,磁分离1.5 min后,300 nm和1μm免疫磁珠磁回收率都达到95%以上(见图5)。而大体积、复杂基质延迟了免疫磁珠的磁回收时间,且2种免疫磁珠的磁回收率都降低到64%以下,1μm免疫磁珠的磁回收率要高于300 nm免疫磁珠(300 nm:52%,1μm:64%,见图6)。因为免疫磁珠粒径越大体积越大,磁含量也越多。牛奶有一定黏度,且含有大量的脂肪[31],影响了免疫磁珠在磁场中的迁移,尤其是磁含量低的亚微米级免疫磁珠不能进行有效的磁分离。
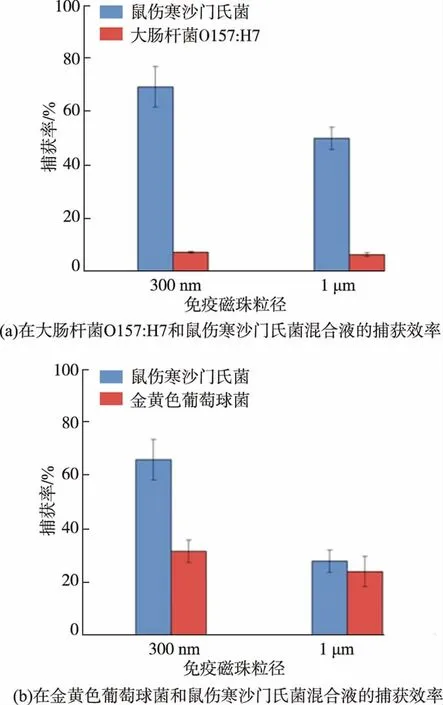
图3 300 nm、1μm免疫磁珠的特异性Fig.3 Specificity of 300 nm IMBs and 1μm IMBs

图4 免疫磁珠与目标菌结合状态扫描电镜图Fig.4 Scanning electron microscopy of IMBs with Salmonella Typhimurium

图5 300 nm和1μm免疫磁珠在1 mL PBST中磁回收率Fig.5 Recovery rate of 300 nm and 1μm IMBs in 1 mL PBST

图6 300 nm和1μm免疫磁珠在25 mL牛奶基质中的磁回收率Fig.6 Recovery rate of 300 nm and 1μm IMBs in 25 mL milk
2.3 粒径对免疫磁珠在不同体系中捕获效率的影响
基于国标方法中捕获体积(1 mL)[11]、采样体积(25 mL)[32]的规定,并参考以往研究[33],本研究设计了3个免疫捕获体系体积(1、10、25 mL),以考察粒径对免疫磁珠在不同体积液体中的捕获率(见图7)。结果显示,300 nm和1μm免疫磁珠随着免疫捕获体积的增大,捕获率均呈现下降趋势,其中,1 μm免疫磁珠下降趋势更显著。在无杂质背景溶液(PBST)中,捕获体积逐渐增大,免疫磁珠与目标菌的有效碰撞次数减少是捕获率下降的主要原因,由于相同质量免疫磁珠粒径越小,个数越多,偶联抗体自由度越大,相对在较大捕获体积情况下表现出较高的目标菌捕获率[34-35]。

图7 300 nm和1μm免疫磁珠在不同体积PBST中的捕获效率Fig.7 Capture efficiency of 300 nm and 1μm IMBs in PBST with different volumes
考察了2种免疫磁珠在牛奶基质中的捕获率,结果表明,2种免疫磁珠的目标菌捕获率均降低到50%以下,1 mL牛奶中300 nm免疫磁珠捕获率较高,而25 mL牛奶中,1μm免疫磁珠捕获率较高(见图8)。牛奶中含有丰富的蛋白质成分[36-37],在一定程度上会干扰免疫磁珠表面抗体的特异性免疫反应[31]。微米级免疫磁珠表现出了较好的磁回收率,所以有较好的免疫捕获表现。因此,复杂基质,特别是有一定黏度的大体积基质,应该选择微米级免疫磁珠。
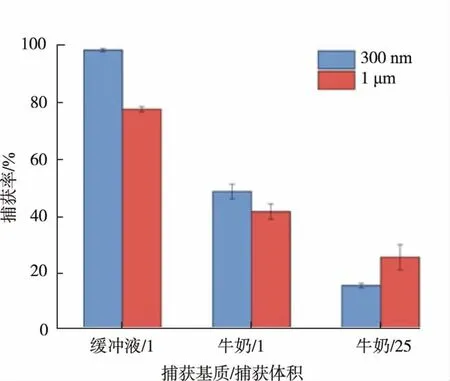
图8 300 nm和1μm免疫磁珠在不同捕获体系中的捕获效率Fig.8 Capture efficiency of 300 nm and 1μm IMBs in different liquids
3 结语
本文中以沙门氏菌为代表,研究免疫磁珠不同粒径对食源性致病菌捕获效率的影响。免疫磁珠由一定量特异性抗体通过化学偶联在超顺磁性颗粒表面而形成,其表现出的抗原结合能力和磁响应性能决定了免疫磁珠的捕获率。因此,作者在采用相同的抗体包被的前提下,以抗体偶联量及磁回收率为主要考察因素,研究在不同基质、不同体积捕获体系中微米级和亚微米级免疫磁珠的捕获效率。采用流式细胞仪直接测定免疫磁珠表面偶联抗体的情况,不仅避免了间接检测方法中偶联液和磁珠活化液的干扰,还能消除因抗体种类不同而产生的检测误差,方便对不同抗体免疫磁珠的比较,也可以直观地展示免疫磁珠抗体偶联量的分布情况。本文中,采用分光光度计测量免疫磁珠的浓度进而计算磁回收率,该方法简单快速也较为准确。由于免疫磁珠的比表面积与粒径成反比,所以亚微米免疫磁珠能固定较多的抗体,而且在简单基质(如缓冲液)中磁回收率也较高,因此对目标菌的免疫捕获率更高,但同时对能产生交叉反应的杂菌的捕获率也更高。然而,在基质复杂的牛奶样品中,受样品中各成分的干扰,免疫磁珠在磁场中迁移的阻力增加,其中,微米级免疫磁珠中磁含量相对较高,磁回收率相对较高,从而表现出高于亚微米级免疫磁珠的捕获率。在实际样本中进行食源性致病菌的免疫磁分离时,简单基质可以选择亚微米级免疫磁珠,有一定黏度的复杂基质,特别是大体积,应选择微米级免疫磁珠。作者着重研究了不同粒径的免疫磁珠对捕获效率的影响,此外,磁珠的带电性、抗体的特异性等因素同样对捕获效率产生重要影响,我们会在今后逐步开展相关研究。

