浅析“互斥理论”与“杂化理论”
四川 王梦林
《物质结构与性质》作为选修模块,在全国卷中占据了15分的大分值,问题一般会按照教材顺序进行设置:原子结构与性质、分子结构与性质、晶体结构与性质。本文主要针对分子结构与性质中的价层电子对互斥理论和杂化轨道理论进行分析和说明。
一、考频分析
全国卷近三年价层电子对互斥理论和杂化轨道理论的考查频率如表中所示:
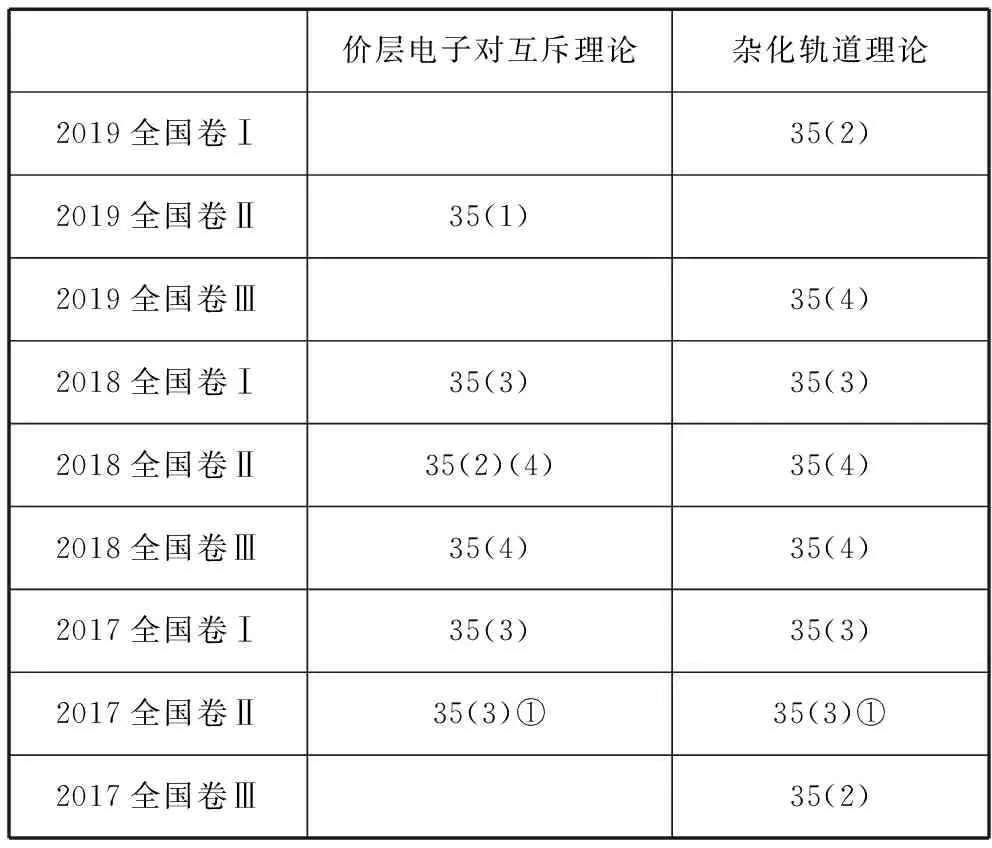
价层电子对互斥理论杂化轨道理论2019全国卷Ⅰ35(2)2019全国卷Ⅱ35(1)2019全国卷Ⅲ35(4)2018全国卷Ⅰ35(3)35(3)2018全国卷Ⅱ35(2)(4)35(4)2018全国卷Ⅲ35(4)35(4)2017全国卷Ⅰ35(3)35(3)2017全国卷Ⅱ35(3)①35(3)①2017全国卷Ⅲ35(2)
由表中统计数据可知,2017年至2019年9套全国卷高考题中都至少考查了价层电子对互斥理论或杂化轨道理论中的一个。2017年和2018年6套题目中除了2017年全国卷Ⅲ只考查了杂化轨道理论外,其余5套试卷同时考查了价层电子对互斥理论和杂化轨道理论。由此可见价层电子对互斥理论和杂化轨道理论在高考中的重要性,属于高频考点。
2019年的3套高考题中都只考查其中一个理论的原因又是什么呢?“价层电子对是指分子中的中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对”,这是教材上对价层电子对的解释;“杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对”,这是教材上对杂化轨道作用的说明。不难发现二者的描述很相似,都提及了σ键电子对和孤电子对,所以在判断微粒空间构型或者中心原子的杂化类型时都用到了价层电子对数,故考查的知识存在一定的重复性,于是我们就不难理解2019年全国卷3套试卷都只考查其中一个理论的原因了,这样的考查形式更加合理和精炼。
二、真题评析
(2017·全国卷Ⅰ·35节选)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
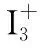
【答案】V形 sp3
【命题意图】
【解析】
☆方法一
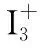
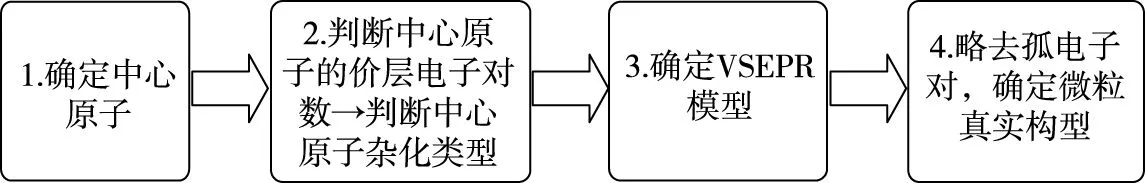
(1)确定中心原子为I原子;
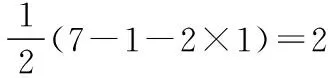
(3)确定VSEPR模型为四面体形;
(4)略去孤电子对,确定微粒的真实空间构型为V形。
根据几何构型的判断步骤中的①②可判断中心I原子的价层电子数对为4,故杂化轨道的数目为4个,根据杂化前后轨道数目不变即可得出“杂化轨道数=参与杂化的轨道数=4”,故I为sp3杂化。
☆方法二
合理运用等电子原理。教材中对等电子原理的描述为“原子总数相同、价电子总数相同的分子(即等电子体)具有相似的化学键特征”,故亦可借用等电子原理判断微粒的空间构型,即互为等电子体的微粒具有相同的空间构型。
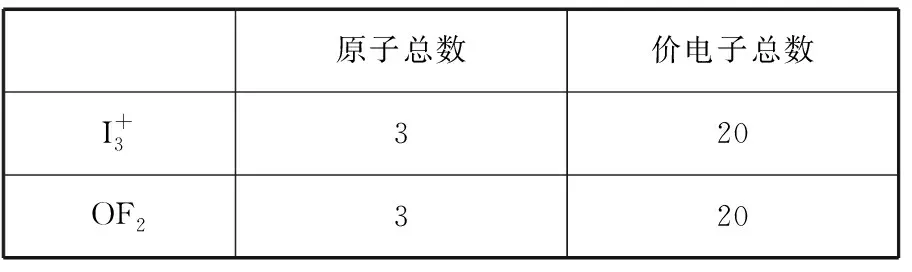
原子总数价电子总数I+3320OF2320
【小结】
高考题在设置问题时根据题干信息创设了新的情景对两个理论进行考查,学生能很好地掌握微粒立体构型和中心原子杂化类型的判断方法,这个考点的得分率相对较高。
三、应考技巧
由于价层电子对互斥理论和杂化轨道理论在知识内容有一定的相似性,故在解题时也有一些相似,解题时可按如下步骤思考:
1.确定微粒的中心原子
一般来说,达到稳定结构时需要电子数多的原子为中心原子。例如HClO中,H原子需要1个电子,Cl原子需要1个电子,O原子需要2个电子,故O原子为中心原子。
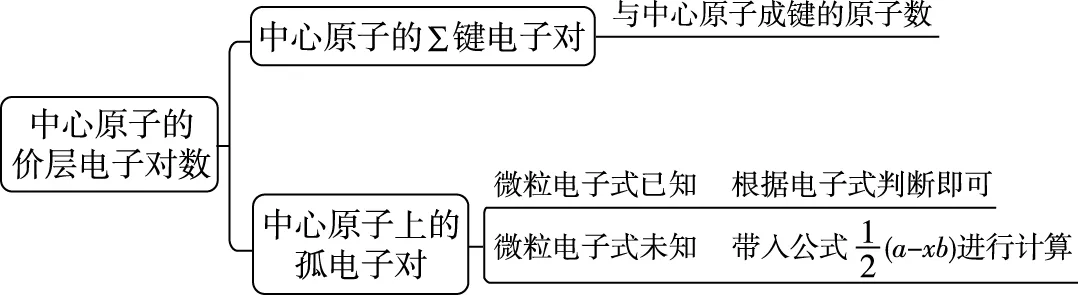
2.计算中心原子上的价层电子对数,确定中心原子的杂化类型
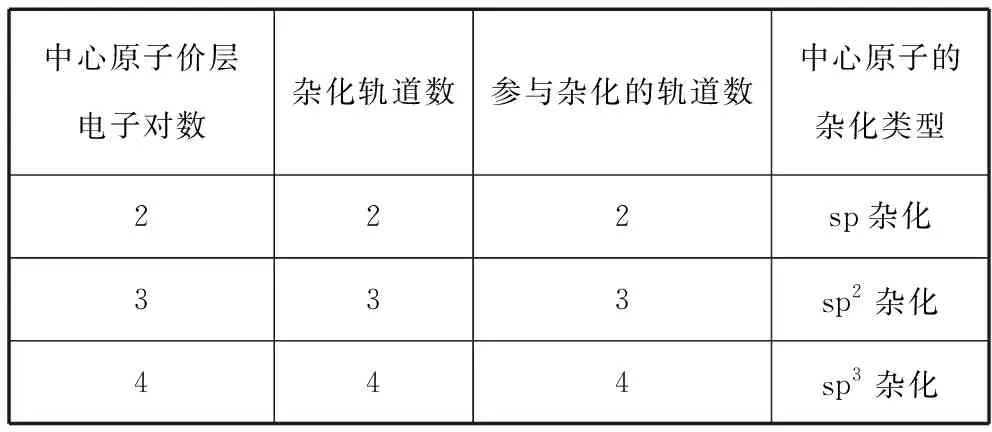
中心原子价层电子对数杂化轨道数参与杂化的轨道数中心原子的杂化类型222sp杂化333sp2杂化444sp3杂化
3.根据价层电子对互斥理论判断VSEPR模型
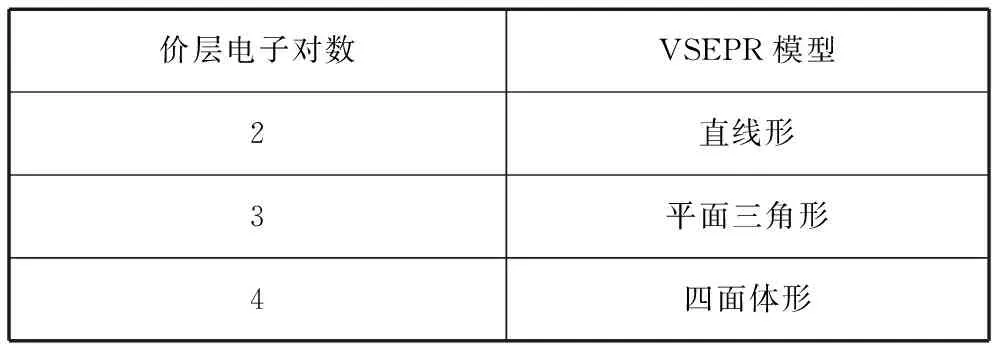
价层电子对数VSEPR模型2直线形3平面三角形4四面体形
4.略去孤电子对,确定微粒的空间构型
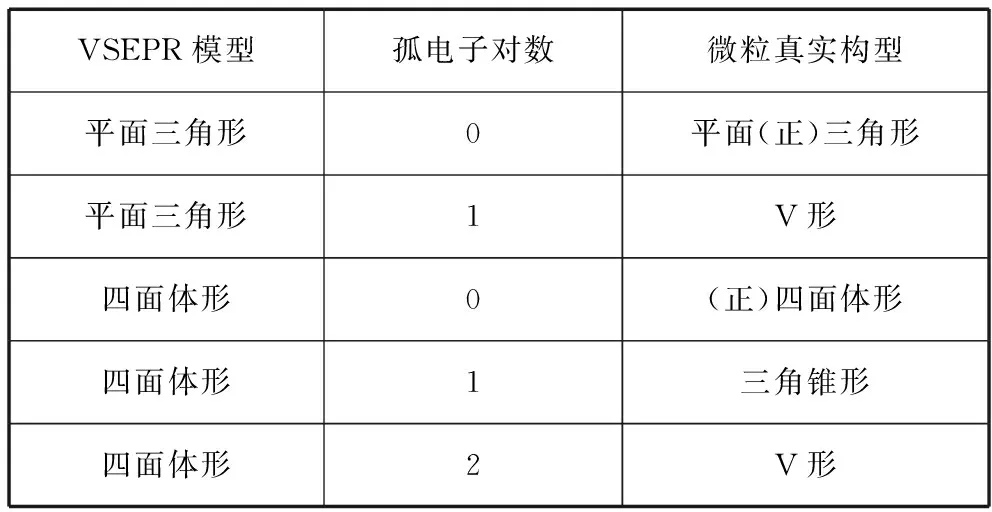
VSEPR模型孤电子对数微粒真实构型平面三角形0平面(正)三角形平面三角形1V形四面体形0(正)四面体形四面体形1三角锥形四面体形2V形
四、选修三《物质结构与性质》新课教学建议
价层电子对互斥理论和杂化轨道理论都十分抽象,如果仅通过机械记忆学生也可以记住而且容易得分,但是学生会逐渐丧失对化学的学习兴趣,因此在新课阶段的教学一定不能仅以做题为目的,我们应运用合理的教学设计让学生在已有知识体系上构建新的知识,让学生学会学习,构建自己的知识体系,脱离枯燥的死记硬背的学习方式。
(一)“价层电子对互斥理论”教学建议
1.拆分概念,化未知为已知
“价层电子对互斥理论”对于学生来说是一个全新的理论,直接给出理论内容学生会较难接受,所以建议先将概念拆分。
(1)概念A——电子互斥,学生了解电子带负电,会相互排斥至排斥力最小的位置;
(2)概念B——电子对互斥,由单个电子变为电子对,学生容易理解;
(3)概念C——价层电子对,此概念明确了电子对的来源,即为σ键电子对和孤电子对。
2.构建模型,化抽象为形象
实验时使用球棍模型,大球代表中心原子,一个黑色小球代表一对σ键电子,一个橙色小球代表一对孤电子,金属棒用于固定大球和小球的相对位置。
3.实际操作,化理论为实践
设定价层电子对为2对、3对和4对,学生可自由选择小球的颜色,学生自主思考并找到价层电子对排斥力最小的相对位置,再用金属棒将大球与小球固定,确定VSEPR模型;然后将橙色小球去除,确定微粒的最终构型。
如此一来,学生自己体会了价层电子对互斥理论的演示过程,对于原理和方法都有了很深的印象,有助于学生更好地理解,也可增强学生的学习兴趣,更强化了化学学科的实验动手能力,一举多得。
4.合理引导,化疑问为思考
学生在学习价层电子对互斥理论时,会有一个共同的问题:“为什么只考虑σ键电子对不考虑π键电子对?”此时我们只需要设置一个问题“π键在什么情况下才会形成?”,这个问题引导学生进行主动思考,进而得到自己想要的答案。
(二)“杂化轨道理论”教学建议
在杂化轨道理论教学过程中,教师必须引导学生明确几个问题:
1.为什么要提出杂化轨道理论?
杂化轨道理论的提出源于之前所学的价键轨道理论和价层电子对互斥理论形成的矛盾。
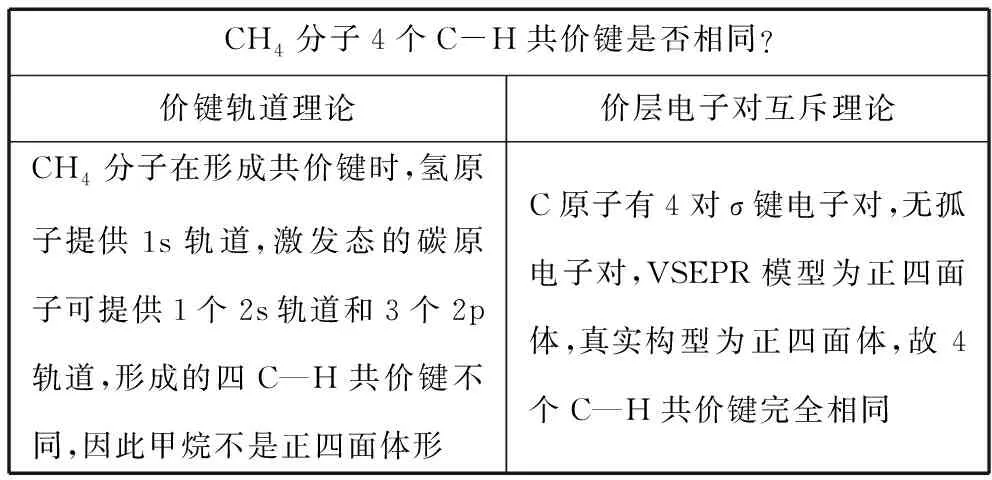
CH4分子4个C-H共价键是否相同?价键轨道理论价层电子对互斥理论CH4分子在形成共价键时,氢原子提供1s轨道,激发态的碳原子可提供1个2s轨道和3个2p轨道,形成的四C—H共价键不同,因此甲烷不是正四面体形C原子有4对σ键电子对,无孤电子对,VSEPR模型为正四面体,真实构型为正四面体,故4个C—H共价键完全相同
现有理论出现矛盾时,杂化轨道理论可以起到“缓和矛盾”、解释特殊的作用,由此让学生体会到科学是在不断发展和进步的,有利于培养学生严谨治学的科学态度,提升学生探究和创新的素养。
2.什么是杂化?怎么杂化?
教材上对杂化的描述是“当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角为109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的”。建议在描述杂化轨道时可引入“均分”的思想,即可将描述转化为一定数目的能量相近的原子轨道混合后均分为数目相同的新轨道,由于轨道是用来填充电子的,所以新轨道之间也存在互斥原理,这样学生也更好地理解了教材之后提及的杂化轨道的形状。
3.中心原子的杂化类型如何判断?
教材中提及“杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对”,这句话就是判断中心原子杂化类型的基础:

4.中心原子是否必须杂化?
必须明确的是高中阶段接触的杂化轨道理论主要是为了解释价键轨道理论和价层电子对互斥理论在微粒构型判断上产生的矛盾,但是并不是所有微粒的构型都需要用杂化轨道理论来解释:
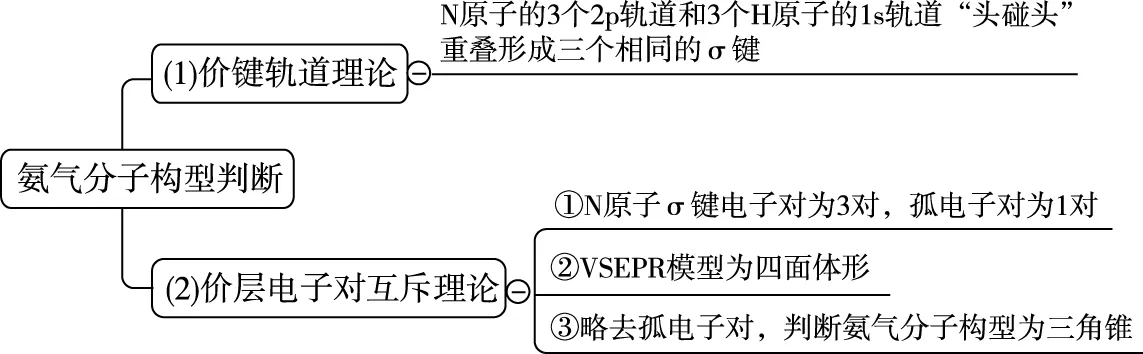
综上,可通过价层电子对互斥理论判断构型的微粒,其中心原子都可以运用杂化轨道理论来判断杂化类型,而有些分子的构型仅用价键轨道理论即可解释。
五、高三备考及命题建议
此部分内容比较简单,在进行备考复习时,只需要将价层电子对互斥理论和杂化轨道理论内容简要叙述,即可进行适当的课堂练习,引导学生总结归纳判断微粒空间构型和中心原子杂化类型的判断方法:
教师可收集与新型冠状病毒肺炎有关信息营造题目情境,通过给定结构考查特定原子的杂化类型,例如:
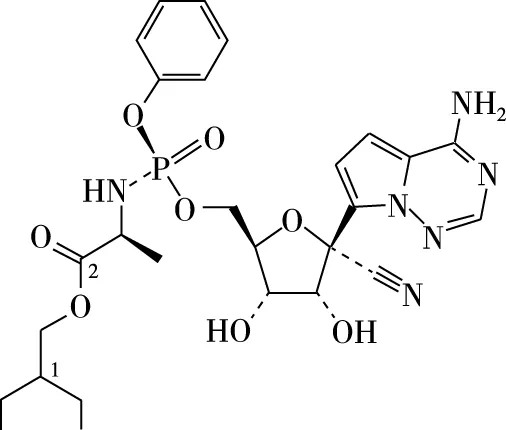
Remdesivir(瑞德西韦)是一种核苷类似物,具有抗病毒活性,其结构如图,结构中标号为1和2的碳原子的杂化类型为________。
【答案】sp3杂化 sp2杂化


