PKC介导P38MAPK通路调控结直肠癌细胞MMP-9表达及侵袭的研究
姜媛 谢海娟 王毓兴
[摘要] 目的 研究MAPK信号通路对结直肠癌SW480细胞MMP-9表达及细胞侵袭作用的影响。 方法 观察蛋白激酶C激活剂TPA诱导下SW480细胞形态学的改变;蛋白免疫印迹法检测MMP-9、P38MAPK蛋白的表达,zymography法检测MMP-9蛋白的分泌,利用Transwell实验观察细胞侵袭能力。 结果 显微镜下观察,随着TPA浓度的升高,细胞形态逐渐改变成针尖样;蛋白免疫印迹法显示,TPA处理下P38磷酸化增加,MMP-9蛋白表达和分泌增加,呈时间依赖性;并且肿瘤细胞侵袭能力随之增强;而通过预处理PKC抑制剂和P38抑制剂,可明显抑制TPA诱导的MMP-9表达和细胞侵袭能力。 结论 在结直肠癌SW480细胞中PKC激动剂TPA通过激活P38 MAPK信号通路调控MMP-9表达及细胞侵袭,为阻止结直肠癌侵袭转移研究提出多方位的作用靶点和新思路。
[关键词] 基质金属蛋白-9;促分裂原活化蛋白激酶P38;细胞侵袭;蛋白激酶C;结直肠癌
[中图分类号] R735.35 [文献标识码] A [文章编号] 1673-9701(2020)26-0004-04
[Abstract] Objective To study the effect of MAPK signaling pathway on the MMP-9 expression and cell invasion in colorectal cancer SW480 cells. Methods The morphological changes of SW480 cells induced by TPA, the activator of protein kinase C(PKC), were observed. Western blot method was adopted to detect the expression of MMP-9 and P38MAPK protein. Zymography was used to detect the secretion of MMP-9 protein. Transwell experiment was performed for the observation of cell invasion ability. Results Under microscope, with the increase of TPA concentration, the cell morphology gradually changed into pinpoint shape. Western blot method showed that after TPA treatment, the phosphorylation of P38 and the expression and secretion of MMP-9 protein increased in a time-dependent manner, and the tumor cell invasion ability was enhanced. However, the pretreatment of PKC inhibitor and P38 inhibitor can obviously inhibit the MMP-9 expression and cell invasion ability induced by TPA. Conclusion TPA, a PKC agonist, regulates and controls the MMP-9 expression and cell invasion through activating P38MAPK signaling pathway in colorectal cancer SW480 cells, which provides multi-directional targets and new ideas for the research on preventing the invasion and metastasis of colorectal cancer.
[Key words] Matrix metalloproteinase-9; P38 mitogen-activated protein kinase; Cell invasion; Protein kinase C; Colorectal cancer
結直肠癌(Colorectal cancer,CRC)约占全球所有新发癌症病例的10%,也是我国最常见的消化道恶性肿瘤之一,15%~25%的CRC患者在初诊时已发生远处转移[1,2]。细胞侵袭是肿瘤转移过程的前提条件,是肿瘤患者治疗失败和致死的关键因素,肿瘤侵袭相关研究一直是结直肠癌研究的焦点。基质金属蛋白酶(MMPs)是肿瘤浸润转移过程中的启动因子,降解基底膜、细胞外基质等,促进肿瘤细胞向周围组织浸润、最终导致远处转移[3]。MMP-9是MMPs家族中的重要成员,它参与多种人类肿瘤的发展,通过基底膜和细胞外基质的降解促进肿瘤进展,包括侵袭、转移、生长和血管生成[4]。国外报道证实结直肠癌患者MMP-9表达水平与预后密切相关[5]。蛋白激酶C(PKC)是调控细胞增殖、凋亡和迁移等多种过程的主要信号因子。有报道显示,PKC与结直肠癌侵袭密切相关[6,7]。PKC激活剂TPA已被公认为肿瘤促进剂,也是MMPs的强激活剂,可促进乳腺癌细胞侵袭中MMP-9合成和分泌[8]。因此,抑制MMPs被认为是降低肿瘤细胞侵袭潜力的新策略。本研究旨在探讨MAPK信号通路对结直肠癌细胞PKC/MMP-9表达和细胞侵袭的作用,为进一步了解结直肠癌侵袭迁移提供多方位的分子位点,现报道如下。
1 材料与方法
1.1 材料来源
人结直肠癌SW480细胞株(中科院上海细胞库),RPMI-1640培养基(Gibco公司);胎牛血清(Hyclone公司);TPA、GF109203X、SB203580(Sigma公司);Bradford蛋白浓度测定试剂盒、ECL试剂盒(北京索莱宝公司);anti-p38、anti-p-p38、anti-β-actin(Abcam公司);anti-MMP-9、HRP标记IgG(Santa Cruz公司);Transwell侵袭系统(costor公司)。
1.2 方法
1.2.1 细胞培养 人结直肠癌细胞株SW480细胞使用10%胎牛血清(FBS)和1%抗生素的RPMI-1640培养基,在5%CO2、37℃培养箱中培养,当细胞生长至80%~90%时进行传代培养。
1.2.2 细胞形态学观察 取对数生长期SW480细胞,按所需浓度接种于6孔板中,待细胞长至50%~60%愈合后,更换新鲜培养基,给予不同浓度(0、20、50、100 nM)TPA处理24 h后,在倒置显微镜下观察细胞形态学变化。
1.2.3 蛋白印迹法检测蛋白表达 根据研究目的,100 nM TPA处理0、0.5、1、3、6、12、24 h,或用1 μM GF109203X、20 μM SB203580预处理SW480细胞1 h,然后与100 nM TPA共孵育24 h。用冰冷的蛋白提取液裂解细胞,用Bradford法测定裂解液中的蛋白质浓度。每组30 μg蛋白与2×SDS加样缓冲液混匀制备成上样液,进行SDS-PAGE电泳分离蛋白,并转移到PVDF膜上,用5%脱脂牛奶封闭2 h,然后在4℃下与1∶2000稀释的一抗孵育过夜,洗膜5次,以1∶2000稀释的HRP-IgG二抗常温孵育2 h,洗膜,用ECL试剂盒显色,用图像分析仪通过信号分析确定蛋白表达水平。
1.2.4 明胶酶谱法检测MMP-9的活性 使用无FBS的培养基进行处理,用1 μM GF109203X、20 μM SB203580预处理SW480细胞1 h,然后与100 nM TPA孵育24 h。经24 h处理后收集培养基,与非还原样品缓冲液混合,在含有0.1%明胶的聚丙烯酰胺凝胶中电泳,用2.5%Triton X-100溶液在室温下洗涤30 min,然后用5 mM CaCl2,0.02% Brij,50 mM Tris-HCl(pH=7.5)溶液在37℃中孵育过夜。用0.25%考马斯亮蓝染色及脱色,并在图像分析仪上拍照。
1.2.5 Transwell检测细胞侵袭能力 利用Transwell侵袭实验检测各实验组对SW480细胞的侵袭作用。侵袭实验在24孔板中进行,用20 μL基质胶涂层。基质胶在培养基中重新水化30 min,各组细胞悬液分别加入上室,条件培养基加入下室孵育24 h。孵育后,用棉签去除腔室上侧的细胞,0.1%甲醇固定细胞并用台盼蓝溶液染色,利用光学显微镜随机5个视野计数侵入细胞。
1.3 觀察指标
观察各组细胞形态学变化、P38MAPK信号通路、MMP-9蛋白表达以及细胞侵袭能力的变化。观察各种抑制剂对TPA诱导MMP-9蛋白表达及分泌的影响。
1.4 统计学方法
采用SPSS16.0统计学软件对实验结果进行分析。计量资料以均数±标准差(x±s)表示,多组数据比较采用单因素方差分析,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TPA对SW480细胞形态学的影响
观察不同浓度(0、20、50、100 nM)PKC激动剂TPA诱导SW480细胞24 h后细胞形态学的变化,如封三图1所示:空白对照细胞之间有紧密联系,具有上皮细胞特点;随着TPA浓度升高SW480细胞失去极性,排列松散,细胞间隙增宽,紧密联接消失,细胞形态逐渐变成针尖状,向类似间质细胞的形态转化。
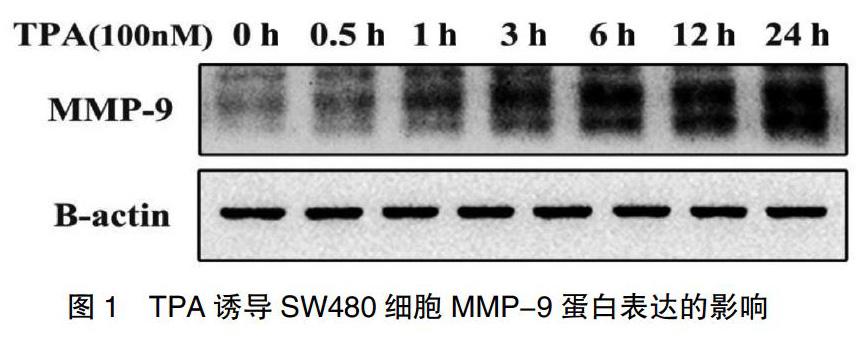
2.2 TPA对MMP-9蛋白表达水平的影响
为了观察TPA对MMP-9蛋白表达水平的影响,利用Western Blot法检测TPA处理0、0.5、1、3、6、12 h和24 h时SW480细胞中MMP-9蛋白表达的水平。如图1所示,发现随着TPA诱导时间的延长,MMP-9蛋白表达逐渐增高,呈时间依赖性,24 h时升高最明显。
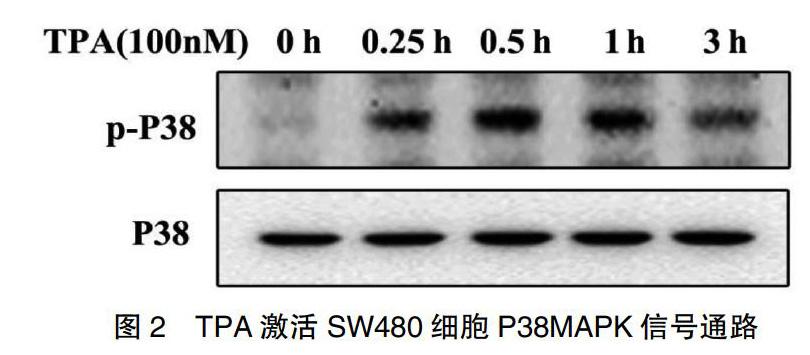
2.3 TPA对P38MAPK信号通路的影响
为了进一步验证TPA诱导MMP-9的信号传导通路,检测TPA诱导0、0.25、0.5、1 h和3 h时P38 MAPK通路激活情况。P38的激活是通过其磷酸化为P-P38来实现的。如图2所示,TPA诱导P-P38蛋白表达水平逐渐增高,0.5 h时P-P38水平升高最显著,提示TPA诱导MMP-9过程中可激活P38MAPK通路。
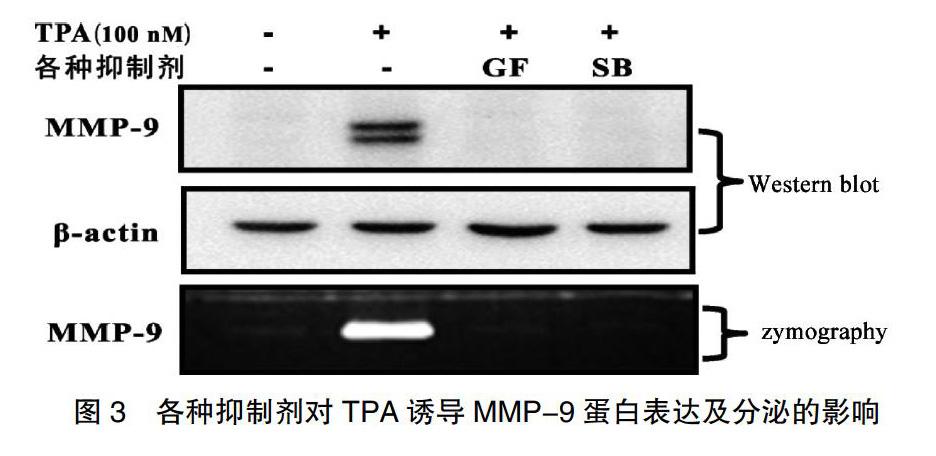
2.4 各种抑制剂对TPA诱导MMP-9蛋白表达及分泌的影响
利用Western Blot法检测MMP-9蛋白表达情况;利用明胶酶谱法检测MMP-9细胞外分泌情况,各实验组细胞MMP-9蛋白表达水平。如图3所示,预处理PKC抑制剂GF109203X、P38抑制剂SB203580后,TPA诱导增加的MMP-9蛋白表达和分泌均被明显抑制,提示TPA激活PKC-P38MAPK通路诱导MMP-9蛋白表达和分泌。
2.5 TPA对SW480细胞侵袭能力的影响
利用Transwell侵袭实验检测TPA对SW480细胞侵袭能力的影响。如封三图2所示,与空白对照组相比,单用TPA后穿过基底膜的细胞数量明显增加,差异有统计学意义(P<0.01);与单用TPA组相比,TPA与PKC抑制剂GF109203X或P38抑制剂SB203580合用后,穿过基底膜的细胞数量明显减少,差异有统计学意义(P<0.01),显示TPA可明显增强SW480细胞的侵袭能力,这种增强均可被PKC抑制剂GF109203X和P38抑制剂SB203580所抑制,再次证明TPA通过PKC-P38MAPK通路诱导SW480细胞MMP-9表达及细胞侵袭的作用。见表1、封三图2。
3 讨论
近年来研究显示PKCs是一种转化癌基因,PKC在肿瘤发生、发展及对抗瘤因子的反应均起到重要作用,可介导肿瘤细胞黏附、运动、侵袭及转移过程[9]。然而,PKC诱导细胞侵袭的机制仍然扑朔迷离。本研究结果显示,TPA通过PKC下游分子P38MAPK信号通路诱导结直肠癌细胞MMP-9表达及细胞侵袭。这些结果显示,在结直肠癌细胞中PKC-P38 MAPK通路参与了MMP-9表达及侵袭过程,为阻止肿瘤侵袭转移提供了可行的理论依据。
恶性肿瘤的浸润和转移过程从降解细胞外基质开始,MMPs通过降解基底膜、细胞外基质等,向周围浸润,并侵袭血管和淋巴管向远处转移,因此患者肿瘤组织中MMPs的含量和肿瘤的侵袭、转移往往密切相关[10]。现已在多种人类肿瘤中检测到MMPs的存在,在人类结肠癌中MMP-2、MMP-7和MMP-9均表达增高[11]。已有研究表明MMP-9与结直肠癌的发生有相关性,且作为结直肠癌的早发事件和影响预后的风险因子,MMP-9表达水平是评估结直肠癌患者复发风险的有效指标[5]。
PKC是蛋白激酶家族中的一个重要成员,参与各种细胞功能的调节,在细胞的增殖、分化、神经递质的运输、释放及肿瘤发生等起重要作用。早期的研究表明PKC能够被具有促肿瘤增殖作用的佛波醇所激活,提示PKC在肿瘤的增殖过程中可能起重要作用,被认为可能是肿瘤治疗中的一个新靶点[9,12]。据报道激活的PKC能够进一步磷酸化P38 MAPK信号通路[13]。
促分裂原活化蛋白激酶(MAPK)是细胞内一类丝氨酸/苏氨酸蛋白激酶,是细胞内主要信息传递途径之一,其包括三大信号通路:P38MAPK信号通路、ERK细胞外信号调节蛋白激酶(ERK)通路及应激活化蛋白激酶(SAPK)/c-Jun氨基末激酶(JNK)信号通路[14]。P38是MAPK家族中的重要成员,是介导细胞反应的重要信号系统。P38信号通路是一種应激反应通路,它可被不同的外部与细胞内刺激所激活,从细胞凋亡至细胞增殖周期,到诱导细胞基因的表达、分化中都有广泛的参与及应答。P38的激活是苏氨酸和酪氨酸残基的特定位置发生双重磷酸化的过程[15-16]。
TPA是PKC的激活剂,作为促癌剂能促进肿瘤的发展[9]。而在分子肿瘤研究中,TPA作为经典促癌剂,其对细胞黏附的能力也有部分相关报道。有研究指出,TPA能在动态和静态环境中增加HT-29细胞的黏附能力[17]。TPA与PKC有高亲和性,一方面TPA可以与PKC稳定的结合,从而下调PKC活性,另一方面TPA可以充分激活PKC,促进癌细胞的侵袭及转移。PKC的激活与结直肠癌侵袭转移高度相关[18]。
本研究结果显示,PKC激动剂TPA可以诱导SW480细胞向类似间质细胞的形态转化,为结直肠癌细胞侵袭提供启动因子。随之,发现TPA时间依赖性诱导MMP-9蛋白表达增高,并且预处理PKC抑制剂可明显阻滞TPA诱导的MMP-9表达及分泌,说明激活PKC可诱导结直肠癌细胞MMP-9蛋白的表达。进一步检测TPA对PKC下游信号P38MAPK的作用,发现TPA激活PKC可诱导下游P38被磷酸化,说明激活PKC可诱导下游P38信号通路的激活;为再次证明P38 MAPK信号通路对MMP-9的调控作用,利用P38抑制剂预处理,发现PKC激活诱导的MMP-9蛋白表达可被P38抑制剂所明显抑制。发现激活PKC可诱导结直肠癌细胞的侵袭能力增强,而这种增强可被PKC抑制剂和P38抑制剂所抑制,再一次证实了PKC诱导的结直肠癌细胞MMP-9表达及侵袭过程是介导P38MAPK通路来完成。
综上所述,PKC可能是诱导结直肠癌侵袭的一个因子,初步探索了PKC诱导MMP-9蛋白表达的信号通路。PKC-P38-MMP-9可能是PKC诱导结直肠癌细胞侵袭的重要信号传导通路之一,可能会为结直肠癌治疗提供新的分子靶点。
[参考文献]
[1] LGvdG,J LB,M K,et al. Nationwide trends in incidence,treatment and survival of colorectal cancer patients with synchronous metastases[J]. Clinical & Experimental Metastasis,2015,32(5):457-465.
[2] Wong SH,Yu J. Gut microbiota in colorectal cancer:Mechanisms of action and clinical applications[J]. Nat Rev Gastroenterol Hepatol,2019,16(11):690-704.
[3] Kapoor C,Vaidya S,Wadhwan V,et al. Seesaw of matrix metalloproteinases(MMPs)[J]. J Cancer Res Ther,2016, 12(1):28-35.
[4] SM,NA,SB,et al. Matrix metalloproteinase-9(MMP-9) and its inhibitors in cancer:A minireview[J]. European Journal of Medicinal Chemistry,2020,194:112260.
[5] Wang W,Li D,Xiang L,et al. TIMP-2 inhibits metastasis and predicts prognosis of colorectal cancer via regulating MMP-9[J]. Cell Adh Migr,2019,13(1):273-284.
[6] Islam SMA,Patel R,Bommareddy RR,et al. The modulation of actin dynamics via atypical protein kinase-C activated cofilin regulates metastasis of colorectal cancer cells[J]. Cell Adh Migr,2019,13(1):106-120.
[7] Qureshi-Baig K,Kuhn D,Viry E,et al. Hypoxia-induced autophagy drives colorectal cancer initiation and progression by activating the PRKC/PKC-EZR(ezrin) pathway[J]. Autophagy,2019,16(8):1-17.
[8] Jang HY,Hong OY,Youn HJ,et al. 15d-PGJ2 inhibits NF-κB and AP-1-mediated MMP-9 expression and invasion of breast cancer cell by means of a heme oxygenase-1-dependent mechanism[J]. BMB Rep,2020,53(4):212-217.
[9] Isakov N. Protein kinase C(PKC) isoforms in cancer,tumor promotion and tumor suppression[J]. Semin Cancer Biol,2018,48:36-52.
[10] Alaseem A,Alhazzani K,Dondapati P,et al. Matrix metalloproteinases:A challenging paradigm of cancer management[J]. Semin Cancer Biol,2019,56:100-115.
[11] Tao L,Zhu Y,Gu Y,et al. ARHGAP25: A negative regulator of colorectal cancer(CRC) metastasis via the Wnt/β-catenin pathway[J]. Eur J Pharmacol,2019,858:172476.
[12] Marquardt B,Frith D,Stabel S. Signalling from TPA to MAP kinase requires protein kinase C,raf and MEK:Reconstitution of the signalling pathway in vitro[J]. Oncogene,1994,9(11):3213-3218.
[13] Cardoso VG,Gonalves GL,Costa-Pessoa JM,et al. Angiotensin II-induced podocyte apoptosis is mediated by endoplasmic reticulum stress/PKC-δ/p38 MAPK pathway activation and trough increased Na(+)/H(+) exchanger isoform 1 activity[J]. BMC Nephrol,2018,19(1):179.
[14] Yue J,López JM. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci,2020,21(7):2346.
[15] Ewendt F,Fller M. P38MAPK controls fibroblast growth factor 23(FGF23) synthesis in UMR106-osteoblast-like cells and in IDG-SW3 osteocytes[J]. J Endocrinol Invest,2019,42(12):1477-1483.
[16] Martínez-Limón A,Joaquin M,Caballero M,et al. The p38 pathway:From biology to cancer therapy[J]. Int J Mol Sci,2020,21(6):1913.
[17] Banskota S,Dahal S,Kwon E,et al. β-catenin gene promoter hypermethylation by reactive oxygen species correlates with the migratory and invasive potentials of colon cancer cells[J]. Cell Oncol(Dordr),2018,41(5):569-580.
[18] Shelton PM,Duran A,Nakanishi Y,et al. The secretion of miR-200s by a PKCζ/ADAR2 signaling axis promotes liver metastasis in colorectal cancer[J]. Cell Rep,2018,23(4):1178-1191.
(收稿日期:2020-06-12)

