液质联用方法研究伊马替尼药代动力学及生物等效性综述
李宏霞,段小群,李婷
(1.桂林医学院,广西 桂林;2.桂林医学院附属医院,广西 桂林)
0 引言
伊马替尼(Imatinib)是一种酪氨酸激酶抑制剂,可以特异性地作用于BCR-ABL 酪氨酸激酶,是CML 的一线治疗药物,也可用于胃肠道基质瘤(GIST )的治疗。
甲磺酸伊马替尼,化学名:4-[(4- 甲基-1- 哌嗪)甲基]-N-[4- 甲基-3-[[4-(3- 吡啶)-2- 嘧啶] 氨基] 苯基]苯甲酰胺甲磺酸盐。分子式与分子量:C29H31N7O·CH4SO3;589.7。甲磺酸伊马替尼原料药为白色至淡黄色结晶性粉末;无臭;本品在水中易溶,在甲醇中溶解,在异丙醇中几乎不溶,在0.1mol/L 的盐酸溶液中易溶;pH4.5-6.0;本品的熔点为220~226℃[1]。
1 色谱条件及质谱条件
现今液质联用广泛用于测定血浆中药物浓度,考虑其具有高效分离、高选择性、高灵敏性,故用来伊马替尼定量分析。文献报道中主要常用的LC-MS/MS 仪器来源有Agilent、Waters、AB Sciex、SHIMADZU。

图1 甲磺酸伊马替尼化学结构式
表1、表2 是本综述总结的相关研究中液质联用的主要信息。通过整合以下文献中的信息可初步确定主要的液相条件和质谱条件。质谱条件:MRM,ESI+,离子对大致是494 →394。 液 相 条 件:色 谱 柱,ZORBAX SB C18(4.6 mm×150 mm,3.5μm);流动相B,乙腈,流动相A:0.1%甲酸&5mM 乙酸铵水溶液;流速1.0 mL-min-1;柱温40℃。

表1 研究中的质谱条件
2 标准品和内标
从可追溯的来源获得标准品。标准品应带有分析证书(Certificate of Analysis)包括纯度,储存条件、失效日期和批号等。LC-MS/MS 生物分析要使用内标应尽可能使用稳定同位素标记的内标。在最近几年的文献中多采用氘代化合物作为内标。因此推荐采用伊马替尼-D8 作为内标。
3 采样点的选择

表2 研究中的色谱条件
甲磺酸伊马替尼在空腹给药后大约2-4h 内达到血浆峰浓度,食物对吸收影响的研究显示,与空腹时比较,高脂饮食后伊马替尼吸收率轻微降低(Cmax 减少11%,tmax 延后1.5h)[2]。考虑高脂餐的影响,伊马替尼可在清淡饮食后给药。
根据《化学药物临床药代动力学研究技术指导原则》(2005)要求,一个完整的血药浓度-时间曲线,应包括药物各时相的采血点,即采样点应包括给药后的吸收相,峰浓度附近和消除相。一般在吸收相至少需要2~3 个采血点,峰浓度附近至少需要3 个采血点,消除相至少需要3~5 个采血点,总共一般不少于11~12 个采血点。根据《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(2016),建议每个周期采样12~18 个采血点,采样时间不短于3 个消除半衰期。
伊马替尼的消除半衰期约为18 h,取样时间点可以以伊马替尼原型药物半衰期计算,以3~5 个半衰期为宜[5]。伊马替尼空腹给药后大约2-4h 内达到血浆峰浓度,餐后给药延后约1.5h,宜在给药2~5.5h 密集采点。
根据其文献报道伊马替尼给药后72h 血药浓度仍在可测标曲范围内,因此采样结束时间宜设置在给药后72h。综合以上药代动力学参数及查阅参考文献可设计采血点如下:每周期于给药前(0h,服药前1.0h 内)和给药后0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h、4.5h、5.0h、5.5h、6.0h、7.0h、8.0h、12.0h、24.0h、36h、48h、72h,共20 个时间点采集静脉血约4mL。
根据原研产品数据,伊马替尼的消除半衰期约为18 h,其活性代谢产物半衰期约为40h,七天内约可排泄所给药物剂量的81%,为避免前一周期的携带效应,清洗期宜为设为10~14d。
4 前处理及进样分析
在目前报道的前处理方法中蛋白沉淀法是LC-MS 最常使用的方法之一,其中又最常用有机溶剂沉淀法,可使结合型的药物释放,减少乳化,保护仪器性能。甲醇和乙腈是最常用的沉淀剂,其中乙腈的沉淀更致密,沉淀更完全。推荐沉淀剂体积比例:含药物的血浆与甲醇的体积比大于1:3,含药物的血浆与乙腈的体积比大于1:2。推荐离心转速:大于10000rpm/min。
前处理中的溶剂体系尽量与流动相保持一致,变换不同的有机试剂进行以及不同的蛋白沉淀比例,进行前处理;采用相应的有机试剂作为流动相进样分析,确定药物是否从结合物中释放,以及化合物峰分离以及响应情况,推断是否测定出药物总浓度;由基质响应确定是否通过前处理将样品纯化、富集并消除基质干扰。
5 标准曲线范围
定量下限是标准曲线的最低点,是能够被可靠定量的样本中伊马替尼的最低浓度,具有可接受的准确度和精密度,应适用于预期的浓度和试验目的。标准曲线浓度范围应尽量覆盖预期浓度范围。如果临床试验单次给药药量为100mg,则可将标曲范围初步定为5~1500 ng·mL-1。
在根据实际给药总量和参考表3 及其他相关研究后确定标曲范围,然后进行验证,具体的按照《中国药典》2015年版第四部附录9012《生物样本定量分析方法验证指导原则》中的要求进行确证。
6 数据处理
现在的药代动力学/生物等效性研究中主要将数据通过WinNonLin 等进行药代动力学参数计算。如Cmax/ng·L-1、t1/2/h、tmax/h、AUC0-72h/ng·h·L-1、AUC0-∞/ng·h·L-1。
由非房室模型计算各受试者的药代参数。同时用Excel计算各参数的算术均数、标准差、变异系数、中位数、最小值、最大值和几何均数。主要药代参数(Cmax、AUC)经对数转换后进行方差分析(ANOVA),计算两药主要药代参数的几何平均值比值的90%置信区间,并进行等效性比较,等效区间设定为80.00%~125.00%。
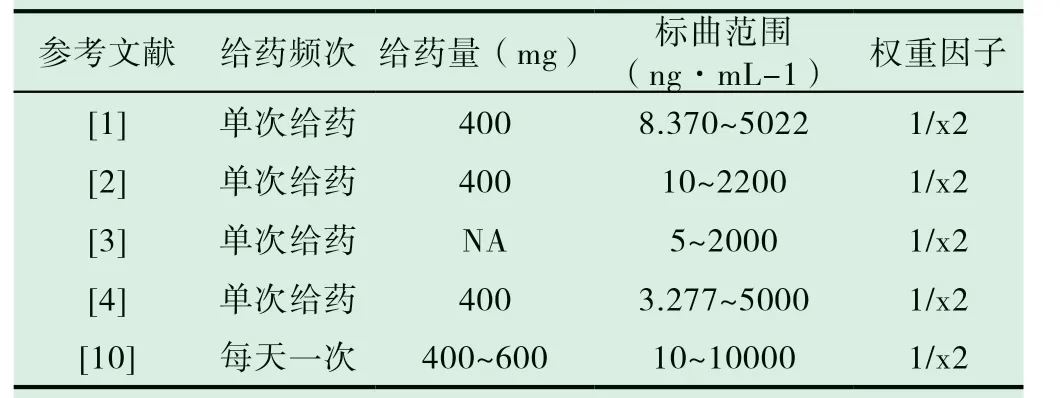
表3 研究中的标曲范围
7 总结
通过以上文献等其他资料,可获得目前伊马替尼的母离子质荷比、主要子离子质荷比、极性、离子化方式、分子式、结构式、溶解度等详细信息,进行方法开发。可利用针泵进样,通过MRM 优化化合物参数,或手动优化,选择合适的MS 方法;通过LC-MRM,进行色谱条件优化,选择合适的LC-MS方法;最后选择合理的前处理方法进行样品配制。
初步确定方法后,进行方法学验证,验证项目:选择性、标准曲线、定量下限、精密度、准确度、提取回收率、基质效应、稳定性、系统残留和稀释可靠性。
临床试验采样点的确定主要考虑药物达峰时间和药物半衰期,也需要考虑食物的影响。将通过合理的临床试验采样后的血样前处理后进样分析,最后将数据通过Excel、WinNonLin 等进行处理。最后获得药物的药代动力学特征,判定药物的生物等效性。
8 讨论
一个合理的药代动力学/生物等效性试验或实验方案的设计,主要包括采样计划和生物分析计划,是在大量的文献资料的基础上,综合考虑临床、实验室、药物、仪器等相关因素后建立的。其中伊马替尼的血药浓度检测虽有大量的研究文献支持,但不同的试验或实验对象、不同基础、不同的地点、不同的仪器等的变化,仍然需要具体问题具体分析,方法学验证也应根据具体情况进行全部验证或部分验证。

