未来食品的发展:植物蛋白肉与细胞培养肉
周景文, 张国强, 赵鑫锐, 李雪良, 堵国成, 陈 坚
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
未来食品是以解决全球食物供给、资源环境、质量安全、营养健康、饮食方式和精神享受等问题,利用合成生物学、脑科学、物联网、人工智能等颠覆性前沿技术,加工制造更健康、更安全、更营养、更美味的食品[1]。随着生命科学与技术快速进步与发展,基于代谢工程和合成生物学等手段,构建具有特定合成能力的细胞工厂,通过现代生物发酵技术,生产人类所需要不同食品的颠覆性创新技术取得了长足的进步(见图1)。利用细胞工厂发酵工程技术不仅可以生物合成制造不饱和脂肪酸、氨基酸、维生素等一系列高附加值产品[2-3],而且低成本合成制造淀粉、油脂、蛋白质等基本食品组分的技术也成了新的研究热点[4-5]。未来食品行业将开发和利用不同学科的交叉技术,根据功能与营养的差异性需求,实现未来食品智能化、定制化生产与加工,进一步补充或替代传统食品行业。
随着世界人口数量的快速增长和人类社会的不断发展,对食品的需求在数量与品质上都在不断提升。食品工业长期以来受科技发展影响较小,在历次科技革命中都没有发生过根本性变革。现阶段食品行业的主要创新往往局限在口味、包装和营销等层面。在前期的食品科学研究中,科研工作者主要通过改进生产方式,实现对现有食品的高技术改良,但是食品的形态或本质并没有改变。随着生物科学和食品科技的高速发展,食品科学正在从高技术食品改良向高技术食品制造转变,即从传统的食品品质改良到未来食品的全新合成[1]。在西方社会,食品工业正从深加工食品过渡到有机食品阶段,而有机食品正在向精准营养阶段过渡。目前,我国未来食品生物制造在研发投入、产业化方面还有待提高,标准体系和检测程序还有待完善。因此,围绕快节奏、营养化、多样性的国民健康饮食消费需求新变化与食品新兴产业发展新需求,开展未来食品创新技术研发和产业化协同发展,对我国食品工业健康可持续发展具有重大意义。
未来食品生物制造是基于食品多组学研究技术,利用系统生物学和大数据分析手段,解析不同食品营养组分、加工方式、膳食模式等与人体健康关系。作为未来食品的代表,植物蛋白肉与细胞培养肉等新型人造肉在健康、安全、环保等方面均较传统养殖肉类具有显著优势[6]。人造肉在研究初期会以模仿真实肉为主,如鸡肉、牛肉等,而随着研究深入及细胞培养、3D打印等新技术的不断突破,会逐渐走向肉制品的合成重构方向。植物蛋白肉由于植物蛋白来源广泛、加工工艺相对成熟,已经逐步开始商业化生产,但在口感、风味与营养等方面与真实肉制品仍然存在较大差距;细胞培养肉在营养、口感和风味方面可能更接近真实肉制品,在资源可持续和环境保护方面潜力巨大,是未来人造肉的主要研究发展方向,但是目前仍在理论与技术层面,特别是肌肉脂肪组织大规模低成本培养等方面,还存在诸多挑战。
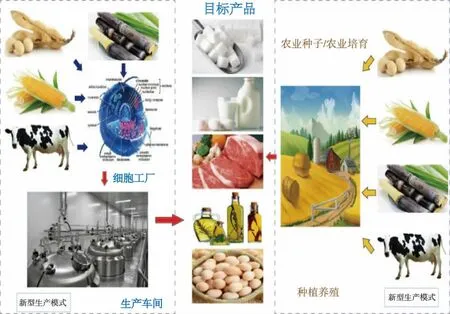
图1 未来食品的生物制造Fig.1 Biomanufacturing of future food
面对人造肉绿色生物制造的挑战,一方面要致力于采用食品合成生物学与现代发酵技术来提高食品原料的品质和安全性。基于食品组学研究,对食品营养、食品安全、食品品质等重要食品领域的内容进行评估。以细胞培养肉为例,首先以组织生物学和合成生物学等现代生物技术为基础,利用动物细胞特性和功能,设计、构建合成大规模的肌肉脂肪组织,生产出满足消费者需求的各种人造肉食品原料[6]。另一方面要推动食品工业向标准化、规模化发展,促进食品产业向高技术健康产业转型。利用代谢工程、发酵工程等技术合成人造肉原料,开发新食品资源和食品添加剂,进一步基于酶工程等技术提高人造肉等未来食品的质构,改善未来食品的口感、风味和储藏性能等。
1 植物蛋白肉生物制造的关键技术
植物蛋白肉是利用大豆、小麦、豌豆等植物蛋白替代动物蛋白,通过纤维结构化和风味物质的整合模仿真肉口感。目前,采用蛋白制品加工成类似肉制品形状的植物蛋白肉与真实肉制品有较大差距,普遍存在质构不足、蛋白生物价偏低、含过敏原及异味成分等问题,品质还有待进一步提升。现阶段,植物蛋白肉生物制造的关键任务在于植物蛋白来源与品质优化,结构风味改良、生物酶处理和理化改性协同加工策略开发等,通过重组植物蛋白质构,降低蛋白过敏原与异味成分,提升植物蛋白肉感官性能与营养价值。
1.1 植物蛋白肉来源与营养品质优化
目前,植物蛋白肉的主要蛋白组分来自大豆蛋白和小麦蛋白等。随着人们对营养价值需求的提升,花生蛋白、豌豆蛋白等其他来源的植物蛋白也将作为配料用于植物肉的生产,进一步提高植物肉营养价值。因此,如何有效重组具有不同氨基酸组成特点的蛋白质及平衡各蛋白质的持水、持油性,是提升植物肉感观品质的关键[7]。此外,植物源蛋白含有相对丰富的氨基酸,但是部分植物蛋白品质相对动物蛋白仍明显不足,存在必需氨基酸组分缺失、蛋白消化率与生物价低及含有致敏成分等问题,影响了植物蛋白的营养品质,需要进一步优化改良,符合健康饮食需求[8]。
部分植物蛋白含有较多的疏水性谷氨酰胺和天冬酰胺残基,这些氨基酸通过氢键等作用把蛋白质连接在一起,造成蛋白质凝聚、产生沉淀等,大大降低了蛋白质的溶解性,进而影响植物蛋白的工艺特性[9]。为解决这些问题,可以通过分析研究植物蛋白肉原料有效蛋白组分、品质与真实肉制品的差异,确定影响植物蛋白肉品质关键成分,如关键氨基酸、营养物质等,为植物蛋白肉品质提升提供指导。已有研究表明,植物蛋白通过糖基化等方法可以改善其持油、持水能力等,弥补天然植物蛋白品质的不足[10]。未来发展也可以利用微生物代谢工程、发酵工程、酶工程与食品工艺等整合策略,构建食品级微生物细胞工厂,合成优质蛋白或营养组分,从提高感官性能与营养价值、增加消化率与生物价、降低过敏原成分等方面,逐步提升合成蛋白的品质与营养价值。
1.2 植物蛋白肉组织结构改善
植物蛋白肉所用的拉丝蛋白受挤压方法和原料性质的影响较多,使植物蛋白肉的形态和质构可控性很差。迄今为止,已有大量研究通过改变原料配方、工艺参数从而优化纤维结构[11]。由于植物蛋白与天然肉类蛋白在结构上存在明显差异,为有效模拟天然肉口感,需要开发植物蛋白结构改良工艺。
目前,植物蛋白结构改良的研究包括物理挤压、化学添加以及生物酶改良等方法,部分技术已被广泛用于植物蛋白类食品的加工,并在产品感观品质及营养强化方面均取得较好效果[12]。由于生物酶法具有绿色安全、节能高效能优势,未来具有较大发展潜力。现阶段,如何将物理挤压与酶法处理有效结合,促进植物蛋白组织结构的改良也成为研究的热点。研究人员通过开发稳定性与特异性优良的谷氨酰胺转氨酶、蛋白质谷氨酰胺酶及各类蛋白酶,评估并优化影响酶制剂的关键因素,提升植物蛋白肉口感(见图2)[12]。采用物理挤压工艺,实现植物蛋白物理结构改造,生产高品质拉丝植物蛋白,增加植物蛋白交联度与蛋白韧性,使植物蛋白肉在结构与口感方面,达到与真实肉制品的高度相似。
1.3 植物蛋白肉中关键酶制剂优化
植物蛋白肉的加工过程主要涉及物理挤压与后期食品营养风味加工等,由于植物蛋白存在质构、营养、安全等问题,需要生物技术干预才能有效改善植物蛋白品质。例如,植物蛋白过敏和异味成分是影响消费者选择植物蛋白类食品的重要因素之一。常用的植物蛋白,如大豆蛋白等,常含有豆腥味和过敏原等成分,影响了植物蛋白的风味与安全,限制了植物蛋白在食品领域的广泛应用[13]。其中,β-伴大豆球蛋白和大豆球蛋白等都是潜在的致敏原,在低阈值水平即能够引发大豆过敏反应。脂肪氧化酶催化生成低分子醇醛是造成蛋白异味的主要原因。
目前,通过传统物化方法可以解决大豆的致敏、异味等问题,但会破坏大豆的营养成分,而采用酶法处理则具有相对温和的优势。通过酶工程等技术,筛选改造高特异性与活性的蛋白酶、风味蛋白酶及相关食品微生物等,实现脂肪氧化酶失活、腥味物质降解、微生物共发酵等,优化人造肉中氨基酸组分等,提升植物蛋白肉的安全性与风味。此外,植物蛋白肉存在的质构差等问题也需要开发不同的生物酶复合系统进行优化,例如谷氨酰胺转氨酶、蛋白质谷氨酰胺酶等复合酶制剂。因此,优化酶制剂在植物蛋白质构与营养改良中的应用,提高食品原料利用效率、改进食品风味和安全性,将推动植物蛋白肉市场的拓展。
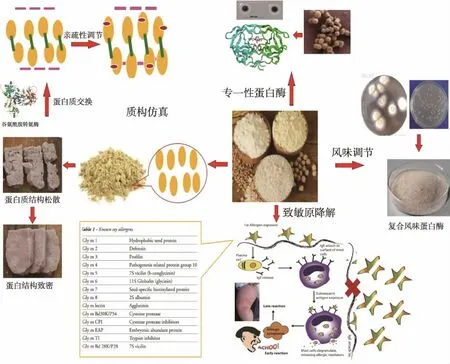
图2 生物酶工艺在植物蛋白加工中的应用Fig.2 Application of enzyme technology in plant protein processing
2 细胞培养肉生物制造的关键技术
细胞培养肉是指基于干细胞、组织工程等技术在体外培养的动物肌肉组织,经过色泽、风味调整,营养物质补充以及物理成型等加工制成的模拟肉制品(见图3)[14]。肌肉干细胞的发现和体外培养已有半个世纪的历史[15-16],但细胞培养肉诞生的标志是2013年荷兰研究人员用完整的细胞培养牛肉制备的汉堡产品[17]。
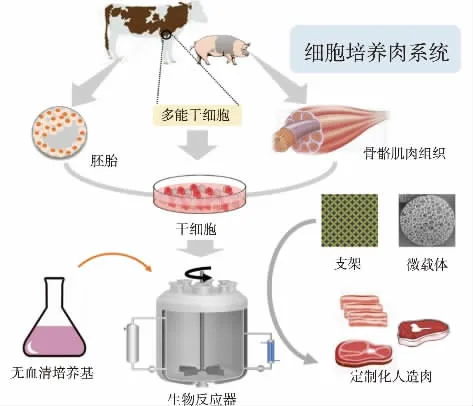
图3 细胞培养肉的生产流程Fig.3 Workflow of cell-cultured meat
2.1 干细胞的低成本获取
作为食品,细胞培养肉只有在实现大规模生产的情况下才有现实意义。从种子细胞来源的角度而言,要求用于培养肉生产的干细胞同时具有两种特性:无限、快速增殖而不损失干性且不发生性状改变或失去分化的能力以及稳定、高效分化成为肌肉组织的能力,两者缺一不可。
表1 列出了可能用于细胞培养肉生产的干细胞来源。可以看到,自然条件下并没有一种干细胞同时符合上述两个条件。全能胚胎干细胞虽然可以无限增殖,但是定向分化成肌肉细胞存在着不确定性。肌肉干细胞可以自然分化并形成肌肉组织,但是自然状态下体外培养时传代次数非常有限且速率较慢[18-19]。因此,解决胚胎干细胞的定向分化问题,或者是肌肉干细胞的无限增殖问题,是细胞培养肉技术的关键之一。荷兰的初创公司Meatable在2018年宣称解决了具有无限增殖能力的多能脐带干细胞定向分化的问题,但对其成本缄口不提[20]。使用肌肉干细胞作为细胞培养肉种子只需从成年动物身体上取少量样本而无须屠杀,具有动物伦理优势,使培养肉产品更容易被接受。种子细胞关乎一个公司的生存,相关技术作为商业机密不被公开。然而,这种生产过程的不透明,可能会影响消费者的接受度[21-22]。
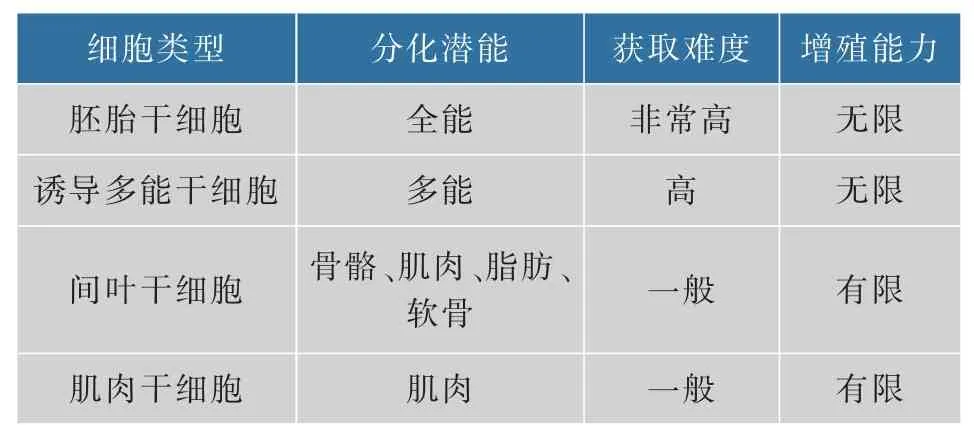
表1 潜在的可应用于细胞培养肉的干细胞来源Table 1 Potential stem cell sources for cell-culture meat
2.2 肌肉和脂肪干细胞增殖分化
培养肉的生产在细胞这一层面要经过两个步骤:增殖和分化。增殖是指少量干细胞经过不断分裂传代产生大量新的干细胞的过程。此后,通过改变培养条件[23],如降低培养基中胎牛血清浓度,干细胞分化成肌肉细胞并最终形成肌肉组织[19]。在细胞培养肉领域,使用全能胚胎干细胞作为种子的较少,而使用肌肉干细胞的技术更具吸引力。后者的主要问题是如何在增殖的过程中保持干性[24]。有些细胞系可以靠不断自发的突变而获得无限增殖的能力,但这一过程类似于癌变,会对细胞的特性产生不利影响。通过基因修改也可以使细胞获得无限增殖的能力,以及改进全能干细胞定向分化的稳定性。然而GMO食品的推广会遇到相当大的阻力。尤其是在欧盟国家,是完全被禁止的。用于细胞培养肉的干细胞的增殖和分化,应该是以优化培养条件以及代谢调控为主。
Boonen等人[25]发现贴壁培养时基质的弹性对小鼠肌肉干细胞的增殖和分化有着显著影响。如果该现象在家畜肌肉干细胞培养中也存在,他们的研究结果则对细胞培养肉所用微载体的研究有指导意义。Ding等人发现在牛肌肉干细胞体外增殖的过程中,丝裂原激活蛋白激酶(P38-MAPK)信号被激活而成对盒蛋白PAX7的表达逐渐消失。使用一定浓度的p38抑制剂(SB203580),不但牛肌肉干细胞增殖能力和PAX7表达得到提升,而且解除抑制后细胞分化成肌肉细胞的能力也有改善。然而,这一昂贵的抑制剂将大大提升成本。因此,通过廉价的方法提高细胞增殖和分化的效率,是细胞培养肉产业化之前必须解决的问题。
2.3 细胞培养肉的规模放大
整个细胞培养肉的产品规模放大,包括基础原料肌肉组织和后期营养风味成分的生产加工放大。但目前主要的困难与挑战在于基础原料的放大,也就是如何高效模拟肌肉细胞或组织生长环境。动物细胞由于没有细胞壁的保护非常脆弱,无法承受剧烈搅拌带来的剪切力。同时,动物细胞对环境均一性的要求又很高,反应器体积放大以后,必须剧烈搅拌才能保证温度、溶氧、pH值以及营养物质的均一性。这两种需求之间的矛盾,导致动物细胞培养装置的规模一般不超过1~2 m3,最大不超过20 m3,与用于食品生产的动辄几百立方米的微生物细胞培养反应器相比规模非常小。因此,动物细胞和组织培养传统上主要是用于价格昂贵且产量极低的医疗医药产品(见图4)。在细胞培养肉领域,随着无血清培养基技术的逐渐成熟,细胞培养肉产业化要解决的下一个问题便是规模的放大。
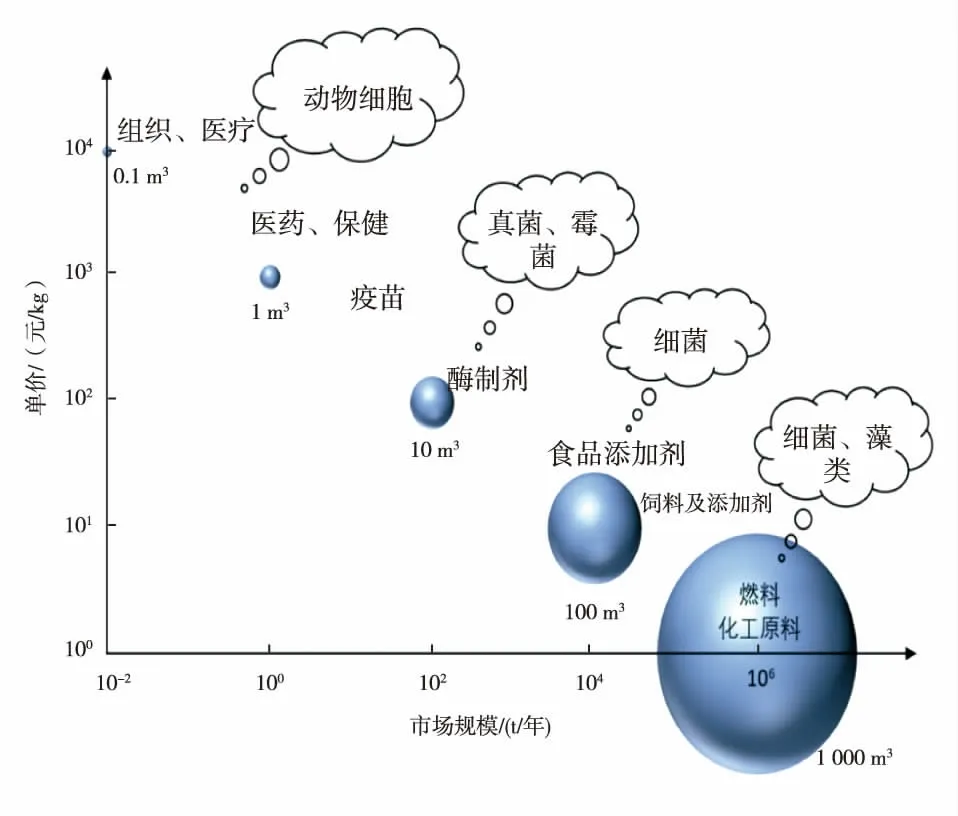
图4 生物制品价格与市场规模关系Fig.4 Relationship between price of biological products and market scale
细胞培养工艺和反应器的理性放大需要细胞利用底物和摄入氧气的动力学参数,对溶氧、静压强、剪切应力、温度及其变化率的承受能力,代谢废物包括CO2对细胞生理特性的影响等基础数据。尤其是细胞对剪切应力的承受能力,对反应器选型、操作、过程控制及采用哪种流体力学模型模拟都有重大影响,甚至可以说是细胞培养肉能否真正实现规模化生产的决定因素。目前文献中还没有针对动物肌肉细胞的相关报道,有些研究人员对细胞培养肉大规模生产进行展望时,也忽视了这些问题[27-28]。Li等假设动物肌肉干细胞的生理特性与常见动物细胞类似,利用计算流体力学(CFD)和数学模型设计了一个300 m3的气升式反应器用于细胞培养肉生产,从理论上证明了这一策略的可行性[26]。针对动物肌肉细胞生理特性数据所做的假设,还需要大量实验数据进行验证。
3 人造肉的食品化技术
目前,微生物细胞工厂与干细胞组织培养技术虽然已经可以生产人造肉食品,但目前市场认可度还比较低。主要原因是现阶段产品还无法真正模拟真肉的品质。因此,要想生产符合消费者口味的人造肉食品,还需要开发相应的食品化技术,在现有产品的基础上做到人造肉制品的色、香、味、型俱全,才能真正被大众所接受,实现产业化推广。
3.1 微生物合成技术
以动植物来源蛋白(大豆球蛋白、肌动蛋白、肌红蛋白、血红蛋白、脂蛋白、糖蛋白等)为基础的新型人造肉食品已经逐渐发展起来,而如何高效获得符合食品安全生产标准的人造肉相关蛋白组分是目前人造肉食品生产的关键问题[29]。
利用食品级微生物细胞工厂,合成植物蛋白肉加工工艺所必需的酶和小分子功能性化合物,降低过敏原与异味成分含量,可以突破以往仅通过物理加工改善植物蛋白肉质构、口感所存在的局限性。目前,利用大肠杆菌、毕赤酵母等微生物模式菌株已经可以实现一些人造肉相关蛋白(大豆球蛋白、血红蛋白等)的合成。但是应用微生物来合成人造肉相关蛋白还存在产率较低、不易纯化的问题,相关产品无法工业化大规模生产。因此,为了实现人造肉相关蛋白的高效合成,需要解决两个方面的难题:第一,实现人造肉相关蛋白中蛋白组分的高效表达;第二,由于血红蛋白需要血红素等辅基才能具有完整的生物学功能,所以必须增强血红素等辅基的供应水平,以满足相关蛋白质合成过程中对辅基的需求。
3.2 合成生物学技术
食品合成生物学是在传统食品制造技术基础上,采用合成生物学原理设计生产重要食品组分、功能性食品添加剂和营养化学品,解决食品原料和生产方式过程中存在的不可持续等问题,实现更安全、更营养、更健康的食品获取方式(见图5)。人造肉等未来食品在食品化加工过程中需要对其进行色香味等方面加工,食品合成生物学可发挥重要作用。例如,人造肉颜色中的血红蛋白和肌红蛋白起到关键作用。目前,利用毕赤酵母合成的大豆血红蛋白可以生产颜色较为接近的牛肉制品。但是植物来源血红蛋白与动物来源的血红蛋白存在差异,而且非食品级的毕赤酵母也并不适合用来生产血红蛋白。因此,利用食品级微生物高效合成动物来源的血红蛋白和肌红蛋白才能更好地在模拟肉制品中呈现逼真的肉色与风味。
肉类的香气与鲜味是肉类品质的关键表征参数。应用GC-MS等分析方法,对比生肉与熟肉的化学组成可以发现,肉中主要的香味物质是由氨基酸和糖类在高温下经美拉德反应形成的含硫化合物、含氮杂环化合物以及微量的醛、酮、醇和呋喃类化合物。近年来,通过采用动物或植物蛋白的酶解产物氨基酸(半胱氨酸)和还原糖(木糖或果糖)反应,已经能够生产各种强烈、逼真的香味物质[32]。利用产酯酵母合成人体所需的不饱和脂肪酸酯并适量添加至人造肉食品中,可以更加真实地模拟出各种肉类的味道,从而提高人造肉食品味觉品质[29]。因此,利用食品合成生物技术可以实现不同营养与风味物质的合成,为人造肉等未来食品的营养、风味定制化加工提供有效手段。
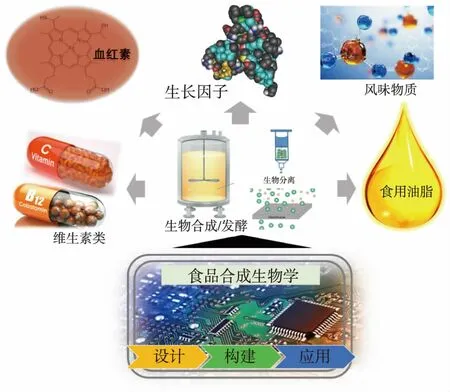
图5 合成生物学技术在未来食品生物制造中的应用Fig.5 Application of synthetic biology in future food biomanufacturing
3.3 食品3D打印技术
食品的三维结构可以直接影响消费者对产品的认可度。目前利用细胞工厂合成原料生产的人造肉食品普遍结构松散,无法让食用者产生真实的咀嚼感。而应用食品3D打印技术对仿真肉制品的结构进行重塑,产生紧密而又富有弹性的三维结构。利用食品级材料,以3D打印和激光技术,已经可以制造出结构上高度相似但仍保持柔韧的人造血管。在作为支架的人工血管间,填充按最佳配方合成的仿真肉糜和食品级交联剂,以实现致密肌肉组织的模拟效果。除此之外,最新的3D打印技术还可以实现对仿真肉制品中肉质的颗粒度、坚韧性进行可编程的局部控制。在此基础上,应用即将投入市场的量子化3D打印技术可以实现细胞水平的结构重排,实现三维结构人造肉食品的生产。
4 植物蛋白肉与细胞培养肉面临的挑战
4.1 其他未来食品原料组分的微生物合成
现阶段人造肉等未来食品的原料组分主要从植物组织或畜禽中提取,但随着动植物蛋白在食品、饮品等领域广泛应用,依靠人工提取获得食品原料无论种类还是数量上已无法满足大众对健康、环保及美味食品的不断追求。而利用微生物细胞工厂异源合成相关蛋白及营养成分,具有低成本、条件温和、环境友好等优点。因此,以代谢工程为基础的微生物发酵法合成动植物蛋白等原料组分将成为新的发展趋势。在已有的报道中,应用不同的微生物已经实现了多种与未来食品生产密切相关组分的合成,例如人造奶与人造蛋所需的酪蛋白、乳清蛋白、乳铁蛋白、营养因子等重要组分。而随着合成生物学技术的快速发展,将可以实现更多未来食品基本原料和高营养价值添加成分的高效合成。
4.2多学科交叉提升未来食品质构与营养
目前人造肉的研究热点主要在于揭示其在结构组成上与真实肉之间的差异,比较分析人造肉口感、风味等品质的不足,高效整合物理加工与生物酶法技术,提高人造肉结构交联程度,优化相关工艺参数,实现从蛋白纤维化质构、营养品质到仿真肉口感的整体提升。动物培养肉在干细胞获取及大规模培养等方面均存在较大挑战,如何有效整合组织培养、合成生物学与生物反应器工程是突破动物细胞培养肉的关键。此外,随着多学科交叉的兴起和不断发展,食品感知科学在基础研究领域获得了众多突破性进展[30]。因此,开展食品感官特性、感官交互作用与味觉多元性、感官模拟与个体差异以及感官/评估方法与标准等方面的研究也有利于食品品质的提升,是未来食品研究的重要领域。
4.3细胞培养肉市场接受度有待提升
虽然人们已经意识到传统畜禽养殖引发的自然资源和环境污染等问题,但是由于大部分消费者对细胞培养肉的生产过程缺乏了解,存在对食品安全性和伦理方面的担忧,现阶段人们对肉类消费的积极性和接受度依然存在问题。目前,为缓解这些担忧,科学家正在调研与分析消费者对细胞培养肉的态度,了解大众对细胞培养肉的看法,并确定阻碍其推广的主要问题。调查结果表明,虽然大多数受访者愿意尝试细胞培养肉,但只有不到三分之一受访者愿意将其作为传统肉制品的替代。此外,现阶段细胞培养肉的高成本也会阻碍其进一步的市场推广。
4.4安全监管与政策完善利于产业健康发展
细胞培养肉等未来食品的发展还面临安全监管与政策制度等一系列挑战。细胞培养肉是前沿技术创新和新兴产业,现有生物产业发展、市场准入和监管、安全性评价等制度已不能适应细胞培养肉产业发展。因此,如何形成完善的制度对行业健康发展具有重要意义。例如,通过培养肉营养成分、生物利用度、毒性评价体系研究,构建动物培养肉营养评价模型,形成产品品质指标体系标准。通过对动物细胞培养肉与真实肉制品的对比测试,确定动物培养肉在评估中暴露的膳食摄入标准,为细胞培养肉的市场推广提供安全保障的政策法规。制定产业发展规范和加强市场管理,保障细胞培养肉产业健康发展。
5 展望
随着食品科学与生命科学的发展,以植物蛋白肉和细胞培养肉等为代表的新兴食品得到了越来越多关注,是未来食品生产的重要发展趋势。未来食品制造将有机会实现人工智能与大数据时代下的全合成食品、精准营养、风味感知等技术的大范围普及应用,如细胞培养肉、人造蛋、人造奶等大宗食品及食品原料实现细胞工厂生产,逐渐减少食品工业对传统农业的依赖性。综上,开展细胞培养肉等未来食品的研究和推广应用,将有利于缓解资源与能源危机,实现绿色可持续发展,对于保障国家食品安全战略具有重要意义。

