人参根提取物对小鼠脾淋巴细胞自噬、增殖和细胞因子分泌的影响及机制研究
李芳宇 齐滨 边帅 赵月 卢姝言 王佳雯 赵大庆

摘 要 目的:研究人參根提取物对小鼠脾淋巴细胞自噬、增殖及细胞因子分泌的影响,并研究其作用机制。方法:将小鼠脾淋巴细胞分为空白对照组、阳性对照组(刀豆蛋白A,5 μg/mL)和不同质量浓度人参根提取物组(32、125、500 μg/mL,以冻干粉末计)。各组细胞加入相应药物培养48 h后,分别采用吖啶橙染色法检测细胞的自噬情况;采用CCK-8法检测细胞的增殖情况;采用酶联免疫吸附法测定细胞培养液中白细胞介素4(IL-4)、IL-6、肿瘤坏死因子α(TNF-α)的水平;采用Western blotting法检测细胞中微管相关蛋白轻链β3(LC3B)、酵母ATG6同源物(Beclin-1)的表达水平以及腺苷酸活化蛋白激酶(AMPK)、蛋白激酶B(AKT)、雷帕霉素靶蛋白(mTOR)的磷酸化水平。结果:与空白对照组比较,32、125、500 μg/mL人参根提取物均能够增加小鼠脾淋巴细胞酸性自噬体的数量(P<0.05或P<0.01);125、500 μg/mL人参根提取物均可显著提高细胞存活率,显著提高细胞中IL-4、IL-6和TNF-α的水平,显著促进细胞中LC3BⅠ向LC3BⅡ转化,显著上调细胞中Beclin-1蛋白表达水平,显著提高AMPK蛋白的磷酸化水平,显著降低AKT和mTOR蛋白的磷酸化水平,差异均有统计学意义(P<0.05或P<0.01)。结论:人参根提取物能通过激活AMPK、抑制AKT活化来抑制mTOR活性,从而诱导小鼠脾淋巴细胞发生自噬、激活脾淋巴细胞活性、调节细胞因子分泌以发挥免疫增强作用。
关键词 人参根提取物;脾淋巴细胞;自噬;细胞因子;免疫增强作用
ABSTRACT OBJECTIVE: To study the effects of ginseng root extract on autophagy, proliferation and cytokine of splenic lymphocyte of mice, and to study its mechanism. METHODS: The splenic lymphocyte of mice were divided into blank control group, positive control group (concanavalin A, 5 μg/mL), different concentration of ginseng root extract groups (32, 125, 500 μg/mL, by lyophilized powder). After 48 h of culture with the corresponding medicine, acridine orange staining method was used to detect autophagy of splenic lymphocyte; CCK-8 assay was used to detect the cell proliferation; ELISA assay was used to determine the levels of IL-4, IL-6 and TNF-α in cell culture; Western blotting method was used to detect the expression of LC3B and Beclin-1, as well as the phosphorylation of AMPK, AKT and mTOR. RESULTS: Compared with blank control group, 32, 125, 500 μg/mL ginseng root extract could increase the number of acidic autophagosomes in splenic lymphocytes of mice (P<0.05 or P<0.01); 125, 500 μg/mL Ginseng root extract could significantly enhance the survival rate of splenic lymphocytes, the levels of IL-4, IL-6 and TNF-α and the transformation of LC3BⅠ to LC3BⅡ, significantly increased the protein expression of Beclin-1, the phosphorylation of AMPK protein, and significantly reduced the phosphorylation level of AKT and mTOR proteins, with statistical significance (P<0.05 or P<0.01). CONCLUSIONS: Ginseng root extract can induce autophagy of mice splenic lymphocytes, activate the activity of splenic lymphocytes, regulate the secretion of cytokine by activating AMPK and inhibiting the activation of AKT which can inhibit the activity of mTOR, so as to exert immune enhancement effect.
KEYWORDS Ginseng root extract; Splenic lymphocytes; Autophagy; Cytokine; Immune enhancement effect
人参是五加科人参属植物人参Panax ginseng C. A. Mey.的干燥根及根茎[1]。据《神农本草经》记载:“人参主补五脏,安精神,定魂魄,除邪气,明目、开心、益智,久服轻身延年”[2]。现代药理学研究表明,人参具有改善记忆力、抗疲劳、抗衰老、抗病毒以及提高免疫力等功效,并且对非特异性免疫、体液免疫和细胞免疫均有明显的调节作用[3-9]。自噬是细胞吞噬自身细胞质蛋白或细胞器进入囊泡,与溶酶体形成自噬溶酶体并降解其包裹的内容物的过程,以此可更新细胞器并完成细胞的自身代谢[10]。同时,自噬在淋巴细胞的活化过程中起着重要的作用[11]。多个研究指出,人参及其主要成分具有免疫调节的作用[12]。然而,人参对脾淋巴细胞自噬及免疫调节方面的作用鲜有报道。鉴于此,本研究选用人参根提取物体外作用于小鼠脾淋巴细胞,探究其对脾淋巴细胞自噬、增殖以及免疫因子分泌的影响,并初步探讨其可能的作用机制,为人参根提取物的深入研究和开发提供理论基础。
1 材料
1.1 仪器
Infinite 200 Pro型酶标仪(瑞士Tecan公司);3111型CO2培养箱、iBright型智能成像系统FL1000(美国 Thermo Fisher Scientific公司);IX73型荧光显微镜(日本Olympus公司);1645050型蛋白质凝胶电泳仪、Mini- Protean 1658001型电泳槽(美国Bio-Rad公司)。
1.2 药品与试剂
人参药材采购自吉林抚松(采摘时间为2018年9月20日),由长春中医药大学药学院肖井雷副教授鑒定为五加科人参属植物人参Panax ginseng C. A. Mey.的干燥根;RPMI 1640培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);刀豆蛋白A(美国Sigma公司,批号:C0412,纯度:95%);CCK-8试剂盒(美国Boster公司,批号:AR1160-500);白细胞介素4(IL-4)、IL-6、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试剂盒(上海优选生物科技有限公司,批号:YX-091204M、YX-091026M、YX-201606M);红细胞裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:C3702、P0010);吖啶橙(AO)染料(北京索莱宝科技有限公司);兔抗蛋白激酶B(AKT)、磷酸化AKT(p-AKT)、腺苷酸活化蛋白激酶(AMPK)、磷酸化AMPK(p-AMPK)、雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)、β-肌动蛋白(β-actin)多克隆抗体(南京巴傲得生物科技有限公司,批号:BS90043、BS4006、BS6271、BS4010、BS1555、BS4706、AP0060);兔抗微管相关蛋白轻链β3(LC3B)、酵母ATG6同源物(Beclin-1)单克隆抗体及辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(美国CST公司,批号:12741、3495、7074P2);其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 动物
SPF级C57BL/6小鼠20只,雄性,8周龄,体质量18~20 g,购自长春亿斯实验动物技术有限责任公司,生产合格证号:SCXK(吉)2018-0007。本实验方案符合《吉林省实验动物管理办法》对动物伦理的要求。
2 方法
2.1 人参根提取物的制备
精密称取人参根50 g,粉碎,过筛(80目),加入10倍量水(mL/g,下同),40 ℃水浴超声(频率:40 kHz,功率:600 W)提取2 h,将提取液以3 500 r/min离心5 min后,滤过,收集滤液并进行超滤浓缩。残渣加10倍量水,80 ℃水浴提取1.5 h,将提取液以3 500 r/min离心5 min后,滤过,收集滤液并进行超滤浓缩。分别将2次浓缩液冻干,即得(人参根提取物收率为21.58%),其中有效成分含量为人参蛋白7.32%、人参多糖8.7%、人参皂苷9.5%。
2.2 小鼠脾淋巴细胞的制备
将小鼠处死,按文献方法[13]在无菌操作条件下取出其脾组织并制备脾淋巴细胞悬液,用血球计数板进行细胞计数,备用。
2.3 人参根提取物对小鼠脾淋巴细胞自噬的影响考察
采用AO染色法进行测定。将小鼠脾淋巴细胞按5×106个/孔接种至6孔板中,将细胞分为空白对照组(空白培养基)、阳性对照组(刀豆蛋白A,5 μg/mL[14])和不同质量浓度人参根提取物组(32、125、500 μg/mL,以冻干粉末计,质量浓度按照前期预试验设置)。各组细胞加入相应药物在37 ℃、5%CO2培养箱中(下同)培养48 h。以1 000 r/min离心5 min,收集各孔细胞,以磷酸盐缓冲液(PBS)洗涤3次后,以4%多聚甲醛室温固定10 min,然后以1 000 r/min离心5 min,收集细胞;再次用PBS洗涤3次,然后加入AO染液(终质量浓度为15 μg/mL),室温避光孵育15 min后,在荧光显微镜下观察细胞的形态并拍照。采用Image Pro Plus 6.0软件进行免疫荧光分析。当自噬水平较低时主要观察到绿色荧光,当自噬水平较高时红色荧光增强,两者合成后呈黄色荧光,黄色荧光强度值越大则表明细胞自噬水平越高。试验重复3次。
2.4 人参根提取物对小鼠脾淋巴细胞增殖的影响考察
采用CCK-8法进行测定。将小鼠脾淋巴细胞按1×105个/孔接种至96孔板中,按“2.3”项下方法进行细胞分组、给药。培养48 h后,每孔加入10 μL CCK-8试剂,然后培养2 h。另设不加药物和细胞的阴性对照组。采用酶标仪于450 nm波长下测定各孔的光密度(OD)值[15],并计算各组细胞的存活率[细胞存活率(%)=(给药组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%]。试验重复3次。
2.5 人参根提取物对小鼠脾淋巴细胞培养液中IL-4、IL-6和TNF-α水平的影响考察
采用ELISA法进行测定。将小鼠脾淋巴细胞按1×105个/孔接种至96孔板中,按“2.3”项下方法进行细胞分组、给药。培养48 h后,以3 000 r/min离心10 min,收集各孔细胞培养上清液。参照相应试剂盒说明书方法操作,检测细胞培养液中IL-4、IL-6和TNF-α水平。试验重复3次。
2.6 人参根提取物对小鼠脾淋巴细胞中自噬相关蛋白表达的影响考察
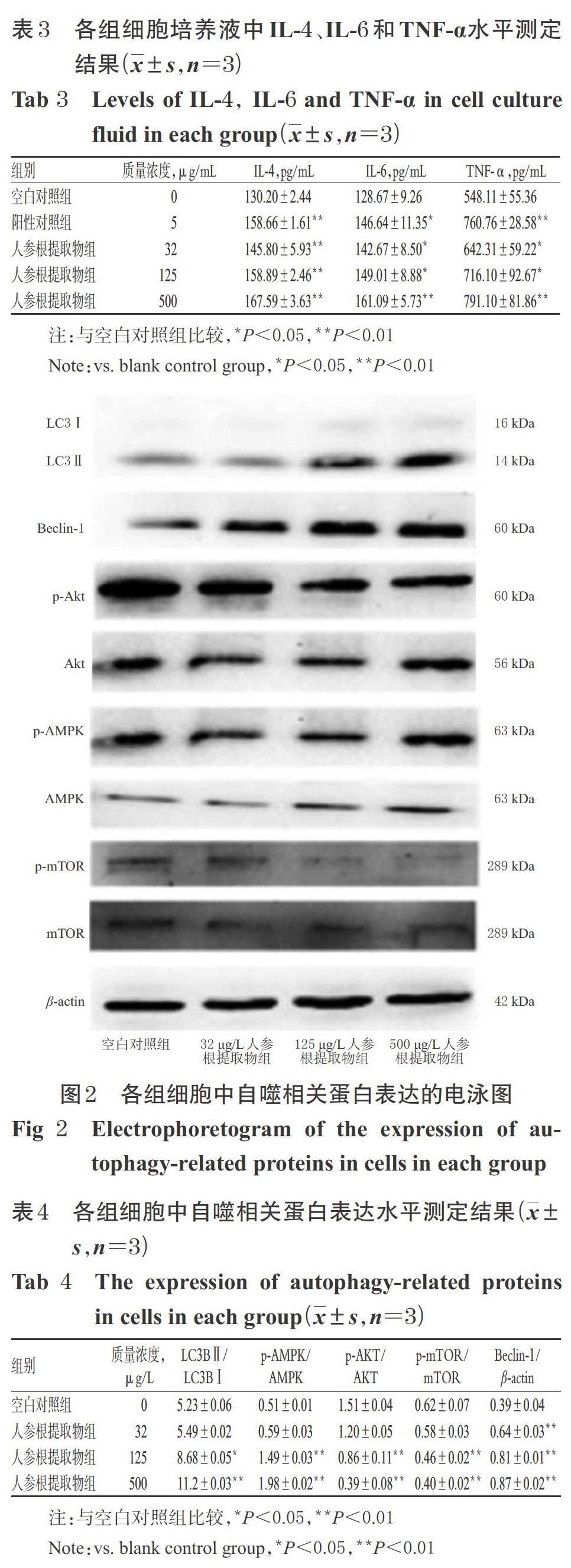
采用Western blotting法进行测定。将小鼠脾淋巴细胞按5×106个/孔接种至6孔板中,将细胞分为空白对照组和不同质量浓度人参根提取物组(按“2.3”项下方法设置为32、125、500 μg/mL,以冻干粉末计)。培养48 h后,以1 000 r/min离心5 min,收集各孔细胞,用PBS洗涤3次,然后加入细胞裂解液充分裂解后,再采用BCA法测定蛋白浓度。将蛋白变性处理后,取50 μg在80 V电压下行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳90 min,然后以200 mA湿法转膜80 min至硝酸纤维素膜(NC)上。将膜放入含5%脱脂奶粉的PBST缓冲液中室温封闭1 h后,加入LC3B、Beclin-1、AKT、p-AKT、AMPK、p-AMPK、mTOR、p-mTOR、β-actin一抗(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;以PBST缓冲液洗膜3次,然后加入二抗(稀释度为1 ∶ 1 000),室温孵育1 h;以PBST缓冲液再次洗膜3次,然后在智能成像系统中采用ECL化学发光液显色。采用Image J 1.52a软件对蛋白条带进行灰度值分析,以目标蛋白条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的表达水平,分别以p-AKT/AKT、p-AMPK/AMPK、p-mTOR/mTOR比值表示AKT、AMPK、mTOR蛋白的磷酸化水平,以LC3BⅡ/LC3BⅠ的比值反映IC3BⅠ向LC3BⅡ轉化的情况。试验重复3次。
2.7 统计学方法
采用GraphPad Prism 5 软件进行数据处理。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 人参根提取物对小鼠脾淋巴细胞自噬的影响
与空白对照组比较,各给药组细胞的荧光强度(指合成后的黄色荧光强度,下同)均显著增大(P<0.05或P<0.01),说明给药后细胞的自噬水平均显著升高,且人参根提取物的作用具有一定的浓度依赖趋势。各组细胞的AO染色显微图见图1,荧光强度测定结果见表1。
3.2 人参根提取物对小鼠脾淋巴细胞增殖的影响
与空白对照组比较,阳性对照组和125、500 μg/mL人参根提取物组细胞的OD值均显著升高(P<0.05或P<0.01),其中500 μg/mL人参根提取物组细胞的存活率达到了150.00%。由此可见,125~500 μg/mL人参根提取物可刺激小鼠脾淋巴细胞的增殖。各组细胞的OD值和存活率测定结果见表2。
3.3 人参根提取物对小鼠脾淋巴细胞分泌IL-4、IL-6和TNF-α的影响
与空白对照组比较,各给药组细胞培养液中IL-4、IL-6和TNF-α水平均显著升高(P<0.05或P<0.01),表明给药后可促进小鼠脾淋巴细胞分泌免疫因子IL-4、IL-6和TNF-α,且人参根提取物的作用具有一定的浓度依赖趋势。各组细胞培养液中IL-4、IL-6和TNF-α水平测定结果见表3。
3.4 人参根提取物对细胞中自噬相关蛋白表达的影响
与空白对照组比较,125、500 μg/mL人参根提取物组细胞中LC3BⅡ/LC3BⅠ、p-AMPK/AMPK均显著升高(P<0.05或P<0.01),p-AKT/AKT、p-mTOR/mTOR均显著降低(P<0.01); 32、125、500 μg/mL人参根提取物组细胞中Beclin-1蛋白表达水平均显著升高(P<0.01)。各组细胞中自噬相关蛋白表达的电泳图见图2,蛋白表达水平测定结果见表4。
4 讨论
本课题组前期经过设置人参根提取物样品溶液的系列质量浓度梯度,确定了其在32~500 μg/mL质量浓度范围内对小鼠脾淋巴细胞无毒性,且能够提高细胞活性,并具有浓度依赖趋势。因此,本研究选用32、125、500 μg/mL这3个质量浓度进行研究。脾淋巴细胞增殖是反映机体细胞免疫与体液免疫最直接的指标[16]。本研究结果显示,人参根提取物作用于小鼠脾淋巴细胞后,细胞增殖能力显著增强。这说明人参根提取物能促进小鼠体外淋巴细胞增殖,具有增强细胞免疫功能的作用。
淋巴细胞是适应性免疫应答中的关键部分[17],本研究主要测定了小鼠脾淋巴细胞中IL-4、IL-6和TNF-α这3种细胞因子的分泌情况。IL-4是由辅助T细胞产生的细胞因子,主要作用于B细胞,可促进B细胞的增殖[18];IL-6在细胞吞噬、抗原提呈、炎症调节中均扮演着重要角色,其能够同时调节细胞免疫和体液免疫[19];TNF-α能够加强免疫反应,并诱导其他免疫因子的分泌[20-21]。本研究结果表明,人参根提取物能够诱导小鼠脾淋巴细胞分泌IL-4、IL-6和TNF-α,从而增强免疫功能,并且其作用具有一定的浓度依赖趋势。
自噬是细胞吞噬受损的细胞器及其变性的蛋白质,并将吞噬物转运到溶酶体中进行降解和再循环,是一种广泛存在于真核细胞内的自我降解机制[22]。自噬的激活受多种途径调控,其中mTOR信号传导途径为细胞自噬过程中最重要的调控途径,起负向调控作用[23]。AMPK是一种丝/苏氨酸激酶,其活化(磷酸化)后在细胞生长、自噬、凋亡等生物学过程中发挥着重要作用[14]。Akt(或称PKB)同样也是一种丝/苏氨酸蛋白激酶,其可协同磷脂酰肌醇依赖性蛋白激酶1/2促进三磷酸磷脂酰肌醇与其自身结合,Akt由细胞质转移至细胞膜并发生活化(即磷酸化),Akt活化后可激活下游蛋白mTOR(即使其磷酸化)[24]。研究证实,AMPK/mTOR与Akt/mTOR是两条经典的自噬信号通路[25-26]。近年来,大量的研究表明,自噬参与淋巴细胞的发育、固有免疫和适应性免疫应答途径[27]。在过去的10年里,自噬已经成为T细胞稳态、激活和分化的重要调节因素,基础自噬能够维持T细胞的内环境稳态,活化诱导的巨自噬被认为是细胞增殖和代谢的关键调控因素,也是效应CD8+T细胞记忆产生的关键[28]。Beclin1是哺乳类动物中第一个被确认的自噬特异性调控基因,通过BH3区域、CCD及ECD在细胞自噬和凋亡过程中发挥至关重要的作用[29]。LC3是控制自噬膜的形成和自噬体与溶酶体融合的关键蛋白,在自噬体膜的延伸和成熟中发挥关键作用,其分为 LC3Ⅰ和LC3Ⅱ两种亚型,自噬发生时,可溶性LC3Ⅰ被活化,并修饰形成LC3-Ⅱ后通过融合蛋白转位至自噬体膜,从而促进自噬体的成熟,参与自噬体形成[30-32]。LC3Ⅱ是自噬体的标志分子,其含量的多少与自噬泡数量的多少呈正比,因此自噬程度与 LC3Ⅱ表达水平呈正相关[30]。本研究结果发现,人参根提取物可增加小鼠脾淋巴细胞自噬水平,使AMPK的磷酸化水平提高,AKT与mTOR的磷酸化水平降低,并可上调自噬相关蛋白Beclin-1的表达,增加LC3BⅠ到LC3BⅡ的转化[10],这说明人参根提取物可活化小鼠脾淋巴细胞,并通过AMPK/mTOR和AKT/mTOR途径诱导细胞自噬。
综上所述,人参根提取物能通过激活AMPK、抑制AKT活化来抑制mTOR活性,从而诱导小鼠脾淋巴细胞发生自噬、激活脾淋巴细胞活性、调节细胞因子分泌来发挥免疫增强作用。后续本课题组将在此基础上进一步探究其作用的分子机制及其对淋巴细胞不同亚群的影响。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:8.
[ 2 ] 吴普述.神农本草经[M].南宁:广西科学技术出版社,2016:31.
[ 3 ] 李倩,柴艺汇,高洁,等.人參现代药理作用研究进展[J].贵阳中医学院学报,2019,41(5):89-92.
[ 4 ] 许慧.人参皂苷Rg1及其代谢产物Rh1、Ppt 生精保护作用的分子机制研究[D].开封:河南大学,2013.
[ 5 ] 姚根兰,张娅萍,欧阳柳凤,等.人参抗疲劳作用的研究进展[J].世界中西医结合杂志,2015,10(8):1174-1177.
[ 6 ] 潘鑫鑫,郑卫红.人参总皂苷抗衰老作用的实验研究[J].中国老年学杂志,1995,15(5):288-290.
[ 7 ] SONG JH,SONG HH,et al. Antiviral activity of ginse- nosides against coxsackievirus B3,enterovirus 71,and human rhinovirus 3[J]. J Ginseng Res,2014,38(3):173- 179.
[ 8 ] 张南,李娜,李佳琳,等.人参、刺五加提取物对链脲佐菌素诱导糖尿病小鼠的降糖作用研究[J].天然产物研究与开发,2014,26(10):1690-1695.
[ 9 ] WANG Y,LIU Y,ZHANG XY,et al.Ginsenoside Rg1 re- gulates innate immune responses in macrophages through differentially modulating the NF-κB and PI3K/Akt/mTOR pathways[J]. Int Immunopharmaco,2014,23(1):77-84.
[10] 郑祖国,张评浒.细胞自噬形成机制及其功能研究进展[J].中国细胞生物学学报,2016,38(12):1541-1548.
[11] 邢君娜,王金丽,何新新,等.胸腺上皮细胞自噬在T细胞分化发育中的研究进展[J].中国免疫学杂志,2020,36(2):254-258.
[12] 白玉洁,郑厚胜,王英平,等.人参免疫调节作用研究进展[J].特产研究,2019,41(1):99-103.
[13] 张妍,林昌岫,邵玉健,等.轮叶党参粗多糖对体外培养小鼠脾淋巴细胞及RAW 264.7细胞的免疫活性[J].食品工业科技,2018,39(12):311-315.
[14] 于思文,张妍,田海玲,等.黄精粗多糖对体外培养小鼠脾淋巴细胞及巨噬细胞免疫活性的影响[J].延边大学医学学报,2019,42(2):107-110.
[15] 朱科学,聂少平,李文娟,等.黑灵芝多糖对小鼠脾淋巴细胞增殖及诱生细胞因子的影响[J].食品科学,2010,31(19):351-354.
[16] PARZYCH KR,KLIONSKY DJ. An overview of autophagy:morphology,mechanism,and regulation[J]. Antioxid Redox Signal,2014,20(3):460-473.
[17] LUO B,QUE ZJ,ZHOU ZY,et al. Feiji Recipe inhibits the growth of lung cancer by modulating T-cell immunity through indoleamine-2,3-dioxygenase pathway in an orthotopic implantation model[J]. J Integr Med,2018,16(4):283-289.
[18] 高焕,王德云,郭利伟,等.淫羊藿多糖脂质体对鸡淋巴细胞增殖及IL-2、IL-4和IFN-γ mRNA表达的影响[J].畜牧兽医学报,2013,44(1):115-121.
[19] WU F,ZHOU C,ZHOU D,et al. Structure characterization of a novel polysaccharide from Hericium erinaceus fruiting bodies and its immunomodulatory activities[J]. Food Funct,2018,9(1):294-306.
[20] JI G,CHEN R,ZHENG J. Macrophage activation by polysaccharides from Atractylodes macrocephala Koidz through the nuclear factor-kappa B pathway[J]. Pharm Biol,2015,53(4):512-517.
[21] LIU Y,HO RC,MAK A. Interleukin(IL)-6,tumour necrosis factor alpha(TNF-alpha) and soluble interleukin-2 receptors(sIL-2R) are elevated in patients with major depressive disorder:a meta-analysis and metaregression[J]. J Affect Disorders,2012,139(3):230-239.
[22] 屈岭,梁晓春.自噬对糖尿病慢性并发症的影响[J].基础医学与临床,2013,33(5):631-634.
[23] 饶小娟,吴毓敏,王彦.麦冬皂苷介导AMPK/Akt/mTOR通路对糖尿病大鼠心肌细胞自噬的影响[J].中国循证心血管医学杂志,2018,10(11):1362-1367.
[24] GUAN F,DING Y,ZHANG Y,et al. Curcumin suppres- ses proliferation and migration of MDA-MB-231 breast cancer cells through autophagy dependent Akt degradation[J]. PLoS One,2016. DOI:10.1371/journal.pone. 0146553.
[25] XUE JF,SHI ZM,ZOU J,et al. Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J]. Biomed Pharmaco Ther,2017,89(17):1252-1261.
[26] ZHANG Y,LING Y,YANG L,et al. Liraglutide relieves myocardial damage by promoting autophagy via AMPK- mTOR signaling pathway in zucker diabetic fatty rat[J]. Mol Cell Endocrinol,2017,448(17):98-107.
[27] WU DJ,ADAMoPOULOS IE. Autophagy and autoimmunityr[J]. Clin Immunol,2017. DOI:10.1016/journal.clim. 2017.01.007.
[28] DOWLING SD,MACIAN F. Autophagy and T cell meta- bolism[J]. Cancer Lett,2018. DOI:10.1017/journal.canlet. 2018.01.033.
[29] YUE Z,JIN S,YANG C,et al. Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J]. Proc Natl Acad Sci U S A,2003,100 (25):15077-15082.
[30] KUMA A,MATSUI M,MIZUSHIMA N. LC3,an autophagosome marker,can be incorporated into protein aggregates independent of autophagy:caution in the interpretation of LC3 localization[J]. Autophagy,2007,3(4):323-328.
[31] LI W,ZOU W,YANG Y,et al. Autophagy genes function sequentially to promote apoptotic cell corpse degradation in the engulfing cell[J]. J Cell Biol,2012,197(1):27-35.
[32] BU T,WANG C,JIN H,et al. Organic anion transporters and PI3K-AKT-mTOR pathway mediate the synergistic anticancer effect of pemetrexed and rhein[J]. J Cell Phy- siol,2020,235(4):3309-3319.
(收稿日期:2020-05-22 修回日期:2020-09-21)
(編辑:林 静)

