肾功能亢进对替考拉宁高剂量治疗方案下患者血药谷浓度的影响
唐莲 石璐 薛宏志 庄智伟 袁云龙 钱春霞 朱金伟 许晓文 朱亚松 刘纪松 沈奕 陆件
摘 要 目的:研究腎功能亢进(ARC)对替考拉宁高剂量给药方案下患者血药谷浓度的影响。方法:前瞻性收集2018年7月至2020年6月南京医科大学附属苏州医院/苏州市立医院重症监护室中目标性治疗使用替考拉宁高剂量方案的患者,根据矫正肌酐清除率分为ARC组和肾功能正常组。两组患者的替考拉宁给药方案均为负荷剂量600 mg,q12 h×3剂,维持剂量6~10 mg/kg,qd,并结合肌酐清除率及血药谷浓度调整给药剂量。采用高效液相色谱法测定两组患者在替考拉宁第4剂给药前30 min和第8~10剂给药前30 min的血药谷浓度,对比两组患者替考拉宁血药谷浓度、临床有效率、革兰氏阳性菌清除率及不良反应发生情况。结果:共纳入56例患者,18例纳入ARC组、38例纳入肾功能正常组。ARC组患者较肾功能正常组患者更年轻(P<0.001),血清白蛋白水平更低(P=0.025)。ARC组患者第4剂给药前和第8~10剂给药前血药谷浓度均低于肾功能正常组(P=0.034;P=0.035)。ARC组和肾功能正常组患者的第8~10剂给药前血药谷浓度均高于同组第4剂给药前血药谷浓度(P=0.003;P<0.001)。ARC组临床有效率为77.8%、革兰氏阳性菌清除率为76.2%,均较肾功能正常组低,但差异无统计学意义(P=0.195;P=0.223)。两组患者均未出现肝功能损害、血细胞减少、过敏反应等情况,但肾功能正常组有1例患者的急性肾损害与替考拉宁用药的因果关系被评定为“很可能”。结论:ARC患者更年轻、多数存在低蛋白血症,其在替考拉宁高剂量治疗方案下的血药谷浓度较肾功能正常者显著降低。建议对危重症感染的ARC患者宜加大替考拉宁负荷剂量以使其血药谷浓度快速达标。
关键词 肾功能亢进;替考拉宁;高剂量;血药谷浓度;临床疗效
ABSTRACT OBJECTIVE: To study the effects of augmented renal clearance (ARC) on blood trough concentration of patients receiving high-dose regimen of teicoplanin. METHODS: Patients who received high-dose regimen of teicoplanin in the ICU were prospectively collected from the Affiliated Suzhou Hospital of Nanjing Medical University/Suzhou Municipal Hospital during Jul. 2018-Jun. 2020. They were divided into ARC group and normal renal function group according to corrected creatinine clearance. The dosage regimen of teicoplanin in the two groups were loading dose of 600 mg, q12 h×3 doses, maintenance dose of 6-10 mg/kg, qd, and the dosage was adjusted in combination with creatinine clearance rate and blood trough concentration. The trough concentration of blood samples which were collected 30 min before the 4th and 8th-10th dosage of teicoplanin were determined by HPLC. Trough concentration, clinical efficacy, Gram-positive bacterial clearance rate and the occurrence of ADR were compared between 2 groups. RESULTS: A total of 56 patients were included and divided into ARC group (18 cases) and normal renal function group (38 cases). ARC group had younger age (P<0.001) and lower serum albumin level (P=0.025) than normal renal function group. The trough concentrations before administration of the 4th and 8th-10th dosage in ARC group were lower than normal renal function group (P=0.034; P=0.035). The trough concentrations in the ARC group and normal renal function group before 8th-10th dosage were all higher than 30 min before the 4th dosage (P=0.003; P<0.001). The clinical efficacy rate and the clearance rate of Gram-positive bacteria in ARC group were 77.8% and 76.2%, which were lower than those of the normal renal function group, but there was no statistical difference (P=0.195; P=0.223). There was no liver function damage, hemocytopenia and allergic reaction in both groups, but in the normal renal function group, the causal relationship between acute renal damage and teicoplanin was assessed as “very likely” in one patient. CONCLUSIONS: ARC patients are younger, most of them have hypoproteinemia, and the blood trough concentrations of teicoplanin in high-dose regimen are significantly lower than those of normal renal function patients. For critical ill ARC patients, it is advisable to increase the loading dose of teicoplanin to make the trough concentration reach the target concentration range quickly.
KEYWORDS Augmented renal clearance; Teicoplanin; High dosage; Blood trough concentration; Clinical efficacy
肾功能亢进(ARC)是危重症患者肾功能增强的一种表现,目前定义为肌酐清除率超过130 mL/(min·1.73 m2)[1-2]。ARC增加了肾脏对药物的清除,并对原型经肾脏排泄的抗菌药物的血药浓度有显著影响,因此需考虑在ARC患者中使用更高的给药剂量[3-4]。替考拉宁是糖肽类抗菌药物,广泛用于治疗耐药革兰氏阳性菌感染,而且对耐甲氧西林金黄色葡萄球菌感染及肠球菌感染与万古霉素一样有效,该药的主要优势为组织穿透性好、肾毒性较低[5]。替考拉宁的血药谷浓度与临床疗效密切相关,其药品说明书及临床应用剂量专家共识推荐:对一般感染者,替考拉宁血药谷浓度应达到10 mg/L以上;而对于严重的革兰氏阳性菌感染者,替考拉宁的血药谷浓度需达到15~30 mg/L[5-6]。更新后的替考拉宁说明书推荐:一般感染者,采用负荷剂量6 mg/kg,q12 h×3~5剂;而对于脓毒血症、骨和关节感染以及感染性心内膜炎等危重症感染、严重耐药菌感染者,起始负荷剂量方案为12 mg/kg,q12 h×3~5剂[6]。肾功能状态不同对药物的清除速度也会有所不同,因此从理论上讲ARC状态可影响替考拉宁的血药浓度。目前,尚未见有关ARC患者使用替考拉宁的治疗药物监测(TDM)研究,针对ARC患者的替考拉宁最优给药方案还未知。鉴于此,本研究前瞻性地收集替考拉宁目标性抗感染治疗的ARC患者和肾功能正常的患者,对其血药浓度监测结果和临床疗效进行比较分析,为ARC患者的替考拉宁个体化用药调整提供参考依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准
(1)经临床医师确诊为革兰氏阳性菌引起感染者,感染性疾病包括呼吸道感染、血流感染、导管相关感染、感染性心内膜炎、中性粒细胞减少伴发热、骨关节感染、腹腔感染、皮肤软组织感染等;(2)静脉使用替考拉宁抗感染治疗者;(3)年龄≥18岁者;(4)肌酐清除率≥50 mL/(min·1.73 m2)者;(5)测定了替考拉宁第4剂和第8~10剂给药前血药谷浓度者。
1.1.2 排除标准
(1)使用替考拉宁后3 d内死亡者;(2)行连续性肾脏替代治疗(CRRT)者;(3)替考拉宁用药时间≤7 d者;(4)替考拉宁用药期间数据收集不全、无法评价疗效和安全性者。
1.2 研究对象
本研究前瞻性地收集2018年7月至2020年6月南京医科大学附属苏州医院/苏州市立医院重症监护室中目标性治疗使用替考拉宁高剂量方案的患者,按照“1.1”项下标准筛选纳入符合要求的研究对象。根据患者用药前肌酐水平,采用Cockcroft-Gault公式估算出其内生肌酐清除率[肥胖患者(体质量指数>30)按瘦体质量公式计算][7-8],并经体表面积矫正后得到矫正肌酐清除率[内生肌酐清除率×体表面积 (m2)/1.73 m2]。矫正肌酐清除率>130 mL/(min·1.73 m2)的患者划分入ARC组,矫正肌酐清除率为50~130 mL/(min·1.73 m2)的患者划分入肾功能正常组。本研究已通过南京医科大学附属苏州医院/苏州市立医院伦理委员会批准,并与每位患者或其家属签订了知情同意书。
1.3 治疗方法及指标记录
两组患者均静脉使用注射用替考拉宁[规格:200 mg,批准文号:国药准字J20171006,生产商:意大利Sanofi S.p.A公司,分装企业:赛诺菲(北京)制药有限公司)]进行抗感染治疗。两组用药方案相同:负荷剂量均为600 mg,q12 h×3剂;维持剂量均为6~10 mg/kg,qd[根据第4剂前血药谷浓度是否达标(目标血药谷浓度为10~30 mg/L)来调整维持剂量]。记录患者一般临床资料、临床感染症状与体征、感染性诊断、感染部位、病原学检查结果(包括替考拉宁药敏试验结果)、影像学检查结果、替考拉宁给药时间和剂量、替考拉宁血药谷浓度数据和血液采样时间以及用药前后患者体温、血常规、生化指标、炎症指标等。
1.4 替考拉宁血药谷浓度测定
两组患者均于替考拉宁第4剂给药前30 min和第8~10剂给药前30 min取血4 mL,置于含EDTA的抗凝管中,以12 000 r/min离心10 min,取上清液,置于 -80 ℃条件下保存。采用高效液相色谱(HPLC)法测定不同时间点的替考拉宁血浆谷浓度[9]。色谱条件:色谱柱为Waters Symmetry C18(250 mm×4.6 mm,5 μm),流动相为0.01 mol/L NaH2PO4溶液(pH 3.3)-乙腈(75 ∶ 25,V/V),流速为1.0 mL/min,检测波长为240 nm,柱温为35 ℃,进样量为20 μL。
1.5 患者疗效分析及不良反应情况观察
从患者临床症状、体征、影像学和实验室检查4个方面评估临床疗效,并观察其不良反应发生情况。根据《抗菌药物临床试验技术指导原则》[10],抗菌药物临床疗效评价标准为:按临床治愈和临床无效进行评定。细菌学疗效判断标准:按病原菌清除、假定清除、假定未清除、其他进行评定,以清除和假定清除计算细菌清除率。将药品不良反应根据因果关系判定為肯定、很可能、可能、可能无关、待评价、无法评价6级,前三者计为发生药品不良反应。
1.6 统计学方法
采用SPSS Statistics 22.0统计学软件进行数据分析。计量资料若符合正态分布,则以x±s表示,采用独立样本t检验;如不符合正态分布,则以中位数(四分位数间距)[M(P25,P75)]表示,采用独立样本秩和检验。计数资料以频数和百分数表示,采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 患者一般临床资料
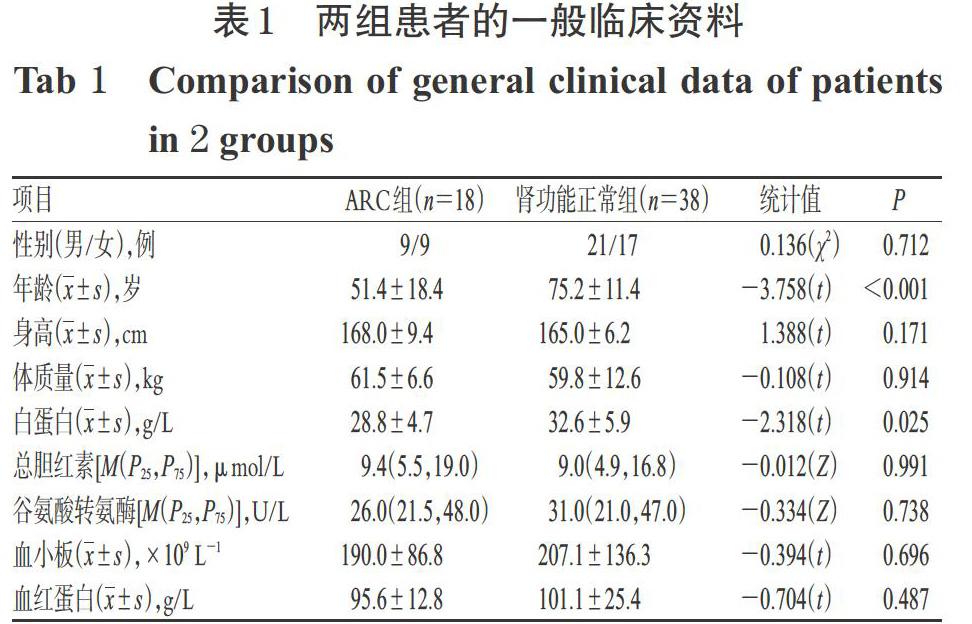
本研究最终纳入56例有效病例,其中ARC组18例、肾功能正常组38例。与肾功能正常组比较,ARC组患者更年轻(P<0.001),血清白蛋白水平更低(P<0.05),其余各项资料差异均无统计学意义(P>0.05)。两组患者一般临床资料见表1。
2.2 患者感染部位及病原学检查指标分布情况
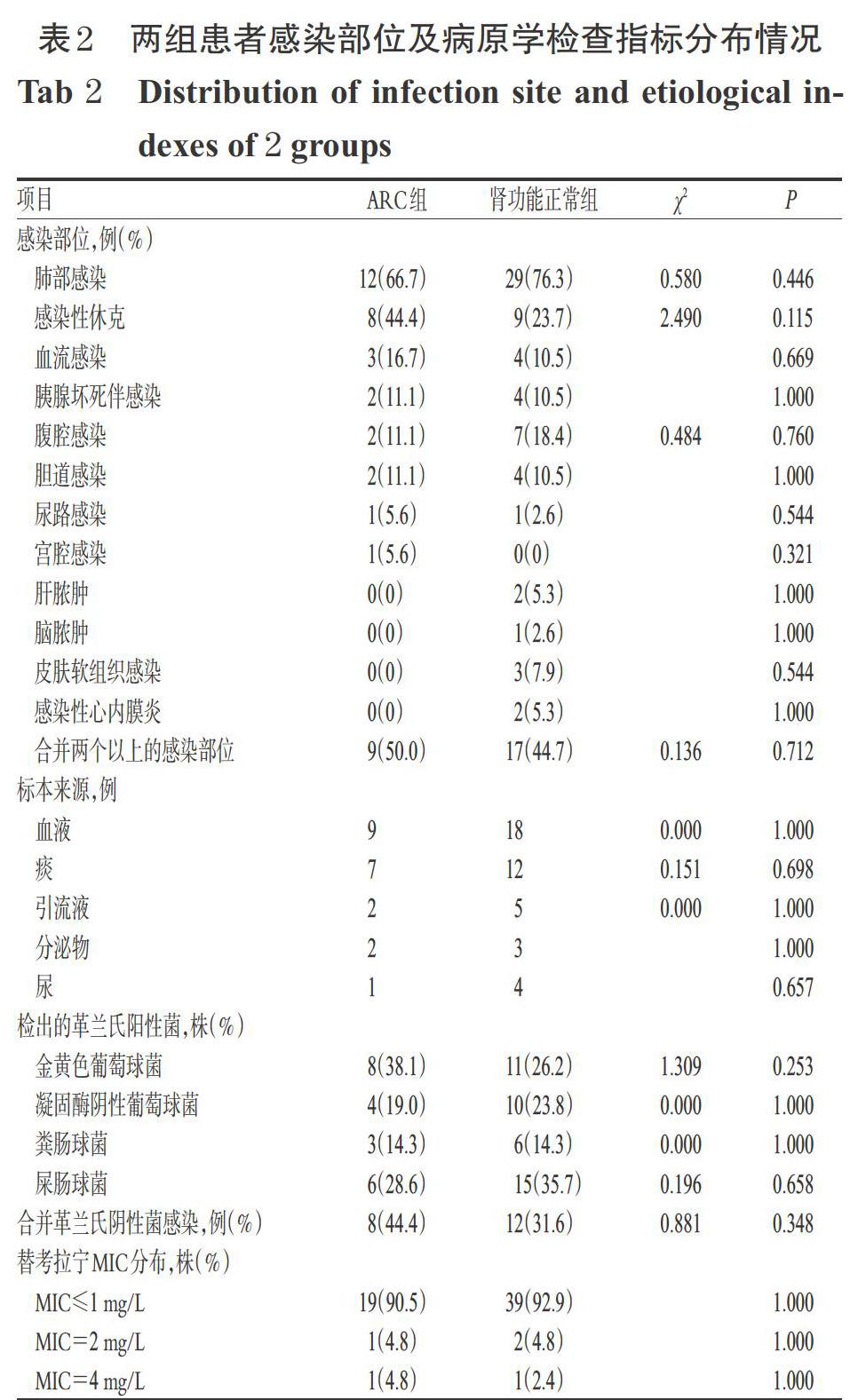
两组患者均以肺部感染为主,其他部位感染还有血流感染、腹腔感染、胰腺坏死伴感染、胆道感染等,感染部位分布在两组患者间差异均无统计学意义(P>0.05)。ARC组患者感染性休克发生率较肾功能正常组高,但差异无统计学意义(P>0.05)。ARC组和肾功能正常组患者分别检出21、42株革兰氏阳性菌,其中病原学标本均以血标本和痰标本为主,其他标本还有引流液、分泌物、尿液标本。检出菌种主要为肠球菌属、金黄色葡萄球菌和凝固酶阴性葡萄球菌。药敏报告中替考拉宁最小抑菌浓度(MIC)分布主要为MIC≤1 mg/L,有3株(松鼠葡萄球菌1株、金黄色葡萄球菌2株)MIC=2 mg/L,2株(均为屎肠球菌)MIC=4 mg/L。ARC组和肾功能正常组患者中各有8例(44.4%)和12例(31.6%)合并革兰氏阴性菌感染。两组患者感染部位及病原学检查指标分布情况见表2。
2.3 替考拉宁血药谷浓度分布
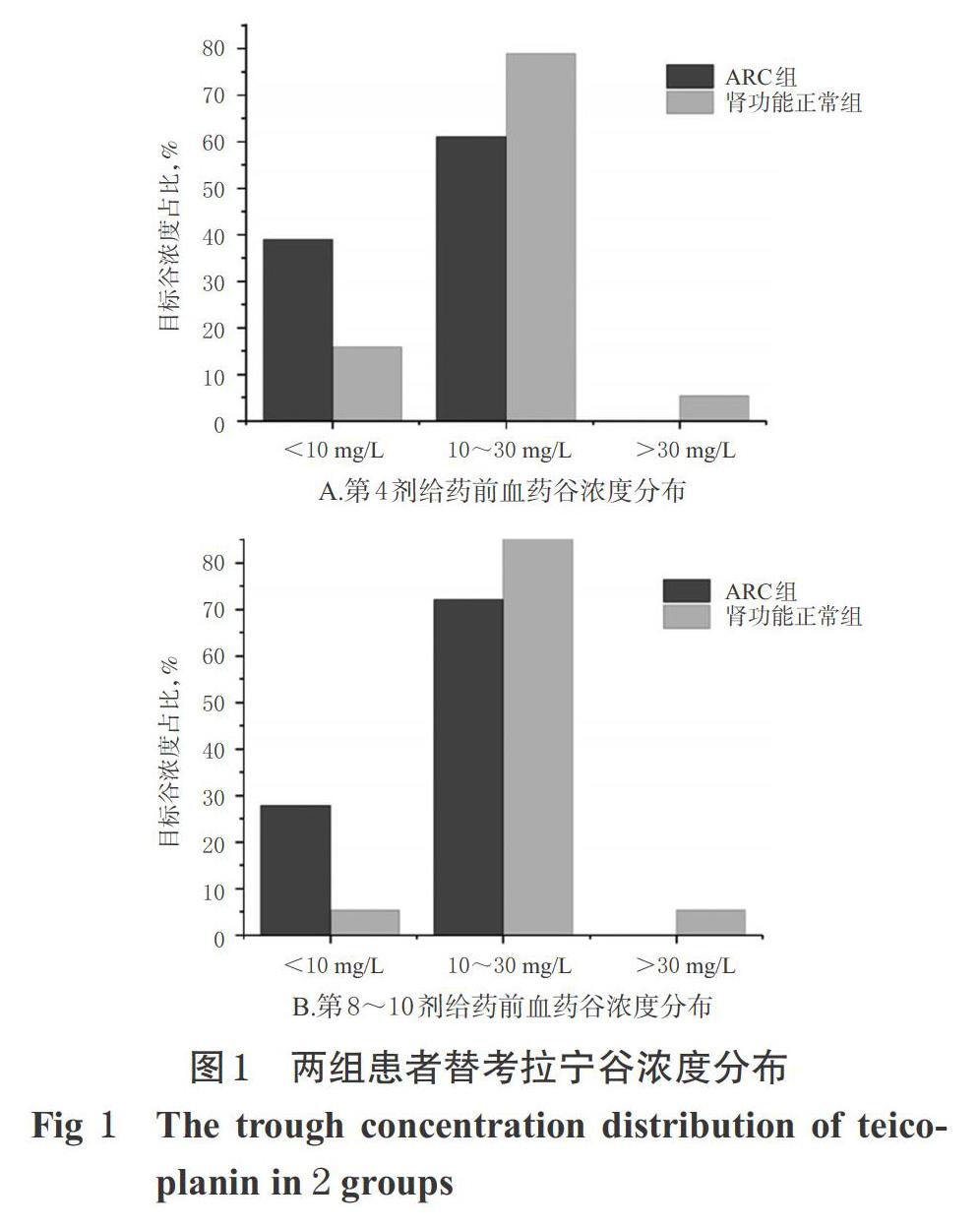
ARC组患者第4剂给药前和第8~10剂给药前血药谷浓均低于肾功能正常组[第4剂给药前:(11.8±5.1) mg/L vs. (15.8±6.6) mg/L,t=-2.183,P=0.034;第8~10剂给药前:(14.3±6.4) mg/L vs. (18.9±7.7) mg/L,t=-2.172,P=0.035]。另外,ARC组和肾功能正常组患者第8~10剂给药前的血药谷浓度均较同组第4剂给药前高(P=0.003;P<0.001)。共有12例患者根据第4剂给药前血药谷浓度对替考拉宁维持剂量进行了调整,其中有8例因血药谷浓度不达标而上调了维持剂量。ARC组患者第4剂给药前血药谷浓度和第8~10剂给药前血药谷浓度的达标率均较同时间点肾功能正常组低,但差异均无统计学意义(P=0.159;P=0.101)。两组患者替考拉宁谷浓度见图1。
2.4 疗效评价结果
ARC组和肾功能正常组患者的替考拉宁用药疗程比较,差异无统计学意义[(11.2±4.4) d vs. (11.8±4.7) d,t=-0.677,P=0.501]。在此疗程下,ARC组治愈14例、无效4例,临床有效率为77.8%;肾功能正常组治愈35例、无效3例,临床有效率为92.1%。两组的临床有效率差异无统计学意义(P=0.195)。ARC组革兰氏阳性菌清除情况为:清除12株、假定清除4株、未清除5株,清除率为76.2%;肾功能正常组革兰阳性菌清除情况为:清除26株、假定清除11株、未清除5株,清除率为88.1%。两组患者革兰氏阳性菌清除率差异无统计学意义(P=0.223)。未清除的革兰氏阳性菌分别为金黄色葡萄球菌6株、屎肠球菌4株,其中包括替考拉宁MIC=4 mg/L的1株(屎肠球菌)和MIC=2 mg/L的1株(金黄色葡萄球菌)。
2.5 安全性评价
两组患者在住院期间均未出现肝功能损害、血细胞减少、过敏反应等情况。但肾功能正常组有1例患者发生急性肾损害与替考拉宁用药的因果关系被评定为“很可能”。该例患者的基本情况及处理情况如下:性别女,年龄76岁,体质量65 kg;经消化道穿孔行剖腹探查术后因腹腔感染、感染性休克予替考拉宁(600 mg,q12 h,用药2剂;后改为600 mg,qd,用药7 d)和亚胺培南(1 g, q8 h)抗感染治疗。患者既往有心功能不全病史,医嘱予以每日液体输入量1 000~1 500 mL。患者肌酐水平从替考拉宁用药前的69 ?mol/L升至用药后第7天的122 μmol/L,同期尿量减少50%以上。经测定,患者第4剂给药前和第8~10剂给药前的替考拉宁血药谷浓度分别为36.7、43.6 mg/L。考虑患者急性肾损害可能与替考拉宁血药谷浓度超标有关,予停用替考拉宁,将亚胺培南减量为0.5 g,q6 h,同时增加补液至2 000~2 500 mL,加强利尿以增加尿量,3 d后患者肌酐水平逐渐回落至78 μmol/L。
3 讨论
3.1 替考拉宁给药剂量选择与血药浓度监测的意义
替考拉宁主要用于治疗耐甲氧西林革兰氏阳性菌感染,其作用机制是抑制细菌细胞壁合成来抑制细菌生長繁殖[11]。对于一般感染的患者,替考拉宁血药谷浓度应达到10 mg/L以上;对于严重感染(骨和关节感染、败血症、心内膜炎等)的患者,替考拉宁血药谷浓度应达到15~30 mg/L[5]。Tobin CM等[12]对替考拉宁血药浓度分析(1994-2006年)的结果显示,血药谷浓度<10 mg/L的患者比例逐年下降,从1994年的23%下降到2006年的13%;而浓度10~60 mg/L的患者比例在2006年已达到89%。该研究结果表明,部分患者需要提高替考拉宁的初始剂量或者增加其负荷剂量的使用时间。Ueda T等[13]将替考拉宁的目标血药谷浓度设定在15~30 mg/L,其中一组患者(n=78)予以替考拉宁6 mg/kg,q12 h,给药2 d后改为6 mg/kg,qd;另一组患者(n=60)予以替考拉宁10~12 mg/kg,q12 h,给药3 d后改为6 mg/kg,qd。结果显示,两组患者的血药谷浓度达标率分别为25.6%、68.3%(P<0.001)。该研究结果表明,起始负荷剂量加量后,替考拉宁血药谷浓度达标率会明显提高。石晓丽等[14]通过对51例替考拉宁使用者的血药谷浓度进行分析后发现,血药谷浓度与负荷给药剂量相关,同时与临床疗效也具有相关性,使用负荷剂量的患者血药谷浓度要明显高于使用低剂量的患者(P<0.05)。51例患者中,建议增加用药剂量的有12例,建议适当减少剂量或延长给药间隔的有5例;对血药谷浓度监测患者进行剂量调整后,患者临床治疗效果提高、不良反应发生率降低。
本研究结果显示,ARC组和肾功能正常组患者在替考拉宁高负荷剂量方案下第4剂给药前血药谷浓度迅速达标,达标率分别为61.1%、78.9%;两组在维持剂量下第8~10剂给药前血药谷浓度均有进一步升高,与第4剂给药前血药谷浓度比较,差异均有统计学意义,其中肾功能正常组患者在维持剂量下的血药谷浓度达标率近90%。以上结果说明,目前起始负荷加量的给药方案是合理的,且随着维持剂量多次给药后药物浓度具有进一步升高的可能,需要定期监测药物浓度和药物相关毒副作用,以便及时调整维持剂量。本研究中两组患者血药谷浓度的达标率比较,差异不具有统计学意义,笔者分析可能与本研究纳入的样本量小有关,还需要进一步开展大样本研究,并增加替考拉宁的负荷剂量以提高谷浓度达标率。替考拉宁静脉注射后需要较长的时间才能达到稳态血药浓度,因此临床上需要对替考拉宁血药浓度持续监测并及时调整给药剂量以保证疗效,同时要对负荷剂量进行首剂加量,以利于更快达到血药浓度。
3.2 ARC对抗菌药物药动学的影响
ARC患者较多出现在危重症患者中,国外研究发现,年龄小于50岁、创伤、序贯器官衰竭估计(SOFA)评分≤4分是ARC的高危因素[1,15-16]。这一研究结果有助于ARC患者的识别。ARC可使药物血药浓度下降,导致抗菌药物的应用变得更加复杂。有多项研究证据显示,ARC可使β-内酰胺类药物和万古霉素的暴露量下降,从而升高了临床治疗失败率[17-18]。本研究结果显示,ARC组患者更年轻、白蛋白水平更低,测定的替考拉宁第4剂给药前和第8~10剂给药前的血药谷浓度均显著低于肾功能正常组,这与其他抗菌药物在ARC患者中的研究结果[17-18]类似。替考拉宁的药动学特点为蛋白结合率(PBR)相对较高(90%~95%)[5]。有多项研究表明,低白蛋白水平可暂时增加替考拉宁的游离药物浓度,导致药物的代谢排泄加快、分布容积增加,从而导致患者的替考拉宁血药谷浓度不达标[19-20]。在本研究中,ARC组患者较肾功能正常组患者感染程度更重、感染性休克患者比例更高、白蛋白水平普遍更低,这可能也是导致ARC患者的替考拉宁血药谷浓度水平低于肾功能正常组的原因之一。ARC组患者第4剂给药前和第8~10剂给药前血药谷浓度达标率分别为61.1%和72.2%,较肾功能正常组偏低,但差异无统计学意义,这可能与本研究纳入的病例样本量少有关。从本研究结果来看,ARC组患者的替考拉宁血药谷浓度达标率不高,还有进一步提高负荷剂量和维持剂量的空间。笔者建议ARC患者可予800 mg,q12 h×3剂的负荷剂量,维持剂量为8~12 mg/kg,qd,以使血药谷浓度快速达标。
3.3 替考拉宁的临床疗效及安全性评价
本研究中肾功能正常组患者革兰氏阳性菌目标性治疗时细菌清除率和临床有效率均较高,说明替考拉宁具有良好的疗效。虽然ARC组患者的临床总有效率和革兰氏阳性菌清除率均低于肾功能正常组,但是差异均无统计学意义。两组患者在替考拉宁负荷剂量下和维持剂量下的血药谷浓度均存在显著差异,但临床疗效无显著性差异,分析原因可能有以下几方面:一方面,每组患者均有一定比例的混合菌感染,临床疗效的评价需要综合分析混合菌清除情况,需依靠联合抗感染方案的总体评价,判断较为复杂;另一方面,本研究纳入的患者均为目标性使用替考拉宁的患者,但是因多方面原因有些患者存在用药疗程不足的情况,导致无法准确评价其最终疗效;此外,本研究样本量小,还有待进一步收集患者扩大样本量后进行评价。
本研究中未清除的10株革兰氏阳性菌主要为屎肠球菌(4株)、金黄色葡萄球菌(6株),其中有2株为替考拉宁MIC较大的菌株。这表明,替考拉宁MIC较大的菌株清除较难,需要更高的血药浓度以保证临床疗效。该结果对替考拉宁用于治疗耐甲氧西林金黄色葡萄球菌、粪肠球菌以及屎肠球菌感染也具有一定的参考意义。替考拉宁血药谷浓度监测也可用于预测替考拉宁相关药物不良反应,例如本研究中有1例患者出现急性肾损害,监测发现其血药谷浓度显著升高。因此,对于谷浓度偏高者宜加强替考拉宁相关不良反应的监测,尽早调整合适的给药剂量。
4 结语
ARC患者更年轻,多存在低蛋白血症,使用替考拉宁抗感染治疗时,其血药谷浓度较肾功能正常者显著降低。为提高替考拉宁临床疗效和安全性,笔者建议ARC患者尤其是危重症感染ARC患者可予800 mg,q12 h×3剂的负荷剂量,维持剂量为8~12 mg/kg,qd,以使血药谷浓度快速达到目标值。对肾功能正常患者,给予替考拉宁高负荷剂量方案可使多数患者血药谷浓度达标,获得较好的臨床疗效。为了提高替考拉宁临床疗效的同时确保其安全性,建议对患者进行血药浓度监测并个体化给药。
参考文献
[ 1 ] BILBAO-MESEGUER I,RODRIGUEZ-GASCON A,BA- RRASA H,et al. Augmented renal clearance in critically ill patients:a systematic review[J]. Clin Pharmacokinet,2018,57(9):1107-1121.
[ 2 ] GIJSEN M,WILMER A,MEYFROIDT G,et al. Can augmented renal clearance be detected using estimators of glomerular filtration rate[J]. Crit Care,2020,24(1):359- 363.
[ 3 ] BAKKE V,SPORSEM H,VON DER LIPP E,et al. Vancomycin levels are frequently subtherapeutic in critically ill patients:a prospective observational study[J]. Acta Anaesthesiol Scand,2017,61(6):627-635.
[ 4 ] MAHMOUD SH,SHEN C. Augmented renal clearance in critical illness:an important consideration in drug do- sing[J]. Pharmaceutics,2017,9(3):1-27.
[ 5 ] 替考拉宁临床应用剂量专家共识组.替考拉宁临床应用剂量专家共识[J].中华结核和呼吸杂志,2016,39(7):500-508.
[ 6 ] 意大利Sanofi S.p.A公司.注射用替考拉宁中文说明书[S]. 2017-09-29.
[ 7 ] 龚珂,秦东芳,王学晶.肾小球滤过率测量方法的研究进展[J].中华检验医学杂志,2020,43(4):502-506.
[ 8 ] 郑明霞,郑连斌,杨茜,等.用瘦体质量、身高标准体重法评价江淮汉族肥胖标准的研究[J].南京师大学报(自然科学版),2014,37(2):101-105.
[ 9 ] 吕碧君,梁峰华,谢慧,等.替考拉宁在重症肺炎患者中的血药浓度监测与应用分析[J].中国医院药学杂志,2017,37(21):2167-2172.
[10] 《抗菌药物临床试验技术指导原则》写作组.抗菌药物临床试验技术指导原则[J].中国临床药理学杂志,2014,30(9):844-856.
[11] 文业,王定淼,陈勇,等.替考拉宁治疗ICU患者革兰阳性菌所致呼吸机相关性肺炎的临床疗效与安全性评价[J].中华医院感染学杂志,2017,27(15):3397-3400.
[12] TOBIN CM,LOVERING AM,SWEENEY E,et al. Analyses of teicoplanin concentrations from 1994 to 2006 from a UK assay service[J]. J Antimicrob Chemomer,2010,65(10):2155-2157.
[13] UEDA T,TAKESUE Y,NAKAJIMA K,et al. High-dose regimen to achieve novel target trough concentration in teicoplanin[J]. J Infect Chemother,2014,20(1):43-47.
[14] 石晓丽,周丽娟.血药浓度监测指导下的51例替考拉宁用药分析[J].中国药事,2016,30(8):832-835.
[15] COOK AM,HATTON-KOLPEK J. Augmented renal clearance[J]. Pharmacotherapy,2019,39(3):346-354.
[16] AKERS KS,NIECE KL,CHUNG KK,et al. Modified augmented renal clearance score predicts rapid piperacillin and tazobactam clearance in critically ill surgery and trauma patients[J]. J Trauma Acute Care Surg,2014,77(3 Suppl 2):S163-S170.
[17] JACOBS A,TACCONE FS,ROBERTS JA,et al. β-lactam dosage regimens in septic patients with augmented renal clearance[J]. Antimicrob Agents Chemother,2018. DOI:10.1128/AAC.02534-17.
[18] WU CC,TAI CH,LIAO WY,et al. Augmented renal clearance is associated with inadequate antibiotic pharmacokinetic/pharmacodynamic target in Asian ICU population:a prospective observational study[J]. Infect Drug Resist,2019. DOI:10.2147/IDR.S213183.
[19] ENOKIYA T,MURAKI Y,IWAMOTO T,et al. Changes in the pharmacokinetics of teicoplanin in patients with hyperglycaemic hypoalbuminaemia:impact of albumin glycosylation on the binding of teicoplanin to albumin[J]. Int J Antimicrob Agents,2015. DOI:10.1016/j.ijantimicay.
[20] BRINK AJ,RICHARDS GA,LAUTENBACH EE,et al. Albumin concentration significantly impacts on free teicoplanin plasma concentrations in non-critically ill patients with chronic bone sepsis[J]. Int J Antimicrob Agents,2015,45(6):647-651.
(收稿日期 :2020-08-15 修回日期:2020-10-01)
(編辑:林 静)

